
- DAZ.online
- DAZ / AZ
- DAZ 13/2018
- Weniger, aber nicht zu ...
Klinische Pharmazie
Weniger, aber nicht zu wenig!
Individuelle Arzneimitteldosierung bei dialysepflichtigen Patienten
Bei einem akuten Nierenversagen (ANV) stellen die Nieren aufgrund unterschiedlicher Ursachen in kurzer Zeit ihre Funktion ein; harnpflichtige Substanzen werden nicht mehr ausgeschieden, es kommt zu einer erheblichen Wassereinlagerung – unbehandelt ein lebensbedrohlicher Zustand. Die meisten ANV werden durch Verminderung des effektiven Blutvolumens verursacht, z. B. wegen Diarrhö, Sepsis oder Verbrennungen. Aber auch eine Harnabflussstörung aufgrund der Obstruktion der Harnwege (Prostatahypertrophie, Urolithiasis) oder Schädigungen der Nieren durch Medikamente oder Giftstoffe können ein ANV verursachen.
Beim chronischen Nierenversagen (CNV) verschlechtert sich die Funktion der Nieren über einen längeren Zeitraum. Durch die verminderte glomeruläre Filtrationsrate (GFR) werden harnpflichtige Substanzen nicht mehr in ausreichendem Ausmaß eliminiert, aufgrund der gestörten tubulären Funktion kann es zu Entgleisungen des Elektrolyt-, Wasser- und Säure-Basen-Haushalts kommen. Eine kausale Therapie zur Wiederherstellung der geschädigten Niere ist zurzeit nicht möglich. In den anfänglichen Stadien des CNV zielt die Therapie darauf ab, eine fortschreitende Verschlechterung der Nierenfunktion zu verhindern und die ursächlichen Faktoren zu minimieren. Eine GFR < 8 ml/min – oder < 15 ml/min bei zusätzlichen Symptomen wie Malnutrition, Urämie und Bluthochdruck – erfordert eine Dialysetherapie oder im Idealfall eine Nierentransplantation.
Intermittierende Peritoneal- und Hämodialyse
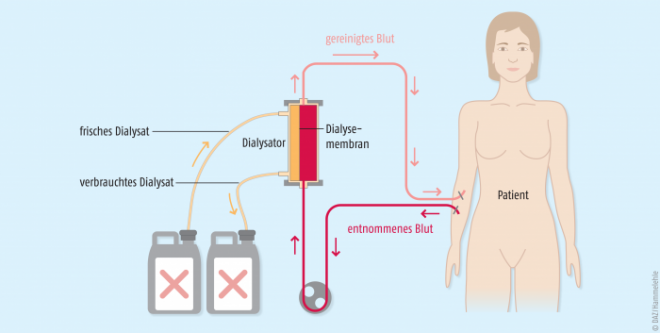
Die Dialyse ist die wichtigste Therapieform bei Nierenversagen, denn nur ein Teil der Patienten erhält die gewünschte Spenderniere. Die verschiedenen Dialysetypen gliedern sich in kontinuierliche und intermittierende Verfahren sowie in intrakorporale (Peritonealdialyse) und extrakorporale Verfahren (Hämodialyse, Hämofiltration).
Bei der Peritonealdialyse (PD) wird das gut durchblutete Bauchfell (Peritoneum) als semipermeable Dialysemembran genutzt: Die Bauchhöhle wird über einen implantierten Katheter mit der Dialyselösung gefüllt, die dann mit harnpflichtigen Substanzen nach dem Prinzip der Osmose das Bauchfell passiert und anschließend wieder abtransportiert wird. Die PD ist der Hämodialyse gleichwertig, spielt aber in Deutschland mit einem Anteil von ca. 5% an den verwendeten Dialyseverfahren eine deutlich untergeordnete Rolle.
Bei chronischer Niereninsuffizienz wird meistens die intermittierende Hämodialyse (HD) eingesetzt, deren Wirkprinzip auf der Diffusion durch eine semipermeable Membran beruht. In der Regel wird das Blut der Patienten dreimal pro Woche in einer drei- bis sechsstündigen Dialysesitzung von Elektrolyten wie Kalium und Phosphat sowie harnpflichtigen Substanzen wie Harnstoff und Kreatinin gereinigt. Große Moleküle wie Proteine und Blutzellen passieren die Membran nicht. Arzneistoffe werden nach ihren jeweiligen physikalisch-chemischen und pharmakokinetischen Eigenschaften in unterschiedlichem Ausmaß dialysiert.
Kontinuierliche Hämodialyse und Hämofiltration
Bei kritisch kranken Patienten und bei akuter Einschränkung der Nierenfunktion werden kontinuierliche Verfahren eingesetzt. Die kontinuierliche Hämodialyse (continuous venovenous hemodialysis, CVVHD) soll die Nierenfunktion gleichmäßig ersetzen. Auch hier diffundieren kleine freie Moleküle durch den Filter, während große Blutbestandteile im Blut zurückbleiben. Ein ähnliches Verfahren ist die kontinuierliche Hämofiltration (continuous venovenous hemofiltration, CVVHF). Dabei zieht ein Druckgradient im Innern der Filtereinheit Flüssigkeit aus dem Blut ab, inklusive der niedermolekularen, frei im Plasma befindlichen Substanzen. Abhängig von der Flüssigkeitsbilanz des Patienten wird die Menge an entzogenem Filtrat ganz oder teilweise vor oder nach dem Filter ersetzt (Prä- bzw. Postdilution).
Arzneimittel für typische Begleiterkrankungen von Dialysepatienten
Neben der Ausscheidung harnpflichtiger Stoffe hat die Niere eine Vielzahl an Funktionen. Sie reguliert die Ionenzusammensetzung und den pH-Wert des Blutes, hat Einfluss auf Glucosespiegel und Blutdruck, aber ist auch verantwortlich für die Produktion von Calcitriol (Vitamin D3) und Erythropoetin. Bei einem CNV kann es folglich zu einer Vielzahl an Begleiterkrankungen kommen, die sich meistens mit Arzneimitteln behandeln lassen (Tab. 1).
Indikation |
Wirkstoffgruppe |
Wirkstoff, Präparat |
|---|---|---|
Bluthochdruck |
Schleifendiuretika* |
z. B. Furosemid, Torasemid, Piretanid |
ACE-Hemmer |
z. B. Ramipril, Enalapril, Fosinopril |
|
AT1 -Rezeptor-Antagonisten |
z. B. Losartan, Valsartan, Candesartan, Irbesartan |
|
Betablocker |
z. B. Metoprolol, Bisoprolol, Carvedilol |
|
gestörter Knochenstoffwechsel |
Phosphatbinder |
Ca-haltig: z. B. Calciumacetat
Mg-haltig: z. B. Phosphosorb® Magnesium
CaCO3 + MgCO3 : z. B. OsvaRen®
Al-haltig: z. B. Aluminiumoxid (Antiphosphat®)
Ca- und Al-frei: z. B. Sevelamercarbonat
|
Vitamin D |
z. B. Alfacalcidiol, Calcitriol |
|
Calcimimetika |
z. B. Cinacalcet (Mimpara®) |
|
gestörter Säure-Basen- und Elektrolythaushalt |
Kaliumbinder |
z. B. Polystyrolsulfonat (CPS®, Resonium®, Sorbisterid®) |
Elektrolyte |
z. B. Natriumhydrogencarbonat (Nephrotrans®, Bicanorm®), Hexacalcium-hexanatrium-trihydrogenheptakiscitrat (Acetolyt®) |
|
Vitaminmangel |
Vitaminkomplex (v. a. B und C) |
z. B. Renavit®, Dreisavit® N, Carenal®
|
Anämie |
Eisen |
z. B. Ferro sanol® duodenal, Lösferron®, Ferrlecit® (i. v.), Venofer® (i. v.) |
Erythropoetin |
z. B. Epoetin alfa (Erypo®), Epoetin beta (NeoRecormon®) |
|
* zur Förderung der Restdiurese | ||
Wenn noch eine Restnierenfunktion vorhanden ist, sind hochdosierte Schleifendiuretika wie Furosemid (125 – 500 mg) oder Torasemid (z. B. 200 mg) die Mittel der Wahl, um die Volumenausscheidung zu steigern. Thiazide sind bei ausgeprägter, dialysepflichtiger Niereninsuffizienz kontraindiziert.
Zur Vorbeugung von Knochenstoffwechselstörungen dienen Phosphatbinder, Vitamin D und Calcimimetika. Hintergrund ist die Veränderung des Calciumhaushalts bei eingeschränkter Nierenfunktion und die verstärkte Freisetzung von Parathormon (sekundärer Hyperparathyreoidismus). Die Phosphatausscheidung ist verringert, der Phosphatspiegel im Blut erhöht. Die Folgen sind Knochenabbau mit Calciumfreisetzung und damit einhergehend die Verkalkung von Weichteilen und Organen.
Häufig treten bei einem CNV auch Störungen im Säure-Basen- und Elektrolythaushalt auf: Wenn die Niere Säuren und Kalium nur noch unzureichend ausscheidet und kein Hydrogencarbonat mehr bildet, übersäuert das Blut (Azidose), und die Kaliumwerte steigen an. Appetitlosigkeit, Insulinresistenz und Störungen des Knochen- und Muskelaufbaus können die Folge sein. In dieser Situation werden Hydrogencarbonat oral substituiert und Kaliumbinder eingesetzt (oder die Ernährung muss konsequent kaliumarm sein), denn erhöhte Kaliumwerte können zu lebensbedrohlichen Herzrhythmusstörungen führen.
Eine weitere wichtige Folgeerkrankung bei einem CNV ist die Anämie, da die geschädigte Niere das Erythropoetin, das die Blutbildung stimuliert, nicht mehr produziert. Aus diesem Grund werden oftmals rekombinantes Erythropoetin (Epoetin alfa, Epoetin beta) und Eisen substituiert.
Häufig werden CNV-Patienten auch spezielle Vitaminpräparate verabreicht, da durch die Dialyse vermehrt hydrophile Vitamine (B-Gruppe und C) eliminiert werden.
Hypertonie ist bei Dialysepatienten sehr verbreitet, weil aufgrund der Flüssigkeitsretention vermehrt Renin freigesetzt wird. Der Blutdruck kann in der Regel gut durch Antihypertonika kontrolliert werden.
Schwere Infektionen mit multiresistenten Erregern erfordern bei Dialysepatienten häufig eine antibiotische Therapie.
Von der urämischen Polyneuropathie – möglicherweise verursacht durch die Ablagerung von harnpflichtigen Stoffen – ist etwa jeder fünfte Dialysepatient betroffen; sie wird durch physikalische Therapiemaßnahmen behandelt.
Aspekte der Arzneimittelauswahl
Grundsätzlich muss bei Niereninsuffizienz und Restnierenfunktion auf potenziell nierentoxische Arzneistoffe verzichtet werden (z. B. Diclofenac). Arzneistoffe ohne renale Ausscheidung sind nicht kontraindiziert und werden bei entsprechender Indikation in normaler Dosierung eingesetzt (z. B. Buprenorphin). Wird ein relevanter Anteil der Substanz unverändert über die Niere ausgeschieden, ist die Dosis entsprechend der Nierenfunktion zu verringern (z. B. Tramadol); dies betrifft auch Dialysepatienten in der dialysefreien Zeit. Wenn der Arzneistoff dialysierbar ist, muss entweder die Erhaltungsdosis etwas erhöht oder nach der Dialyse eine Zusatzdosis gegeben werden.
Einfluss der Dialyseverfahren auf die Pharmakokinetik
Die Normdosierungen von Arzneistoffen werden aufgrund der kinetischen Eigenschaften bei gesunden jungen Probanden festgelegt. Im klinischen Alltag sind diese Standard-Patienten allerdings eine Rarität. So können hohes Alter, Komedikation, Körpergewicht, Organinsuffizienz und auch die Dialyse die Verteilung, Verstoffwechselung und Ausscheidung von Arzneimitteln signifikant beeinflussen.
Der Einfluss der extrakorporalen Dialyseverfahren auf die Pharmakokinetik und damit die „richtige“ Dosierung von Arzneimitteln ist Gegenstand zahlreicher Diskussionen im klinischen Alltag, denn die jeweiligen Fachinformationen und Beipackzettel enthalten meist keine oder nur spärliche Informationen dazu. Häufiger finden sich Hinweise zur Dosierung bei eingeschränkter Nierenfunktion und intermittierender Dialyse. Bücher, Tabellen, Nomogramme und Programme stehen jedoch in großer Anzahl zur Verfügung und können gute Hinweise für eine rationale empirische Dosierung geben. Die engmaschige Messung der Arzneistoffkonzentrationen im Blut (therapeutisches Drug-Monitoring, (TDM) ist bei diesen Patienten empfehlenswert. Klinisch relevante Einflüsse durch die Dialyse sind zu erwarten bei
- geringer Proteinbindung der Arzneistoffe,
- hohen Dosen bei kleinem Verteilungsvolumen (< 0,6 l/kg) und
- niedriger (Rest-)Körper-Clearance.
Umgekehrt findet sich bei Wirkstoffen mit hoher Gesamtkörper-Clearance (z. B. durch starke hepatische Elimination), großem Verteilungsvolumen (> 1 l/kg), niedrigen Dosen und hoher Proteinbindung (> 75%) in der Regel keine klinisch relevante Elimination durch ein Dialyseverfahren.
Individuelle Dosierung bei intermittierender Hämodialyse
Bei niereninsuffizienten Patienten muss die Dosis renal eliminierter Arzneistoffe reduziert werden, da sie sonst kumulieren würden. Im Allgemeinen wird die Einzeldosis reduziert, während das Dosisintervall unverändert bleibt. Sind die Grenzen der Dosisreduktion erreicht (z. B. weil Tabletten nicht weiter teilbar oder entsprechende Ampullenstärken nicht verfügbar sind), kann das Dosisintervall verlängert werden.
Bei Patienten mit intermittierender Dialyse bietet es sich an, ein Arzneimittel mit zweimal täglicher Gabe am Morgen und am Abend zu verabreichen. Bei einmal täglicher Gabe wird die Applikation etwa zwölf Stunden vor der Dialyse bevorzugt (Dialyse am Morgen: abendliche Gabe; Dialyse am Nachmittag oder Abend: morgendliche Gabe). Teilweise ist es sogar möglich, die Applikation der Arzneimittel nur auf die Dialysetage zu beschränken. Wird ein Arzneistoff in relevantem Umfang dialysiert, muss zu jeder Dialyse eine Zusatzdosis verabreicht werden. Die optimale Form der Zusatzdosis ist die kontinuierliche Infusion der zusätzlich ausgeschiedenen Arzneistoffmenge während der Dialyse. Dadurch wird der Dialysatverlust gleichmäßig ausgeglichen und der Serumspiegelverlauf nicht durch die Dialyse beeinflusst.
Bei einer Zusatzdosis mit schneller Freisetzung (v. a. intravenös, eventuell auch oral) ist es eine gute Option, die eine Hälfte zu Beginn und die andere Hälfte ungefähr zur Mitte der Dialyse zu verabreichen. Die Zusatzdosis retardierter Arzneiformen wird zu Beginn der Dialyse gegeben, um einen Abfall des Serumspiegels in subtherapeutische Bereiche während der Dialyse zu vermeiden. Alternativ kann aber auch in vielen Fällen, insbesondere wenn die Erhaltungsdosis nur einmal täglich gegeben wird und die notwendige Zusatzdosis relativ gering ist, die Arzneimittelgabe auf den Zeitpunkt direkt nach der Dialyse gelegt werden und unter Umständen sogar auf eine Zusatzdosis verzichtet werden.
Individuelle Dosierung bei kontinuierlicher Dialyse
Im Gegensatz zur chronischen Niereninsuffizienz ist ein akutes Nierenversagen – z. B. infolge eines septischen Schocks – nach adäquater Therapie bei der Mehrzahl der Patienten reversibel. Die Auswahl der Arzneistoffe orientiert sich hier weniger an den pharmakokinetischen Eigenschaften als am klinischen Nutzen. In der prädialytischen Phase muss die Dosierung nierenpflichtiger Arzneistoffe an die noch vorhandene Nierenfunktion angepasst werden. Bezogen auf die pharmakokinetischen und -dynamischen Parameter der antiinfektiven Therapie bedeutet dies:
- für zeitabhängig bakterizide Substanzen (z. B. Betalactame, Cephalosporine, Carbapeneme, Linezolid, Makrolide) eine Dosisreduktion bei möglichst gleichbleibenden Dosisintervallen und
- für konzentrationsabhängig bakterizid wirkende Arzneistoffe (z. B. Aminoglykoside, Chinolone) eine gleichbleibende Einzeldosis bei verlängerten Dosisintervallen.
Mit Beginn des Dialyseverfahrens muss die zusätzliche Elimination der verabreichten Arzneistoffe über das Dialysat/Filtrat in der Dosierungsstrategie berücksichtigt werden. Zur hepatischen und renalen Rest-Clearance addiert sich die CRRT-Clearance als eigenständiger Eliminationsweg. Besonders hydrophile Substanzen mit geringem Verteilungsvolumen und geringer Proteinbindung werden in relevantem Ausmaß aus dem Blut entfernt. Aber auch die Geräteeinstellungen wie der Dialysat- oder Filtratfluss (und die Prä- oder Postdilution im Falle einer Hämofiltration) spielen eine bedeutsame Rolle. Bei kontinuierlich infundierten Arzneistoffen wird die Infusionsrate um die Menge gesteigert, die zusätzlich aus dem Blut entfernt wird. Bei intermittierend verabreichten Arzneistoffen kann eine Verkürzung des Dosisintervalls nötig sein, solange der Patient dialysiert wird.
Wenn sich die Nierenfunktion regeneriert, sind die Dosierungsschemata erneut zu evaluieren und an die jeweils aktuelle Nierenfunktion anzupassen. Auf keinen Fall dürfen Dosisempfehlungen für die intermittierende Hämodialyse auf die kontinuierlichen Verfahren übertragen werden.
Informationsquellen
Die Fachinformationen und Beipackzettel der Präparate enthalten meist keine oder nur spärliche Informationen zur optimalen Dosierung bei kontinuierlichen Dialyseverfahren. Häufiger finden sich Hinweise zur Dosierung bei eingeschränkter Nierenfunktion und intermittierender Dialyse. Viele Studien zu Dosiervorschlägen entstanden allerdings in den 1980- und 1990er-Jahren und beziehen sich daher auch nur auf die damaligen Dialysepraktiken, die teilweise eine geringere Arzneistoff-Clearance als die heutigen Methoden erzielten. Im klinischen Alltag werden deshalb häufig Listen mit Dosierempfehlungen für dialysepflichtigen Patienten verwendet (z. B. „Ulmer Liste“, „Freiburger Liste“). Dabei werden allerdings entscheidende Kriterien wie Dialysatfluss, Blutfluss, Dialysedauer oder Restnierenfunktion nicht individuell berücksichtigt.
Die Standardquelle zur Dosierung bei Niereninsuffizienz und Dialysepatienten ist das Renal Drug Handbook von Caroline Ashley und Aileen Dunleany [1]. Darin finden sich zahlreiche Arzneistoffdosierungen für CAPD (continuous ambulatory peritoneal dialysis), HD (intermittierende Hämodialyse), HDF (Hämodiafiltration), CVVHD/HF (continuous venovenous haemodialysis/haemofiltration) und CAVHD/HF (continuous arteriovenous haemodialysis/haemofiltration).
Dosierungsvorschläge bei eingeschränkter Nierenfunktion ohne Dialyse lassen sich auf der Website www.dosing.de der Heidelberger Pharmakologie berechnen [4].
Am Klinikum Heidenheim wurde ein Algorithmus entwickelt, der verschiedene Parameter bei Dialyseverfahren berücksichtigt [3]. Das Programm CADDy (www.thecaddy.de) ist nach vorheriger Registrierung frei zugänglich. Es ermöglicht die Anpassung der Dosierungen von rund 250 Wirkstoffen bei vier verschiedenen Dialyseverfahren jeweils gemäß der Restnierenfunktion und der Dialyseeinstellungen. Im Programm ist außerdem ersichtlich, ob Niereninsuffizienz und Dialyse überhaupt einen Einfluss auf die Elimination der Arzneistoffe haben. Dosierungsberechnungen zu Arzneimitteln, die nicht in der Datenbank enthalten sind, sind nach der Eingabe pharmakokinetischer Basisdaten ebenfalls möglich.
Speziell für die Dosierung von Antiinfektiva in der Intensivmedizin ist zu berücksichtigen, dass die vorgeschlagene Tagesdosis nicht die Initialdosis enthält, die zur Aufsättigung und schnellen Wirkung mancher Substanzen benötigt wird. Problematisch ist lediglich die Dosierung bei Patienten mit stark eingeschränkter Leberfunktion (Verlust der metabolischen Kapazität). Hierfür können aufgrund fehlender quantitativer Tests keine adäquaten Vorhersagen getroffen werden. Für Substanzen, die vor allem renal eliminiert werden, spielt dies jedoch eine untergeordnete Rolle.
Zwei Patientenfälle
Ein 57-jähriger anurischer Patient (170 cm, 73 kg) mit intermittierender (täglicher) Hämodialyse erhielt wegen einer nosokomial erworbenen Pneumonie mit einem unbekanntem Erreger eine Meropenem-Therapie.
Nierengesunde erhalten 3000 mg/d Meropenem i.v. (Ziel-Serumspiegel > 8 mg/l). Meropenem wird bei ihnen zu ca. 70% renal eliminiert und liegt nur zu 2% proteingebunden vor. Das Verteilungsvolumen ist mit ca. 0,3 l/kg relativ gering.
Bei Patienten mit Niereninsuffizienz wird eine deutliche Dosisreduktion empfohlen. Da Substanz durch eine Hämodialyse effektiv eliminiert wird, muss in diesem Fall die Dosis wieder etwas erhöht werden.
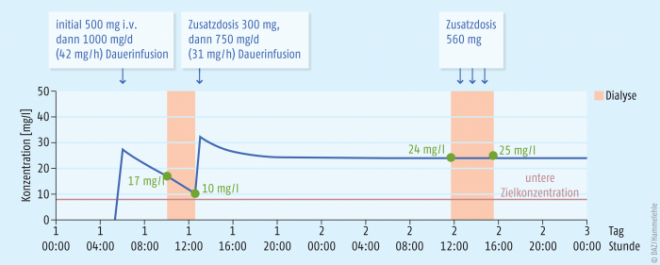
Der Patient erhielt initial 500 mg i.v., dann eine Dauerinfusion von 1000 mg/d (42 mg/h). Während der Dialyse sank der Serumspiegel von 17 mg/l auf 10 mg/l. Dieser Verlust wurde mit einer Gabe von 300 mg ausgeglichen. Die weitere Erhaltungsdosis betrug 750 mg/d (31 mg/h). Während der nächsten Dialyse wurden zusätzlich 560 mg kontinuierlich infundiert, um den Meropenem-Serumspiegel konstant zu halten (vor Dialyse 24 mg/l, nach Dialyse 25 mg/l).
Eine 80-jährige anurische Patientin (170 cm, 105 kg) mit intermittierender Hämodialyse (jeden zweiten Tag) erhielt wegen einer Protheseninfektion mit unbekannten Erregern Vancomycin CP intravenös und Tavanic® (Levofloxacin) oral.
Die Levofloxacin-Tagesdosis für Nierengesunde beträgt 500 mg (bis 1000 mg); dabei werden Konzentrationen von 2 bis 5 mg/l angestrebt. Levofloxacin wird zu über 85% unverändert über die Niere ausgeschieden; die Plasmaproteinbindung liegt bei ca. 35% und das Verteilungsvolumen bei ca. 1,3 l/kg – deutlich mehr als bei Meropenem. Die Dialysierbarkeit von Levofloxacin ist geringer als bei Meropenem.
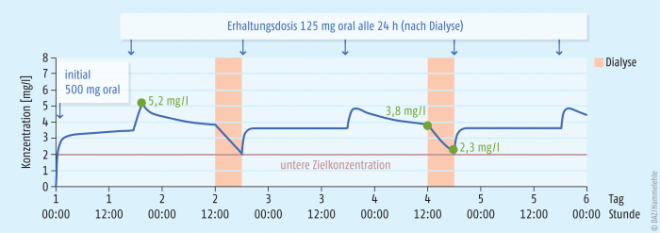
Zur schnellen Aufsättigung wurden der Patientin initial 500 mg Levofloxacin verabreicht, danach als Erhaltungsdosis 125 mg alle 24 h (an jedem zweiten Tag direkt nach der Dialyse). Die Erhaltungsdosis und das Dosierintervall blieben über den ganzen Therapiezeitraum gleich.
Fazit
Die steigende Anzahl an Dialysepatienten mit einer ihrer Multimorbidität geschuldeten Polymedikation stellt eine große Herausforderung dar. Keines der verschiedenen modernen Dialyseverfahren kann die gesunde Niere mit ihren vielfältigen Aufgaben völlig ersetzten. Die chronische Dialyse ist aufgrund des enormen Zeitaufwands und der zahlreichen Folgeerkrankungen mit einer deutlichen Beeinträchtigung der Lebensqualität des Patienten verbunden. Insbesondere die adäquate, der aktuellen Nierenfunktion und dem gewählten Dialyseverfahren angepasste Arzneimitteldosierung ist eine wichtige Aufgabe für den Pharmazeuten im therapeutischen Team. |
Literatur
[1] Ashley C et al. The Renal Drug Handbook. Radcliffe Medical Press Oxford, 4. ed. 2014
[2] Brinkmann A et al. Therapeutisches Drug-Monitoring in der antiinfektiven Therapie. Krankenhaushygiene up2date 2017;12(1):59-71
[3] CADDy. Calculator to Approximate Drug-Dosing in Dialysis; www.thecaddy.de
[4] DOSING. Informationen zur Arzneimittel-Anwendung & -Sicherheit; www.dosing.de
[5] Haag-Weber M. Hämodialyse vs. Peritonealdialyse. Dialyse aktuell 2016;20(9):455-459
[6] Hartmann B et al. Drug therapy in patients with chronic renal failure. Dtsch Arztebl Int 2010;107(37):647-655
[7] Keller CK et al. Akutes Nierenversagen. Praxis der Nephrologie. Springer Berlin/Heidelberg 2010: 181-198
[8] Klein S et al. Status quo und Zukunft der Heimdialyse. Nomos Baden-Baden 2014
[9] McMillan JI. MSD Manual Chronische Nierenkrankheiten; www.msdmanuals.com/de-de/profi/urogenitaltrakt/chronische-nierenkrankheiten/chronische-nierenkrankheiten
[10] Pharkin. Heidenheimer Pharmakokinetikprogramm; www.pharkin.de
[11] Röhr A, Bassermann U. Pharmakokinetik gelebt – Simulationsprogramme und Dosierungstools zur Dosisanpassung. Pharm Ztg Prisma 2017;24(3):137-145
[12] Röhr A et al. Anti-infective drugs during continuous hemodialysis – using the bench to learn what to do at the bedside. Int J Artif Organs 2015;38(1):17-22
[13] Tast C et al. Medikamente für Dialysepatienten. Projekt E GmbH Esslingen, 5. Auflage 2014
[14] UK Medicines Information (UKMi). What factors need to be considered when dosing patients on renal replacement therapies? www.sps.nhs.uk/articles/what-factors-need-to-be-considered-when-dosing-patients-on-renal-replacement-therapies-2
[15] UpToDate. Drug removal in continuous renal replacement therapy; www.uptodate.com
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.