
- DAZ.online
- DAZ / AZ
- DAZ 7/2017
- Stoffwechsel fein ...
Schwerpunkt Schilddrüse
Stoffwechsel fein justiert
Wie Mikronährstoffe die Schilddrüsenfunktion beeinflussen

Iod
Iod-Versorgung in der Schwangerschaft. Eine adäquate Iod-Versorgung als Voraussetzung für eine normale Schilddrüsenfunktion werdender Mütter ist für die kindliche Entwicklung außerordentlich wichtig. Eine unzureichende Versorgung erhöht das Risiko für Fehl- und Frühgeburten. Erst ab der 12. Schwangerschaftswoche ist der fetale Organismus überhaupt in der Lage, selbst Schilddrüsenhormone zu produzieren; bis dahin ist das ungeborene Kind diesbezüglich vollständig auf die mütterliche Zufuhr von Thyroxin angewiesen. Für die anschließende eigenständige Produktion von Schilddrüsenhormonen durch den Fetus bleibt der Transport ausreichender Iod-Mengen über die Plazenta essenziell. Thyroxin stimuliert die Expression des nerve growth factor (NGF), der am neuronalen Wachstum und an der neuronalen Vernetzung der Großhirnrinde beteiligt ist. Außerdem beeinflusst es durch Hochregulierung bestimmter Myelin-Funktionsproteine die normale Entwicklung des Innenohrs; daher ist eine Innenohrschwerhörigkeit ein spezifisches Zeichen für einen intrauterinen Thyroxin- bzw. Iod-Mangel [1, 2].
Folgen intrauterinen Iod- bzw. Thyroxin-Mangels. Bereits eine moderate maternale Hypothyreose bzw. Iod-Unterversogung in der Frühschwangerschaft kann die geistige und motorische Entwicklung des Kindes negativ beeinflussen, was sich z. B. in einem niedrigeren Intelligenzquotienten äußert [3, 4]. Ein ausgeprägter Mangel an Schilddrüsenhormonen kann im Extremfall zu einem als Kretinismus bezeichneten irreversiblen Krankheitsbild führen (frz. cretin = Dummkopf, Idiot), das von massiver geistiger Retardierung, Kropfbildung, Minderwuchs, Schwerhörigkeit und Fettleibigkeit gekennzeichnet ist. Kretinismus wurde bis ins 20. Jahrhundert hinein vor allem in Alpentälern mit iodarmen Böden beobachtet und kommt nach Erkennen der Zusammenhänge und daraus folgenden Präventivmaßnahmen (z. B. Iodierung des Speisesalzes) zwar in Europa nicht mehr vor, wohl aber in Entwicklungsländern [5].
Kretinismus
Der Begriff Kretinismus beschreibt eine Entwicklungsstörung als Folge des Mangels an Schilddrüsenhormonen. Früher war sie in Regionen weit verbreitet, in denen kein oder nur sehr wenig Iod im Boden und damit in den landwirtschaftlichen Produkten enthalten war. Wegen der iodarmen Böden in den Schweizer Alpen wurde in einigen Gemeinden das Speisesalz bereits seit 1919 mit Iod angereichert, seither ist dort die Prävalenz der Iod-Mangelstruma deutlich gesunken. 1923 wurde in der gesamten Schweiz Salz iodiert, damals mit 3,75 µg Iod/kg, 2014 betrug der Wert 25 µg/kg. Das Bild zeigt „Die Cretinnen in Steiermark und anderen Ländern“ [Oesterreichs Tibur oder Natur- und Kunstgemählde aus dem oesterreichischen Kaiserthume Verlag Doll, Wien 1819]
In der Schweiz wird Speisesalz bereits seit 1923 regelhaft mit Kaliumiodat versetzt, während der Iod-Zusatz zu Speisesalz und Tierfutter in Deutschland erst 1970 erlaubt wurde. Zwar verwenden in Deutschland etwa 80% der Privathaushalte Iod-Salz, allerdings wird dieses hauptsächlich als Zusatz zum Kochwasser verwendet, wobei das Iod größtenteils verloren geht [6]. Bei industriell bzw. handwerklich hergestellten Lebensmitteln liegt die seit 1989 erlaubte Verwendung von iodiertem Speisesalz noch unter 30 Prozent [8]. Die Iod-Versorgung der Bevölkerung hat sich zwar seitdem deutlich verbessert, ist aber insgesamt immer noch nicht zufriedenstellend und möglicherweise sogar wieder rückläufig [7]; so wurde in einer großen epidemiologischen Studie an 18.000 Kindern bei 57% der Kinder ein milder bis moderater Iod-Mangel und bei 30% eine sonographisch vergrößerte Schilddrüse festgestellt [9]. Zwar sind die oben beschriebenen durch Iod-Mangel bedingten intrauterinen Entwicklungsstörungen irreversibel, allerdings konnte gezeigt werden, dass eine Iod-Supplementierung die kognitiven Fähigkeiten von Schulkindern mit mildem bis moderatem Iod-Mangel zumindest teilweise verbessern kann [10, 11]. Obwohl die zugrundeliegenden Mechanismen und die Folgen einer Iod-Unterversorgung bekannt sind, besteht also auch weiterhin Handlungsbedarf. Schon der flächendeckende Einsatz von Iod-Salz in Lebensmittelindustrie und -handwerk könnte eine ausreichende Iod-Versorgung in Deutschland sicherstellen [12] (s. Abb. 1). Die empfohlene Iod-Zufuhr beträgt für Erwachsene bis 51 Jahre 200 µg/Tag, ab einem Alter von 51 Jahren 180 µg/Tag [8] (s. Tab. 1). Ohne die Verwendung von iodiertem Speisesalz lägen 96 bis 97% aller Deutschen unterhalb der empfohlenen Mengen [13].
Personengruppe |
empfohlene tägliche Aufnahme |
|---|---|
Säuglinge |
40 µg bis 80 µg |
Kinder 1 bis 9 Jahre |
100 µg bis 140 µg |
Kinder 10 bis 12 Jahre |
180 µg |
|
Jugendliche und Erwachsene
13 bis 50 Jahre
|
200 µg |
Erwachsene ab 51 Jahren |
180 µg |
Schwangere |
230 µg |
Stillende |
260 µg |
Unbegründete Sorgen. Immer häufiger hört man von Verbrauchern, die angesichts aktueller Ernährungstrends die Befürchtung äußern, die Verwendung von Iod-Salz in Fertiglebensmitteln im Rahmen der allgemeinen Iod-Mangelprophylaxe könne gesundheitsgefährdend sein. Diese Befürchtung ist durch keine toxikologischen Daten begründet. Die Iod-Menge, die in Fertiglebensmitteln unter Verwendung von Iod-Salz enthalten ist (15 bis 25 mg/kg Salz), ist aufgrund gesetzlicher Vorgaben im Übrigen so (niedrig) gewählt, dass weder für Gesunde noch für Menschen mit Schilddrüsenerkrankungen ein gesundheitliches Risiko durch den Verzehr iodsalzhaltiger Lebensmittel besteht. Auch die zur Pathogenese der Iod-Akne erforderlichen Iod-Mengen werden durch die Verwendung von Iod-Salz nicht annähernd erreicht. Kritische Zufuhrmengen würden selbst dann nicht resultieren, wenn Verbraucher ausschließlich iodiertes Speisesalz und iodierte Fertiglebensmittel verwenden würden [8]. Selbst bei der Hashimoto-Thyreoiditis werden von den entsprechenden Fachgesellschaften weder ein Iod-Verzicht noch eine iodarme Ernährung empfohlen; auch der Verzicht auf iodiertes Speisesalz ist in diesem Fall keineswegs erforderlich. Einzig auf die Einnahme hochdosierter, iodhaltiger Nahrungsergänzungsmittel (z. B. bestimmter Algen-Präparate, s. u.) sollte selbstverständlich verzichtet werden. Ebenfalls eine „Legende“ ist die „Iod-Allergie“ durch iodhaltige Lebensmittel: Die verwendeten Iodate sind allein aufgrund ihrer geringen Molekülgröße nicht allergen; auch Allergien gegenüber iodhaltigen Kontrastmitteln beruhen nicht auf dem Iod an sich, sondern auf den Trägerstrukturen.
Iod-Supplementierung in der Schwangerschaft. In Deutschland liegt die tatsächliche mediane Iod-Zufuhr für Frauen bei 185 µg/Tag, während die Zufuhrempfehlung für Schwangere 230 µg/Tag vorsieht [13]. Schwangere sollten daher zusätzlich zu einer ausreichend iodhaltigen Ernährung ein Iod-Supplement einnehmen, um die genannten negativen Folgen für das Ungeborene zu vermeiden. Empfohlen wird dazu eine supplementative Iod-Zufuhr von 100 bis 150 µg/Tag [14]. Für die konkrete Dosisfindung innerhalb dieser Spanne sollte berücksichtigt werden, wie der Iod-Gehalt der üblichen Ernährung im konkreten Fall ist (also insbesondere, ob Seefisch und/oder iodiertes Speisesalz verwendet werden oder nicht). Die Gesamttageszufuhr an Iod sollte inklusive aller Supplemente und Lebensmittel 500 µg nicht überschreiten. Bei Schilddrüsenerkrankungen sollte Iod auch bei Schwangeren in keinem Fall ohne ärztliche Rücksprache supplementiert werden.
Iodhaltige Algenpräparate. Dringend abgeraten werden sollte von der Verwendung iodhaltiger Algenpräparate, wie sie von Veganerinnen/Vegetarierinnen teilweise gezielt auch in der Schwangerschaft als vermeintlich natürliche Iod-Quelle genutzt werden: Der Iod-Gehalt in diesen Präparaten/Nahrungsergänzungsmitteln liegt teilweise erheblich über der maximalen Zufuhrempfehlung (Gehalt bis 11 mg Iod pro Gramm Trockengewicht) und ist daher potenziell gesundheitsgefährlich [8]. Diese Warnung vor iodhaltigen Algenpräparaten gilt indes nicht nur für Schwangere: Auch bei älteren Personen, die in Zeiten des Iod-Mangels aufgewachsen sind und infolgedessen kompensatorisch autonome Knoten entwickelt haben, kann ein plötzliches Überangebot an Iod zu einer gesteigerten Produktion von Schilddrüsenhormonen und damit zu einer Hyperthyreose führen [8].
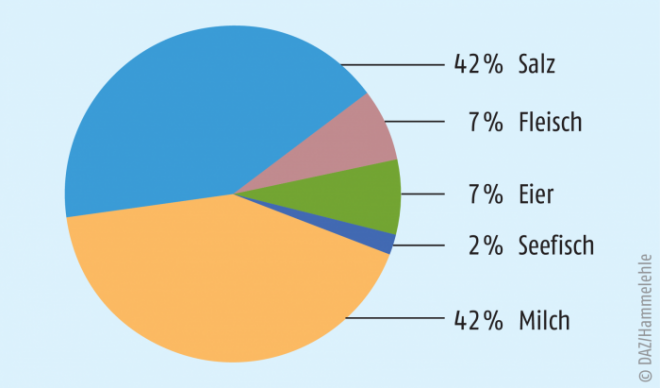
Nutritive Quellen für Iod
- täglicher Verzehr von Milch-/Milchprodukten (Cave: aufgrund der Fütterungsbedingungen erniedrigter Iod-Gehalt von Biomilch im Vergleich zu konventioneller Milch)
- Verzehr von Seefisch zweimal pro Woche
- konsequente Verwendung von Iod-Salz im Haushalt
- bei Verwendung von Fertiglebensmitteln: Bevorzugung von Produkten mit Iod-Salz
Iod-Zufuhr und andere Erkrankungen. Neben den bekannten Auswirkungen von Iod-Mangel auf die geistige und körperliche Entwicklung sehen einzelne Autoren auch einen möglichen Zusammenhang zwischen Iod-Zufuhr, Schilddrüsenerkrankungen und Brustkrebs [6]; die zugrunde liegenden Zusammenhänge werden aber kontrovers diskutiert und erlauben noch keine praktische Beurteilung [15]. Umgekehrt führt die im Vergleich zu früher verbesserte Iod-Versorgung der Bevölkerung möglicherweise zu einer leicht erhöhten Prävalenz von Autoimmunerkrankungen der Schilddrüse, wobei die Vorteile des verbesserten Iod-Status dieses geringe Risiko überwiegen [16]. Eine Überversorgung mit Iod durch die Nahrung ist auch bei flächendeckender Verwendung von Iod-Salz im Haushalt und in der Lebensmittelproduktion nicht zu befürchten.
Vitamin D
Die Bedeutung von Vitamin D für die Calcium- und Phosphathomöostase und den Knochenstoffwechsel ist hinlänglich bekannt. Darüber hinaus wurden jedoch in den letzten Jahren verstärkt Zusammenhänge mit weiteren Organen und physiologischen Prozessen außerhalb des Skelettsystems untersucht, z. B. mit onkologischen Erkrankungen, Diabetes mellitus Typ 1 und 2 sowie Autoimmunerkrankungen wie multipler Sklerose oder rheumatoider Arthritis [17 – 20]. Der Zusammenhang mit Autoimmunerkrankungen liegt vermutlich darin begründet, dass Vitamin D verschiedene immunmodulatorische Effekte aufweist. So wird beispielsweise die Aktivität von Makrophagen und antigenpräsentierenden Zellen dahingehend beeinflusst, dass die Proliferation und Differenzierung von Makrophagen stimuliert und die Präsentation von Autoantigenen sowie die Sekretion proinflammatorischer Zytokine verringert wird, woraus insgesamt eine verminderte Entzündungsneigung resultiert [17, 18]. Auch eine Verbindung mit Autoimmunerkrankungen der Schilddrüse wurde verschiedentlich postuliert [21]. Tatsächlich wurde eine Korrelation zwischen niedrigem Spiegel von 25-Hydroxycholecalciferol (25-OH-D3), dem zur Bestimmung des Vitamin-D-Status besonders aussagekräftigen einfach hydroxylierten Vitamin-D-Derivat, und dem Auftreten einer autoimmunen Thyreoiditis bei prämenopausalen Frauen [22] und bei älteren Patienten [23] nachgewiesen. Auch bei Patienten mit Morbus Basedow wurden Vitamin-D-Mangelzustände festgestellt [24]. Zum Teil widersprüchliche Ergebnisse verschiedener Studien lassen sich möglicherweise dadurch erklären, dass autoimmune Schilddrüsenerkrankungen mit genetischen Polymorphismen am Vitamin-D-Rezeptor-Gen assoziiert zu sein scheinen [25, 26].
Der therapeutische Einsatz von Vitamin D bzw. seinen Analoga bei verschiedenen Autoimmunerkrankungen unter Ausnutzung der immunmodulatorischen Wirkung und gleichzeitiger Vermeidung unerwünschter Wirkungen im Sinne einer Hypervitaminose ist derzeit Gegenstand intensiver klinischer Forschung – dies betrifft auch den Zusammenhang mit Erkrankungen der Schilddrüse. Obwohl verschiedene Untersuchungen darauf hindeuten, dass Vitamin D den Verlauf von Autoimmunerkrankungen der Schilddrüse im Sinne einer Reduktion des TPO-Antikörpertiters positiv beeinflussen kann [27, 28], bedarf es großer randomisierter, placebokontrollierter Studien mit harten Endpunkten, um die Wirksamkeit und Sicherheit dieser Therapieoption abschließend beurteilen zu können. Ein bestehender Vitamin-D-Mangel sollte durch individuelle Supplementation ausgeglichen werden; bekanntermaßen herrscht jedoch keine einheitliche Meinung über die wünschenswerte Höhe des 25-OH-D3-Spiegels.
Selen
Neben Iod und Vitamin D ist auch Selen für eine normale Schilddrüsenfunktion essenziell. Dieses Spurenelement ist im Körper eines erwachsenen Menschen zu etwa 10 bis 15 mg enthalten und wird über die Nahrung vor allem durch den Verzehr von Fisch, Fleisch, Hülsenfrüchten und Nüssen aufgenommen, wobei der Selen-Gehalt der Nahrungsmittel starken regionalen Schwankungen unterliegt. Die D-A-CH-Referenzwerte empfehlen für Erwachsene eine Zufuhr von 60 µg/Tag (Frauen) bzw. 70 µg/Tag (Männer) (s. Tab. 2) [8]. Das Risiko einer Selen-Unterversorgung ist vor allem bei Frühgeborenen, Kindern mit angeborenen Stoffwechselerkrankungen, Alkoholikern sowie – wegen des zu geringen Selengehalts kommerziell erhältlicher Nährlösungen – bei über längere Zeit parenteral ernährten Patienten erhöht [18].
Alter |
Selen µg/Tag |
|
|---|---|---|
m |
w |
|
Säuglinge | ||
0 bis unter 4 Monate |
10 |
|
4 bis unter 12 Monate |
15 |
|
Kinder und Jugendliche | ||
1 bis unter 4 Jahre |
15 |
|
4 bis unter 7 Jahre |
20 |
|
7 bis unter 10 Jahre |
30 |
|
10 bis unter 13 Jahre |
45 |
|
13 bis unter 15 Jahre |
60 |
|
15 bis unter 19 Jahre |
70 |
60 |
Erwachsene | ||
19 bis unter 25 Jahre |
70 |
60 |
25 bis unter 51 Jahre |
70 |
60 |
51 bis unter 65 Jahre |
70 |
60 |
65 Jahre und älter |
70 |
60 |
Schwangere |
60 |
|
Stillende |
75 |
|
Bedeutung für die Schilddrüse. Die physiologische Bedeutung des Selens für die Schilddrüse liegt in seiner Funktion als Bestandteil verschiedener Selenoenzyme. So kommt Selen in Form der Aminosäure Selenocystein im aktiven Zentrum der Iodthyronin-5‘-Deiodasen vor, deren Typ-I-Unterform in der Schilddrüse die Deiodierung und damit Aktivierung von 3,5,3‘,5‘-Tetraiodthyronin (T4, syn. Thyroxin) zu 3,5,3‘-Triiodthyronin (T3) katalysiert. Darüber hinaus ist Selen integraler Bestandteil der Enzyme Glutathionperoxidase und Thioredoxinreduktase, die den Abbau von Wasserstoffperoxid (H2O2) katalysieren. H2O2 wird in der Schilddrüse zur Oxidierung von Iodid- zu Iodoniumionen (I+) gebildet; letztere iodieren die Tyrosinreste des Thyreoglobulins zu Monoiodtyrosin und Diiodtyrosin, aus denen schließlich T3 und T4 entstehen. Überschüssiges H2O2 wird zur Vermeidung der Bildung zytotoxischer Hydroxyl-Radikale durch die genannten Selenoenzyme entgiftet [18]. Neben der Beteiligung an Hormonsynthese und antioxidativen Entgiftungsprozessen in der Schilddrüse ist Selen ein Stimulator der humoralen und zellulären Immunität [25].
Nutritive Quellen für Selen
Gehalt pro 100 g Lebensmittel [37]
- hoher Gehalt: Innereien (bis 200 µg), Steinpilz (187 µg), Thunfisch (82 µg), Makrele (39 µg)
- mittlerer Gehalt: Sojabohnen (19 µg), Naturreis (10 µg)
- geringer Gehalt: Rindfleisch (5 µg), Speisequark (5 µg), Vollmilch (1 µg), Weizenmehl (1 µg)
Selen und Schilddrüsenerkrankungen. Diese physiologischen Funktionen des Selens in der Schilddrüse sowie der Umstand, dass z. B. eine durch Selen-Mangel reduzierte Aktivität der antioxidativen Enzyme eine H2O2-vermittelte Schädigung des Schilddrüsengewebes verursacht, führten zu der Hypothese, dass eine Selen-Supplementierung unter Umständen das Ausbrechen bzw. die Progression von Schilddrüsenerkrankungen verlangsamen könnte. Dies gilt offenbar insbesondere für einen subklinischen Hypothyreodismus bei Autoimmun-Thyreoiditis [29]. Auch eine große populationsbasierte chinesische Studie konnte zeigen, dass neben subklinischer und manifester Schilddrüsenunterfunktion und vergrößerter Schilddrüse auch Autoimmunerkrankungen der Schilddrüse signifikant häufiger in Gegenden mit unzureichender Selen-Versorgung auftraten [30]. Ein kombinierter Iod- und Selen-Mangel der Mutter kann einen sogenannten myxödematösen Kretinismus verursachen, bei dem eine verminderte H2O2-Entgiftung durch selenabhängige Enzyme zur Zerstörung des Schilddrüsengewebes führt [31].
Aktuelle Studien. Diese Ergebnisse erlauben jedoch noch keine Rückschlüsse darauf, ob zusätzlich zugeführtes Selen sich auch bei ausreichender Selen-Versorgung bzw. bei bereits bestehenden Schilddrüsenerkrankungen positiv auswirkt. Mehrere kleinere Studien an Patienten mit Hashimoto-Thyreoiditis führten diesbezüglich zu widersprüchlichen Ergebnissen, sodass nicht abschließend darüber geurteilt werden kann, ob eine Selen-Supplementierung das Fortschreiten einer Hashimoto-Thyreoiditis aufhalten kann [25]. Bei der im Rahmen eines Morbus Basedow auftretenden endokrinen Orbitopathie (Exophthalmus) zeigte sich bei milden Formen tatsächlich ein positiver Effekt der Selen-Supplementierung auf den Krankheitsverlauf [32]. Eine entsprechende Empfehlung hat trotz der noch dünnen Datenlage Eingang in die Leitlinien der European Thyroid Association gefunden [33]. Bisher existieren allerdings noch keine validen Ergebnisse aus großen prospektiven klinischen Studien, die exakt belegen, welche Subgruppen von Patienten mit z. B. Hashimoto-Thyreoiditis oder Morbus Basedow unter Umständen von einer Selen-Supplementierung profitieren. Bis dahin sollte sich der Gebrauch von Selen auf Indikationen beschränken, für die eine entsprechende Evidenz existiert; dies ist bisher nur bei klinisch nachgewiesenem Selen-Mangel der Fall. Bei Patienten mit normalem oder unbekanntem Selen-Status ist von einer pauschalen Empfehlung zur zusätzlichen Selen-Zufuhr abzusehen, da einerseits keine Evidenz für einen klinischen Nutzen existiert und dem Patienten andererseits durch eine chronische Selen-Intoxikation Schaden zugefügt werden kann [34]. Die maximal tolerable tägliche Zufuhr aus Nahrung und Supplementen wurde von der europäischen Lebensmittelaufsichtsbehörde EFSA auf 300 µg/Tag festgesetzt [35]. Da die meisten kommerziell verfügbaren, nicht rezeptpflichtigen Selenpräparate bereits 200 µg pro Tablette enthalten, ist hier Vorsicht geboten. |
Literatur
[1] De Escobar GM et al. The changing role of maternal thyroid hormone in fetal brain development. Semin Perinatol 2008;32:380-386
[2] Gärtner R. Thyroid disease in pregnancy. Curr Opin Obstet Gynecol 2009;21:501-7.
[3] Santiago-Fernandez P et al. Intelligence quotient and iodine intake:a cross sectional study in children. J Clin Endocrinol Metab 2004;89:3851-3857
[4] Remer T et al. Iod-Mangel in der Kindheit – ein Risiko für die kognitive Entwicklung. Dtsch Med Wochenschr 2010;135:1551-6
[5] Fualal J et al. Access, availability, and infrastructure deficiency:The current management of thyroid disease in the developing world. Rev Endocr Metab Disord 2016; epub ahead of print
[6] Gärtner R. Hat Iod eine Bedeutung in der Prävention und adjuvanten Therapie von Brustkrebs? Deutsche Zeitschrift für Onkologie 2009;43:51-56
[7] Deutsche Gesellschaft für Ernährung:Iodunterversorgung wieder auf dem Vormarsch? Presseerklärung der Deutschen Gesellschaft für Ernährung vom 29. Januar 2013
[8] Fragen und Antworten zur Iod-Versorgung und zur Iod-Mangelvorsorge. Bundesinstitut für Risikobewertung (BfR) vom 7. Februar 2012, www.bfr.de
[9] Thamm M et al. Iod-Versorgung in Deutschland. Ergebnisse der Iod-Versorgung im Kinder- und Jugendgesundheitssurvey (KiGGS). Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2007;50:744-749
[10] Zimmermann MB et al. Iodine supplemetation improves cognition in iodine-deficient schoolchildren in Albania:a randomized, controlled, double-blind study. Am J Clin Nutr 2006;83;108-114
[11] Köhler M, Fechner A, Leiterer M et al. Iodine content in milk from German cows and in human milk:new monitoring study. Trace Elements and Electrolytes 2012;29:119-261
[12] Zimmermann MB. Iodine deficiency. Endocrine Reviews 2009;30:476-488
[13] Ergebnisse der nationalen Verzehrstudie 2008, Max-Rubner-Institut, www.mri.bund.de
[14] Koletzko B. Ernährung in der Schwangerschaft. Deutsches Ärzteblatt 2013;13:612-613
[15] Smyth PP. The thyroid and breast cancer. Curr Opin Endocrinol Diabetes Obes 2016;32(5):389-393
[16] Utiger RD. Iodine nutrition – more is better. N Engl J Med 2006;354:2819-2821
[17] Vondra K et al. Vitamin D and Thyroid Diseases. Physiol Res 2015;64(2):95-100
[18] Elmadfa I, Leitzmann C. Ernährung des Menschen. 5. Auflage 2015, Verlag Eugen Ulmer Stuttgart
[19] Muscogiuri G et al. Vitamin D and thyroid disease:to D or not to D? Eur J Clin Nutr 2015;69(3):291-296
[20] Danilovic DLS et al. 25-Hydroxyvitamin D and TSH as Risk Factors or Prognostic Markers in ThyroidCarcinoma. PLoS ONE 2016;11(10):e0164550
[21] Wang J et al. Meta-analysis of the association between vitamin D and autoimmune thyroid disease. Nutrients 2015;7(4):2485-298.
[22] Choi YM et al. Low levels of serum vitamin D3 are associated with autoimmune thyroid disease in pre-menopausal women. Thyroid 2014;24(4):655-656
[23] Muscogiuri G et al. 25 Hydroxyvitamin D Deficiency and Its Relationship to Autoimmune Thyroid Disease in the Elderly. Int J Environ Res Public Health 2016;13:850
[24] Yasuda et al. Serum vitamin D levels are decreased and associated with thyroid volume in female patients with newly onset Graves’ disease. Endocrine 2012;42(3):739-741
[25] Wiersinga WM. Clinical Relevance of Environmental Factors in the Pathogenesis of Autoimmune Thyroid Disease. Endocrinol Metab (Seoul) 2016;31(2):213-222
[26] Feng M et al. Polymorphisms in the vitamin D receptor gene and risk of autoimmune thyroid diseases:a meta-analysis. Endocrine 2013;43(2):318-26
[27] Chaudary S et al. Vitamin D supplementation reduces thyroid peroxidase antibody levels in patients with autoimmune thyroid disease:An open-labeled randomized controlled trial. Indian J Endocrinol Metab 2016;20(3):391-398
[28] Mazokopakis E et al. Is vitamin D related to pathogenesis and treatment of Hashimoto‘s thyroiditis? Hell J Nucl Med 2015;18(3):222-227
[29] Pirola I, Gandossi E, Agosti B, Delbarba A, Cappelli C. Selenium supplementation could restore euthyroidism in subclinical hypothyroid patients with autoimmune thyroiditis. Endokrynol Pol 2016;67(6):567-571
[30] Wu Q et al. Low Population Selenium Status Is Associated With Increased Prevalence of Thyroid Disease. J Clin Endocrinol Metab 2015;100(11):4037-4047
[31] Köhrle J, Gärtner R. Selenium and thyroid. Best Pract Res Clin Endocrinol Metab 2009;23:815-827
[32] Marcocci C et al. Selenium and the course of mild Graves‘ orbitopathy. N Engl J Med 2011;364(20):1920-1931
[33] Bartalena L et al. The 2016 European Thyroid Association/European Group on Graves‘ Orbitopathy Guidelines for the Management of Graves‘ Orbitopathy. Eur Thyroid J 2016;5(1):9-26
[34] Hegedüs L et al. Selenium in the treatment of Thyroid Diseases: An Element in the search of the relevant indications? Eur Thyroid J 2016;5:149-151
[35] Tolerable upper intake levels for vitamins and minerals. EFSA (European Food Safety Authority) 2006
[36] Johner SA, Thamm M, Noehling U, Remer T. Iodine status in preschool children and evaluation of major iodine sources: a German experience. Eur J Nutr 2013;52(7):1711-1719
[37] Souci SW, Fachmann W, Kraut H. Lebensmitteltabelle für die Praxis. 5. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart 2011























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.