
- DAZ.online
- DAZ / AZ
- DAZ 49/2017
- Startklar für securPharm
Arzneimittelsicherheit
Startklar für securPharm?
EU-weiter Fälschungsschutz für Arzneimittel: Was sich 2018 und 2019 für Apotheken verändert
Den Anstoß für die europaweiten Regelungen zum Fälschungsschutz gab im Jahr 2008 der damalige EU-Industriekommissar Günter Verheugen mit seinem EU-Pharmapaket. „Jede Fälschung von Medikamenten ist ein versuchter Massenmord“, erklärte der Kommissar damals. Nach langen Beratungen verabschiedete das Europäische Parlament Anfang 2011 die Richtlinie zur Bekämpfung von Arzneimittelfälschungen in der legalen Lieferkette. Seitdem war klar: Künftig wird es besondere Sicherheitsmerkmale für die Packungen verschreibungspflichtiger Arzneimittel geben. Mit ihrer Hilfe soll die Echtheit eines Arzneimittels sichergestellt und der Patient geschützt werden. Details zu diesen Sicherheitsmerkmalen wurden in der Richtlinie allerdings noch nicht geklärt, sondern einer weiteren Gesetzgebung, der sogenannten delegierten Verordnung, überlassen. Hier sollte beispielsweise geregelt werden, wie genau die Sicherheitsmerkmale aussehen sollen und wie das Datenspeicher- und -abrufsystem funktioniert, das die Informationen zu diesen Merkmalen bereit hält und damit die Echtheitsprüfung ermöglicht. Auf diese Verordnung mussten die Mitgliedstaaten recht lange warten – bis Februar 2016.
Wer steht hinter securPharm?
securPharm e. V. ist eine Stakeholder-Organisation, deren Aufgabe es ist, ein System zur Echtheitsprüfung von Arzneimitteln nach den europäischen Vorgaben aufzubauen. Dafür gibt es in jedem EU-Mitgliedstaat eine zentrale Organisation. SecurPharm wurde 2012 gegründet. Mit dabei sind neben der ABDA der Großhandelsverband Phagro, der vfa – die forschenden Pharma-Unternehmen, der Bundesverband der Arzneimittel-Hersteller (BAH), der Bundesverband der Pharmazeutischen Industrie (BPI) sowie die Informationsstelle für Arzneispezialitäten GmbH (IFA) und die Avoxa, die Mediengruppe der ABDA.
Die Anfänge von securPharm
In Deutschland ruhte man sich in dieser Zeit allerdings nicht aus. Die Verbände der pharmazeutischen Industrie, der Apotheker und des Großhandels wurden sofort aktiv. Schon 2010 habe es erste „Sondierungsgespräche“ zwischen Apothekern und Industrie gegeben, berichtet Hoferichter. Und bereits damals habe man sich auf zwei Punkte verständigt, die sich bis heute als tragend und richtig erwiesen hätten. Einer war die Übereinkunft, dass die Akteure zusammenarbeiten müssen. Daraus erwuchs 2012 die Stakeholder-Organisation securPharm e. V., in der sich die Pharma-, Großhandels- und Apothekerverbände BAH, BPI, vfa, Phagro und ABDA zusammengeschlossen haben. Dieses Stakeholdermodell griff später auch die delegierte Verordnung auf. Der zweite Punkt, auf den man sich frühzeitig verständigte, ist das Modell der verteilten Datenbanken. SecurPharm sieht nämlich vor, dass sowohl die Hersteller als auch die Apotheker ihre Daten auf einem eigenen Server speichern und somit die Hoheit über ihre Daten behalten. Die später erlassene delegierte Verordnung spricht zwar von nur einem Verifizierungssystem. Doch securPharm hat sich längst bestätigen lassen, dass auch das deutsche System mit den zwei Servern, den europäischen Vorgaben entspricht. „Da sind wir in trockenen Tüchern“, betont Hoferichter – auch wenn es von verschiedenen Seiten Kritik am deutschen Weg gab.
Was besagt der Stichtag?
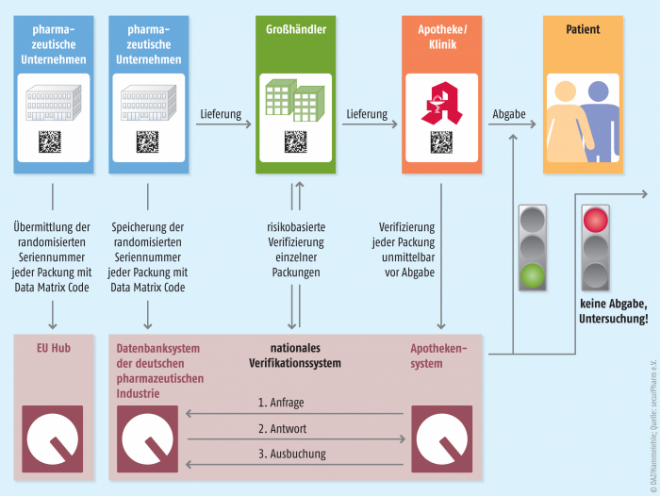
Seit die delegierte Verordnung am 9. Februar 2016 in Kraft getreten ist, läuft ein Countdown: Die Mitgliedstaaten erhielten drei Jahre Zeit, um sich vorzubereiten. Das heißt: Ab dem 9. Februar 2019 muss jedes verifizierungspflichtige Arzneimittel in jeder Apotheke eines EU-Mitgliedstaates sowie den EWR-Staaten auf seine Echtheit überprüft werden können, ehe es an den Patienten abgegeben wird. Konkret müssen bei der Abgabe zwei Sicherheitsmerkmale überprüft werden: das individuelle Erkennungsmerkmal in Form eines Data-Matrix-Codes und der Erstöffnungsschutz, der eine Vorrichtung gegen Manipulationen darstellt. Ist die Prüfung erfolgt, muss die Apotheke das individuelle Erkennungsmerkmal durch eine Ausbuchung aus dem System deaktivieren. Als „verifizierungspflichtig“ gelten dabei grundsätzlich alle verschreibungspflichtigen Arzneimittel (wenige Ausnahmen finden sich im Anhang 1 zur delegierten Verordnung, zum Beispiel homöopathische Arzneimittel und medizinische Gase – sog. „White List“). Rezeptfreie Arzneimittel müssen die Sicherheitsmerkmale dagegen nicht tragen – mit einer Ausnahme: Omeprazol in den Stärken 20 und 40 mg.
Mittlerweile ist die Vorbereitungszeit bereits mehr als zur Hälfte verstrichen. Und ein Datum im Jahr 2019 mag vielen noch immer fern klingen. Doch die Zeit vergeht bekanntlich meist schneller als es einem lieb ist. Daher sind die ABDA und auch securPharm jetzt aktiv geworden: Die Apotheker sollen erfahren, was genau sie erwartet. Nach einer Info-Veranstaltung zum Stand bei securPharm am 8. November für die ABDA-Mitgliedsorganisationen sind nun die Kammern und Verbände gefordert, die Apotheken vor Ort zu informieren. Jede Mitgliedsorganisation musste Ansprechpartner für Fragen rund um securPharm bestimmen. Und an Fragen aus der Praxis mangelt es nicht – das haben in der letzten Zeit zahlreiche Mitgliederversammlungen gezeigt, bei denen securPharm ein Thema war.
Deutschland: Durch langen Pilotbetrieb geübt
Die gute Nachricht vorweg: Bei securPharm und bei der ABDA ist man überzeugt, dass am 9. Februar 2019 in den öffentlichen Apotheken alles glatt gehen wird. Schließlich haben sich die securPharm-Akteure lange genug vorbereitet. Seit 2013 läuft bereits ein Pilotbetrieb. Im November 2017 waren an diesem rund 400 Apotheken und fünf Softwarehäuser sowie rund 160 pharmazeutische Unternehmen mit 1900 Produkten sowie ein freiwillig prüfender Großhändler beteiligt. Hier konnten die Beteiligten erste Erfahrungen sammeln. Auch DAV-Vize Hubmann ist von Anfang an bei diesem Pilot dabei und hat sich lange und intensiv für securPharm engagiert. Jetzt ist seine Botschaft an alle Apotheken, die noch nicht genau wissen, was auf sie zukommen wird: „Deutschland wird gut vorbereitet sein. So weit wie wir ist kein anderes Land in Europa.“ Hubmann und Hoferichter gehen beide davon aus, dass es zum Stichtag keinen „Big Bang“ geben wird, ab dem in der Apotheke plötzlich etwas ganz anderes funktionieren muss. „Weil das System schon jetzt in der Erprobung ist und sich im kommenden Jahr immer mehr Nutzer draufschalten werden, wird das ein allmählicher Übergang, ein ‚fliegender Start‘“, sagt Hoferichter. „Man wird den 9. Februar in der Praxis kaum spüren“. Das ist keine Selbstverständlichkeit. Hoferichter hat gewisse Zweifel, ob wirklich alle beteiligten 32 Länder rechtzeitig bereit sein werden.
„Die Entscheidung für getrennte Datenbanken war richtig. Dahinter stehen wir alle.“
Zugang über die NGDA
Doch wie soll dieser „fliegende Start“ funktionieren? Während die ACS PharmaProtect GmbH, eine Gesellschaft der Industrieverbände, sich um die Datenbank der Hersteller und deren Anbindung kümmert, ist die Netzgesellschaft Deutscher Apotheker (NGDA), eine Avoxa-Tochter, für die Nutzerseite da: Das sind die öffentlichen Apotheken, aber auch die Großhandlungen und Krankenhäuser. Die NGDA wird die Anmeldung zum securPharm-Apothekenserver, der für die Echtheitsprüfung genutzt werden soll, vornehmen, erklärt Hubmann. „Dafür brauchen wir eine sichere Legitimation.“ Anfänglich habe es noch die Vorstellung gegeben, das werde über den Heilberufsausweis laufen können, der den Apotheken den Zugang zur Telematikinfrastruktur ermöglichen soll. Doch darauf will man sich aus Zeitgründen nun nicht mehr verlassen. Daher hat die NGDA selbst das sogenannte N-Ident-Verfahren entwickelt – ein Identifizierungsverfahren, das sicherstellt, dass nur Berechtigte Zugang zum Server erhalten. Mit ihm werden die Nutzer auf die Securpharm-Datenbank zugreifen können. Dann kann aus dem gegenwärtigen securPharm-Testbetrieb ab 2018 ein Regelbetrieb werden, der 2019 zum Pflichtbetrieb wird, erläutert Hubmann.
Softwarehäuser kommen auf Apotheken zu
Neben dem notwendigen N-Ident-Zertifikat für den Zugang zum Apothekenserver ist allerdings noch etwas nötig, um loslegen zu können: Das Warenwirtschaftssystem muss vorbereitet werden. Damit sind die Softwarehäuser „auf der letzten Meile zuständig“, wenn es um die Anbindung an securPharm geht. Laut Hubmann sind sie informiert und instruiert über alles, was nötig ist und werden in Kürze selbst auf die Apotheken zugehen und ein Verifizierungs-Modul von securPharm in die Apotheken-Software einbauen. Damit kann die Echtheitsprüfung dann reibungslos in die etablierten Prozesse in der Apotheke integriert werden, verspricht Hoferichter. Die Softwarehäuser werden übrigens auch über die zum Einlesen des Data-Matrix-Codes notwendigen Scanner informieren. Mit diesen sogenannten 2D-Code-Scannern müssen in der Apotheke alle relevanten Arbeitsplätze ausgestattet werden. In vielen Apotheken sind aber bereits entsprechende Geräte vorhanden. Ebenso werden die Softwarehäuser die Apotheken in Sachen Handhabung der Verifikations-Funktionen schulen. Die Anbindung wird nicht auf einen Schlag erfolgen, aber Hubmann rechnet damit, dass bis zum Ende des ersten Halbjahres die allermeisten öffentlichen Apotheken vorbereitet sind. Allerspätestens Ende 2018 sollen dann endgültig alle rund 20.000 mit an Bord sein. „Dafür werden wir jetzt trommeln“, so Hubmann.
Das System der verteilten Datenbanken
SecurPharm setzt auf zwei unterschiedliche Datenbanken: eine für Hersteller, eine für Apotheken. Damit will man für einen besonderen Schutz der sensiblen Daten sorgen – denn die Daten für die Echtheits-Prüfprozesse werden nur anonymisiert ausgetauscht. Die Apotheken müssen insbesondere nicht fürchten, dass die Industrie Einblick in ihre Warenströme erhält. Die EU-Vorgaben sehen ein solches Zwei-Server-System allerdings nicht ausdrücklich vor und Deutschland ist das erste Land, das sich für diesen Weg entschieden hat. Es gibt weitere Länder, die die Umsetzung des deutschen Systems prüfen. Doch der Rest Europas arbeitet mit einer Standardlösung, dem sogenannten Blue-Print-Modell, bei dem sich alle Daten von Herstellern und Apothekern unter einem Dach befinden. Dahinter steht nicht zuletzt der europäische Pharmaverband EFPIA, der Mitglied der europäischen Stakeholder-Organisation EMVO (European Medicines Verification Organisation) ist, und lieber nur dieses eine Blue-Print-System in Europa sähe. Zu teuer, zu kompliziert, lauten die Vorwürfe. Doch securPharm lässt sich nicht von der Kritik beeindrucken. „Deutschland war nun einmal das erste Land, das sich überhaupt Gedanken zur Umsetzung der EU-Richtlinie gemacht hat“, sagt Hoferichter. Und er versichert: Die hiesige Zwei-Server-Variante ist abgesegnet und securPharm als zentrale Organisation beim Bundesgesundheitsministerium angemeldet. Sollte in Deutschland noch jemand darauf bauen, dass eine Alternative auf den Markt kommt, so muss er diese Hoffnung begraben. Denn die Delegierte Verordnung legt fest, dass es pro Land nur ein Verifizierungssystem geben darf. Für die Bundesrepublik ist dies das securPharm-System.
Problemfall Krankenhausapotheken
Gleiches gilt in der Theorie für Krankenhäuser. Doch während die Landschaft der Software-Anbieter für öffentliche Apotheken überschaubar und gut organisiert ist – die großen Anbieter decken rund 90 Prozent des Marktes ab –, ist die für Krankenhausapotheken sehr heterogen. SecurPharm hat die Kliniken – ebenso wie alle Großhändler, auch die zahlreichen kleinen – im November angeschrieben und erläutert, was auf sie zukommt und dass sie sich auf die Anbindung ans (Apotheken-)System vorbereiten müssen. Die ABDA sieht sich allerdings nicht dafür verantwortlich, für die Krankenhausapotheken ebenso aktiv zu werden wie für die öffentlichen Apotheken. „Wir informieren gerne, aber verantwortlich ist für die Krankenhausapotheken die Krankenhausgesellschaft“, sagt Hubmann. Und Hoferichter betont ebenfalls, dass securPharm „kein Rundum-sorglos-Paket anbietet“. Vielmehr ordne die Fälschungsrichtlinie gewisse Aufgaben direkt den Nutzern zu – etwa ihre Software zu ertüchtigen. „Die Nutzer müssen also zunächst ihre Hausaufgaben machen – dann können sie zu uns kommen und wir binden sie an“, so Hoferichter. Während er keine Sorge hat, dass Hersteller, die öffentlichen Apotheken und die vollsortierten Großhändler rechtzeitig bereit sind, sind die Kliniken und kleineren Großhandlungen bei ihm doch noch mit einem Fragezeichen besetzt. Für die Klinikapotheken stellen sich in der Tat zahlreiche andere Fragen als für öffentliche Apotheken. Hier hat man es mit ganz anderen Mengen und Strukturen zu tun. Vieles ist noch ungeklärt – doch die Verantwortung dafür tragen aus Sicht von Hoferichter und Hubmann die Krankenhäuser selbst.
Was heißt End-to-End-Verifikation?
Die delegierte Verordnung der EU-Kommission sieht vor, dass die Identifizierung und Echtheitsprüfung der Arzneimittel durch eine End-to-End-Überprüfung erfolgt. Das heißt: Der pharmazeutische Unternehmer erzeugt am einen Ende der Lieferkette beim Verpacken der Arzneimittel die Sicherheitsmerkmale, die dann am anderen Ende dieser Kette – bei der Abgabe des Arzneimittels an den Endverbraucher, also in der Apotheke oder Klinik – überprüft werden. Zwischendrin erfolgt grundsätzlich keine Verifikation – das ist der Unterschied zum sehr viel aufwendigeren und kostspieligeren Track- and Trace-System, bei dem die Ware an jedem Ort verfolgt werden kann. Ausnahmen gibt es allerdings: Großhändler sollen Arzneimittel, bei denen ein erhöhtes Fälschungsrisiko besteht, entlang der gesamten Lieferkette prüfen. Das soll das Risiko minimieren, dass gefälschte Arzneien länger unentdeckt im Umlauf sind. Die Verordnung gibt den Großhändlern vor, die Echtheit des individuellen Erkennungsmerkmals „mindestens“ bei Arzneimitteln zu prüfen, die von Apotheken oder anderen Großhändlern an ihn zurückgegeben wurden sowie bei solchen, die er von einem Großhändler erhält, der keine Genehmigung für das Inverkehrbringen besitzt und auch nicht vertraglich dazu befugt ist. Grob lässt sich sagen: Was nicht direkt vom Hersteller kommt, sollte verifiziert werden.
Was jetzt zu tun ist
Doch was können die öffentlichen Apotheken jetzt konkret tun, um sich vorzubereiten? Das sind vor allem zwei Dinge: Sie müssen sich über die NGDA bei securPharm anmelden und darum kümmern, dass sie eine funktionsfähige Internetverbindung haben. Letzteres dürfte in der Regel kein Problem sein. Wo das Internet jetzt läuft, wird es auch mit securPharm laufen, sagt Hubmann. Keine Apotheke müsse sich sorgen, dass securPharm ihr Netz zusammenbrechen lässt. Die hier versendeten Datenmengen liegen unter einem Kilobyte pro Abfrage. „Alle reden von Mega- und Gigabyte, da kann sich so kleine Mengen kaum noch jemand vorstellen“, so Hubmann. Nebenbei: Wenn das Internet oder auch der Strom vorübergehend doch mal ausfallen sollte, wird die Apotheke dennoch weiter Arzneimittel abgeben dürfen. Die Verifizierung und Ausbuchung kann dann nachträglich durchgeführt werden – im schlimmsten Fall manuell. Doch die Softwarehäuser werden voraussichtlich individuelle Lösungen für mehr Komfort und auch Back-up-Lösungen bereitstellen, erklärt Hubmann. Er geht davon aus, dass es einen Zwischenspeicher geben wird, der die spätere Ausbuchung ermöglicht. Wird die Internetverbindung wieder aufgenommen, kann der Code nachträglich übertragen werden.
Wie funktioniert die Verifizierung in der Praxis?
Hat die Apotheke nun ihre aufgefrischte Software und ihren Zugang zum Apothekenserver, kann es losgehen. Noch können Fehler gemacht und erkannt werden, das System lernen. Gerade deshalb ist es so wichtig, dass möglichst viele Apotheken schon jetzt mitmachen, betont Hubmann. Im Grunde ändert sich wenig bei den rein praktischen Vorgängen in der Apotheke: Die verifizierungspflichtige Packung – erkennbar durch ihre beiden besagten Sicherheitsmerkmale – wird beim Wareneingang üblicherweise gescannt. Dabei sollte sie zukünftig auch gleich verfiziert werden, rät Hubmann. Zwar kann die Echtheitsprüfung zu jedem beliebigen Zeitpunkt erfolgen (spätestens bei der Abgabe). Doch die Apotheke hat Vorteile, wenn sie sie schon beim Wareneingang vornimmt. Denn der Data-Matrix-Code wird auch „Komfortfunktionen“ mit sich bringen: In ihm stecken neben der individuellen Seriennummer und dem Produktcode auch Charge und Verfalldatum. „Mit einem Scan sind also PZN und Verfall schon im System“, erklärt der DAV-Vize. Er ist überzeugt, dass auch das die Akzeptanz bei den Apothekern erhöhen wird. Aber was genau passiert bei der Verifizierung? Der Scan löst eine Überprüfung der Inhalte des Data-Matrix-Codes gegenüber der Hersteller-Datenbank aus. Diese Anfrage wird dabei anonymisiert über den Apothekerserver weitergeleitet. Die Rückmeldung, ob die Packung im dortigen System zu finden ist, kommt binnen Sekundenbruchteilen. Im bisherigen Testbetrieb, so räumt Hoferichter ein, gibt es noch relativ häufig die Rückmeldung, dass die Verifizierung in der Apotheke nicht erfolgreich war. Das heiße aber nicht, dass es sich um eine Fälschung handelt. Dafür gebe es einen anderen Grund: „Die zur Packung passenden Daten waren noch nicht in die Datenbank der Hersteller hochgeladen“, erklärt Hoferichter. Aber hier ist bei den Unternehmen eine Lernkurve zu beobachten. Die Anforderung lautet: Zu jeder in Verkehr gebrachten Packung muss der dazugehörige Datensatz bereitstehen.
Das Ausbuchen
Zu beachten ist: Das Verifizieren und das Ausbuchen sind zwei unterschiedliche Schritte in der Apotheke. Während die Echtheitsprüfung ohne Probleme und Folgen mehrmals durchgeführt werden kann, ist die Ausbuchung grundsätzlich nur einmal möglich. Mit dem Ausbuchen wird der Status der Packung im System auf „abgegeben“ gesetzt – das heißt, die Seriennummer ist verbraucht. Sollte nochmal eine Packung mit der gleichen Nummer abgefragt werden, so würde die Software das melden. Eine Abgabe kann dann nicht erfolgen, die Packung muss separiert werden und der Grund für die „rote Ampel“ ist dann zu klären. Deshalb sagen die rechtlichen Vorgaben auch klar: Die Ausbuchung muss – nach erneuter Verifizierung – bei der Abgabe an den Endverbraucher stattfinden. Denn bei securPharm handelt es sich um eine sogenannte End-to-End-Verifikation.
„Nach den Erfahrungen im Pilotbetrieb mit 400 Apotheken starten wir im kommenden Jahr in den Regelbetrieb. Ziel ist ein lebendes System: Sobald Fehler oder Unstimmigkeiten bemerkt werden, wird nachgebessert.“
Will eine Apotheke dagegen beispielsweise zwischen den Filialen verschieben, darf sie nicht ausbuchen. Passiert das aber versehentlich oder gibt es andere Gründe, warum das Präparat trotz Ausbuchung dann nicht abgegeben wurde, gibt es eine 10-Tages-Frist für eine Rückbuchung. Wer diese nicht beachtet, „produziert Arzneimittelschrott“, warnt Hubmann. Wichtig ist die Regelung etwa für den Fall, dass ein Arzneimittel über den Botendienst an einen Patienten geliefert werden soll, der Patient aber nicht angetroffen wird. Dann muss sich die Apotheke schnellstmöglich um die Zurückbuchung kümmern.
Arzneimittelimporte
Importeure gelten ebenfalls als Hersteller. Wenn sie Arzneimittel aus dem EU-Ausland kaufen, um sie in Deutschland weiterzuverkaufen, müssen sie die ausländische Ware verifizieren und aus dem System ausbuchen. Dann müssen sie die Packungen mit neuen, eigenen Sicherheitsmerkmalen versehen und die neue Seriennummer in die Datenbank der Hersteller laden. Solche Parallelimporte werden also mit deutscher Codierung in den Apotheken zu finden sein.
Vorteil für Vor-Ort-Apotheken
Anders ist es übrigens beim Versand von Arzneimitteln: Während beim Botendienst das Arzneimittel im Herrschaftsbereich der Apotheke bleibt und deshalb eine spätere Rückbuchung möglich ist, gibt die Versandapotheke die Verantwortung mit dem Verschicken der Ware ab. Selbst wenn sie die Arzneimittel binnen zehn Tagen unversehrt zurückgeschickt bekäme, könnte sie sie aus rechtlichen Gründen nicht zurückbuchen. Hoferichter sieht damit durch securPharm letztlich auch ein großes Potenzial, um die Apotheke vor Ort zu stärken. Hier erfolgt die Echtheitsprüfung vor den Augen des Kunden – er kann sicher sein, ein sicheres Arzneimittel zu bekommen. Was dagegen auf dem Weg zwischen Versandapotheke bis zum Besteller geschieht, bleibt ein Unsicherheitsfaktor. Klar ist aber: Auch für EU-ausländische Versandapotheken gilt ab Februar 2019 die europäische Verordnung, sie müssen ebenso wie deutsche Apotheken verifizieren.
Wie ist mit Individualimporten aus dem Ausland umzugehen?
Für ausländische Arzneimittel gilt das Gleiche wie für deutsche: Ihr Data-Matrix-Code wird gescannt, wodurch eine Verifizierungsanfrage ausgelöst wird. Hier kommt der „europäische Hub“ ins Spiel: Dies ist ein Router, der die Verifikationssysteme der beteiligten Länder miteinander vernetzt. Über ihn kann die in Deutschland gestartete Anfrage zur Echtheit einer ausländischen Arzneimittelpackung an das System ihres Herkunftslandes weitergeleitet werden.
Und wie sieht es auf Herstellerseite aus?
Eine Unbekannte in dem ganzen Verfahren ist allerdings noch, wie viele Packungen mit den neuen Sicherheitsmerkmalen zum 9. Februar 2019 im Umlauf sein werden. Derzeit sind es nämlich noch nicht allzu viele. Die Hoffnung ist daher groß, dass im kommenden Jahr nicht nur mehr Apotheken, sondern auch mehr Hersteller in die nächste Stufe der Vorbereitung gehen. Ob im Februar 2019 schon alle Produkte in der neuen Aufmachung zur Verfügung stehen werden, will man auch bei securPharm nicht mit Sicherheit versprechen. Hoferichter: „Heute können wir sagen: Alle Hersteller haben verstanden was kommt und arbeiten mit Hochdruck an der Umsetzung.“ Aber es handele sich hier um eine „globale Herausforderung“ und ein „riesiges Infrastrukturprojekt“ für die Firmen: Alle Fertigungsstätten weltweit, die Ware für den EU-Markt produzieren, müssen umgerüstet werden. Tatsächlich ist es nicht ohne, wenn nun jede einzelne Packung individuell bedruckt werden muss. Zudem müssen die Hersteller sicherstellen, dass am Ende der Produktion die entsprechenden individuellen Datensätze für jede Packung erfasst und an die Herstellerdatenbank weitergegeben werden, sodass die Apotheke sie auslesen können.
Hoferichter verweist weiterhin darauf, dass die Hersteller unterschiedliche Strategien hinsichtlich ihres Einstiegs in das System fahren: „Manche wollen nach einer Umstellung sofort testen, ob die neuen Packungen in der Apotheke funktionieren. Andere Hersteller sagen, sie wollen erst einmal alle Produktlinien umstellen und ihr Datenmanagementsystem komplett aufbauen, ehe sie einsteigen.“ Dies erkläre auch, warum bislang erst 160 von 400 Unternehmen an securPharm angebunden sind. Das bedeute aber nicht, dass diese Firmen nichts tun, betont Hoferichter. Sie bereiteten sich lediglich intern vor. „Wir als securPharm raten den Herstellern aber immer, die Möglichkeit der Systemtestung so früh zu nutzen, wie sie können.“ Denn die Erfahrung zeige, dass es nicht selbstverständlich ist, dass die Unternehmen zu jeder Packung auch den passenden Datensatz rechtzeitig in den Markt bekommen. Das liege an kleineren, nicht dramatischen Fehlern, die auszubügeln sind, wenn man genug Zeit für die Erprobung hat.
Abgabe alter Packungen bleibt möglich
Sollte die Umstellung bei den Herstellern zum 9. Februar 2019 noch nicht komplett erfolgt sein, heißt dies aber nicht, dass die Apotheken keine alten Packungen mehr abgeben dürfen. Der Stichtag besagt vielmehr, dass ab diesem Zeitpunkt nur noch Ware mit den Sicherheitsmerkmalen für den Verkehr freigegeben werden darf – er richtet sich also primär an den Hersteller. Zuvor freigegebene Ware bleibt verkehrsfähig bis zum Verfalldatum, erklärt Hoferichter. Das heißt: Fünf Jahre lang gibt es – zumindest theoretisch – ein Nebeneinander neuer und alter Packungen. Die alten kann die Apotheke wie gehabt über den bisherigen PZN-Strichcode („Code 39“) scannen. Hubmann beruhigt: Übersieht die Apotheke, dass eine Packung den Data-Matrix-Code trägt und scannt versehentlich den Code 39, erkennt die Software das Versehen und hakt nach. „Man wird den 9. Februar 2019 in der Praxis kaum spüren“.Dr. Reinhard Hoferichter
Und die Kosten?
Eine Frage, die sich den Apotheken angesichts all der technischen Neuerungen stellt, ist die nach den Kosten. Dass all das nicht umsonst sein kann, ist klar. Die Softwarehersteller werden voraussichtlich etwas mehr verlangen. Die ABDA selbst hält sich bei dem Thema allerdings bedeckt. Hubmann zufolge werden Kosten für das Zertifikat für das N-Ident-Verfahren anfallen. Zudem koste der eigene Apothekenserver etwas. In welcher Weise, in welcher Höhe und ab wann hierfür Geld von den Apotheken eingefordert werden wird, sei allerdings noch nicht klar. Hubmann versichert lediglich, dass dies noch nicht während des Regelbetriebs geschehen werde.
Letztlich stellt sich natürlich die Frage: Wie sicher wird securPharm vor Fälschungen schützen? Hoferichter ist sehr zuversichtlich, dass dies gelingen wird. „Wir haben uns jeden Fälschungsfall retrospektiv angeguckt und geprüft. Bisher können wir sagen: Wir hätten sie alle mit securPharm entdecken können.“ Allerdings weist er auch darauf hin, dass bis fünf Jahre nach dem Startschuss 2019 noch alte Packungen im Umlauf sein können – die leichter zu fälschen wären als die neuen. „Wirklich sicher wird das System daher erst ab dem 9. Februar 2024 sein.“ Die größte Gefahr an eine Fälschung zu geraten, ist allerdings noch immer der illegale Vertriebsweg. |
Noch Fragen?
Auf der securPharm-Webseite finden Sie im Bereich für Apotheker einen Katalog häufiger Fragen und Antworten, der regelmäßig aktualisiert wird. Dorthin finden Sie auch, wenn Sie auf DAZ.online in die Suchmaske den Webcode L5LU5 eingeben.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.