
- DAZ.online
- DAZ / AZ
- DAZ 47/2017
- Mythen der Hä...
Hygiene
Mythen der Händedesinfektion
Maßnahme zum Schutz vor Infektionen in Krankenhaus und Alltag
Im Unterschied dazu kann häufiges Waschen der Hände mit Seife ein Wegbereiter für Irritationsdermatosen sein, weshalb die Händewaschung in Gesundheitseinrichtungen auf die Reinigung der Hände beschränkt bleiben soll. Da alkoholische Händedesinfektionsmittel (HDM) nicht gegen Parasiten und Bakteriensporen wirksam sind, wird z. B. bei Clostridium-difficile-assoziierter Diarrhö eine Kittel-Handschuh-Pflege durchgeführt. Nach dem Ablegen der Handschuhe wird zuerst die alkoholische Händedesinfektion durchgeführt, erst danach werden die Hände gewaschen.
Infektionsprävention durch Händedesinfektion
Die hygienische Händedesinfektion ist die wirksamste Einzelmaßnahme zur Infektionsverhütung in Gesundheits- und Pflegeeinrichtungen.
Die WHO fordert deshalb unter dem Motto „Fight antibiotic resistance – it‘s in your hands“ medizinisches Personal auf, seine Hände in den von der WHO definierten Situationen zu desinfizieren, um die Ausbreitung von Krankheitserregern zu unterbinden [1]. Die Ursache der hohen Effektivität ist darin begründet, dass Bakterien und Hefepilze meist eine Stunde oder länger, Viren von zehn Minuten bis zu mehreren Stunden auf der Haut überleben können, diese transiente Hautflora durch die Händedesinfektion jedoch innerhalb von ≥ 15 Sekunden abgetötet [2] und dadurch die Übertragung verhindert wird.
Bereits in der ersten epochalen Publikation zur Händedesinfektion (1861) konnte Ignaz Philipp Semmelweis die Effektivität der Händehygiene zur Senkung der Müttersterblichkeit durch das Kindbettfieber eindrucksvoll belegen. Seitdem wurde in allen klinischen Settings der infektionspräventive Einfluss einer gesteigerten Händehygiene-Compliance mit Alkohol-basierten Desinfektionsmitteln nachgewiesen [3, 4]. Ebenso wird die Ausbreitung multiresistenter Gram-positiver und Gram-negativer Bakterien sowie von Viren und dadurch verursachter Infektionen reduziert [4, 5]. Schließlich ist die Effizienz der Händedesinfektion bei der Beherrschung von Ausbrüchen nachgewiesen [4] und elementarer Bestandteil der Präventionsbündel zur Prävention von NI [4, 6, 7].
Auch in Kindergärten, Schulen und bei Beschäftigten mit fortlaufendem Personenkontakt (zum Beispiel in Bibliotheken, Bürgerämtern u. ä.) ist der Nutzen der Händedesinfektion belegt. (Im weiteren Text werden nur Quellen angegeben, die nicht in [4] zitiert sind.)
In diesen Bereichen wird selbst durch ungezielte Händedesinfektion nicht nur die Erkrankungsrate durch gastrointestinale und respiratorische Infektionen herabgesetzt, sondern auch die Anzahl krankheitsbedingter Fehltage reduziert [4]. Das vom Bundesministerium für Gesundheit in der Universitätsmedizin Greifswald (UMG) geförderte „AHOI“ Projekt bezieht daher hospitalisierte Patienten und deren Besucher in die Umsetzung der Händedesinfektion ein [8, 9].
Wann müssen die Hände desinfiziert werden?
Die WHO hat basierend auf den Erkenntnissen zur Erregertransmission über die Hände die sich daraus ableitenden Indikationen in fünf Gruppen, die „five moments“ (s. u.), als Grundlage für die Schulung und das Training der Händedesinfektion zusammengefasst [3]. Dadurch sollen zugleich das Wiedererkennen von Indikationen im Arbeitsablauf erleichtert und Beobachtungen zur Compliance standardisiert werden. Die Indikationsgruppen beinhalten die Händedesinfektion
- unmittelbar vor einem Patientenkontakt und vor aseptischen Tätigkeiten sowie
- nach dem Kontakt mit potenziell infektiösen Materialien, nach Patientenkontakt und nach Kontakt mit der unmittelbaren Patientenumgebung.
Grundsätzlich soll auch nach dem Ablegen steriler und unsteriler medizinischer Schutzhandschuhe eine Händedesinfektion durchgeführt werden, weil eine Kontamination der Hand sowohl durch unbemerkte Perforation als auch beim Ablegen der Handschuhe nicht auszuschließen ist. Auch beim Eintritt in eine Gesundheits- oder Pflegeeinrichtung (Patient, Besucher) und vor dem Betreten von Risikobereichen innerhalb des Krankenhauses ist die Händedesinfektion zur Reduktion der Erregerlast zu empfehlen [4].
In Anlehnung an die WHO wurden in der UMG die „Fünf Momente“ für das Personal auf folgende Indikationen der Händedesinfektion für den Patienten übertragen [4, 8]:
- beim Betreten des Patientenzimmers,
- beim Verlassen des Patientenzimmers,
- vor der Esseneinnahme,
- nach Benutzung der Sanitäreinheit (WC),
- vor und nach Kontakt mit der eigenen Wunde, mit Schleimhäuten oder vor Betreten von Risikobereichen.
Voraussetzungen
Die Hände müssen glatt, gepflegt und durch das Händedesinfektionsmittel (HDM) auf der gesamten Oberfläche benetzt werden.
Fingernägel sollen kurzgeschnitten sein und mit den Fingerkuppen abschließen. Nagellack ist nicht zulässig, weil mit zunehmendem Alter der Lackschicht darauf keine Desinfektionswirkung mehr erreichbar ist. Das Tragen künstlicher und gegelter Fingernägel ist unzulässig, weil sich im Klebebereich ein Biofilm ausbildet, der der Desinfektion nicht zugänglich ist. Dadurch wurde eine Reihe von Ausbrüchen verursacht [4]. In allen Bereichen, in denen eine Händedesinfektion durchgeführt wird, dürfen an Händen und Unterarmen keine Ringe, Armbänder, Armbanduhren oder Piercings einschließlich Dermal Anchor getragen werden, weil dadurch der Erfolg der Händedesinfektion infrage gestellt wird.
Durchführung der Händedesinfektion
Für die Dauer der deklarierten Einwirkungszeit müssen alle Bereiche der Hand vom HDM benetzt werden; dabei sind insbesondere Fingerspitzen, Nagelfalze und Daumen zu berücksichtigen. Wenn auch die Unterarme kontaminiert sind, sind sie in die Desinfektion einzubeziehen.
Bei einer sichtbaren Kontamination der Hände sollte diese zuvor mit einem mit HDM getränkten Papierhandtuch, Zellstoff oder Ähnlichem entfernt werden. Stark verschmutzte Hände können zunächst vorsichtig abgespült und dann gewaschen werden. Dabei sind die Umgebung und Kleidung vor Kontamination zu schützen. Der gegebenenfalls kontaminierte Bereich ist danach zu desinfizieren, und bei Kontamination des Kittels ist dieser zu wechseln. Abschließend werden die Hände desinfiziert.
Üblicherweise werden Desinfektionsmittelspender mit Einmalflaschen bestückt. Das Umfüllen von Desinfektionsmittelspendern ist unter der Verantwortung des Arztes oder Apothekers jedoch rechtlich zulässig. Aus medizinischer Sicht und aus haftungsrechtlichen Gründen sind hierbei als hygienischer Mindeststandard die Reinigung, Desinfektion und Sterilisation des Desinfektionsmittelbehälters vor der Neubefüllung, das aseptische Umfüllen (sterile Werkbank) und die Dokumentation der Chargennummer bzw. des Umfülldatums einzuhalten; ferner ist die Durchführung durch geschultes Personal zu gewährleisten. Das Prozedere ist in einer SOP zu fixieren.
Der Umfüllende haftet für das hergestellte Produkt. Ein umgefülltes Desinfektionsmittel darf nicht an andere abgegeben werden. Das Umfüllen von Desinfektionsmittelspendern kann im Fall einer Infektion haftungsrechtlich relevant werden. Die Notwendigkeit für die strenge Vorgabe ergibt sich, weil Bakteriensporen in alkoholischen Desinfektionsmitteln überleben und z. B. in eine Wunde gelangen könnten (Risiko von Gasbrand und Tetanus). Das tatsächliche Risiko ist jedoch minimal. So wurden zwar in 18% der Proben von Händedesinfektionsmitteln nach längerem Stehenlassen geöffneter Flaschen Bakteriensporen gefunden, jedoch < 1 Spore/10 ml und in keinem Fall Sporen pathogener Bakterienspezies [4].
Wirkungsspektrum von HDM
Händedesinfektionsmittel (HDM) enthalten die Alkohole Ethanol, Propan-1-ol (n-Propanol) oder Propan-2-ol (Isopropanol) als Monowirkstoff oder in unterschiedlichen Mischungen. Ihr Wirkungsspektrum umfasst vegetative Bakterien einschließlich multiresistenter Stämme, Hefepilze und Viren: Begrenzt viruzide HDM sind nur wirksam gegen behüllte Viren, begrenzt viruzid Plus HDM gegen Adeno-, Noro- und Rotaviren und viruzide HDM auch gegen die übrigen unbehüllten Viren (Tab. 1).
Deklarierung |
Testviren [12, 13] |
Beispiele zum Wirkungsspektrum |
|---|---|---|
begrenzt viruzid |
Vacciniavirus Stamm Elstree bzw. Modified Vacciniavirus Ankara und bovine Viral Diarrhea Virus Stamm NADL |
Influenza-, Herpes-, Tollwut-, Masern-, Mumps-, Rötelnviren, HIV, HBV, HCV, RSV, CMV |
begrenzt viruzid Plus |
Vacciniavirus + Adenovirus Typ 5 Stamm Adenoid 75 und murines Norovirus Stamm S99 Berlin |
Adeno-, Noro-, Rotaviren |
viruzid |
Norovirus, Adenovirus + Poliovirus-Impfstamm Typ I, Stamm LSc-2ab und Polyomavirus (SV40) Stamm 777 |
Boca-, Parvo-B19-, Picorna-, Hepatitis-A-Viren |
Zur Inaktivierung unbehüllter Viren werden spezielle Zubereitungen benötigt, die wegen der höheren Wirksamkeit des Ethanols gegen Viren als Wirkstoffgrundlage entweder Ethanol 95% m/m enthalten oder bei geringerem Ethanolgehalt mit Phosphorsäure oder mit einer Kombination von Harnstoff und Milchsäure als synergistisch wirkendem Zusatz kombiniert sind [4, 10].
Nach der Versorgung von Patienten mit Viruserkrankungen bzw. nach dem Umgang mit virushaltigem Material ist das HDM in Abhängigkeit von der zu erwartenden Virusspezies auszuwählen; die o. g. Einteilung beruht auf der Wirksamkeit gegen die jeweiligen Testviren (Tab. 1). Das HDM muss den Virustiter im quantitativen Suspensionstest innerhalb der deklarierten Einwirkzeit um vier Logarithmen-Stufen (lg) vermindern. Die Empfindlichkeit gegenüber HDM hängt bei unbehüllten Viren vom Grad ihrer Lipophilie bzw. Hydrophilie und bei behüllten Viren von deren Lipidgehalt ab. Unbehüllte Viren mit hoher Hydrophilie reagieren nicht mit Lipiden und sind demzufolge am resistentesten gegen Alkohole [11].
In die jährlich aktualisierte Desinfektionsmittelliste des Verbunds für Angewandte Hygiene (VAH) werden auf Antrag des Herstellers und nach der Bewertung durch die Desinfektionsmittelkommission des VAH nur Präparate aufgenommen, die die Prüfanforderungen des VAH erfüllen [14]. Diese berücksichtigen auch europäische Normen und für den Nachweis der Viruzidie die Anforderungen der DVV/RKI-Leitlinie [12].
Die neun Mythen der Händehygiene
1. Mythos: Die Händewaschung verhütet NI und unterbricht Kreuzinfektionen: In keiner Studie war die Prävention bakterieller oder viraler nosokomialer Infektionen (NI) durch Händewaschen nachweisbar [4]. Der Grund ist ihre weitaus geringere Wirksamkeit (Reduktion der transienten Hautflora < 0,3 lg) im Vergleich zu Alkoholen. Ausnahmen sind Bakteriensporen, Helminthen, Kryptosporidien, Oozysten und Protozoen, weil Alkohole gegen diese Erreger unwirksam sind. Deshalb wird z. B. bei Clostridium-difficile-assoziierter Diarrhö eine Kittel-Handschuh-Pflege und nach dem Ablegen der Handschuhe und der Händedesinfektion eine Seifenwaschung empfohlen, durch die die Erreger mechanisch entfernt werden (bis 2 lg) [4].
2. Mythos: Die Händewaschung ist besser verträglich als die alkoholische Händedesinfektion: Das Gegenteil ist der Fall: Die Händewaschung ist signifikant schlechter verträglich, nachgewiesen anhand der Parameter Entfettung, transepidermaler Wasserverlust, Rauigkeit, Austrocknung und Schuppung [4]. Trotzdem ist insbesondere bei längerem Handschuhtragen (> 2 h) in einem sogenannten Hautschutzplan die Anwendung von Hautschutzcreme zu Dienstbeginn und nach der Mittagspause sowie von Hautpflegecreme am Dienstende festzulegen, weil dadurch der Hautzustand signifikant verbessert wird, ohne dass die Wirksamkeit der Händedesinfektion beeinträchtigt wird [4].
Die Händewaschung ist einmalig zu Arbeitsbeginn indiziert, um Schmutz und Bakteriensporen zu entfernen. Risikoabhängig kann sie auch vor der Essenszubereitung und -verteilung, nach der Toilettenbenutzung und nach dem Naseputzen durchgeführt werden. Im Fall eines Ausbruchgeschehens sollten auch flüssige Seifen in die Umgebungsuntersuchung einbezogen werden, da sie vereinzelt Quelle für Gram-negative Bakterien waren [4].
3. Mythos: Ein Ethanolgehalt zwischen 65% und 75% v/v ist ausreichend: Bei einem Gel mit 60% v/v Ethanol war kein Einfluss auf die NI-Rate nachweisbar [4]. Bei der Prüfung eines HDM mit 72% v/v Ethanol erreichte dieses weder die Wirksamkeit des Referenzverfahrens zur hygienischen noch zur chirurgischen Händedesinfektion [Kramer, unveröffentlicht]. Zur ausreichenden Wirksamkeit wird ein Ethanolgehalt ≥ 80% v/v benötigt.
4. Mythos: Ethanol-basierte HDM mit ≥ 80% v/v Ethanol sind irritativer als solche mit < 80% v/v: Experimentell wurde die Hauthydratation durch 80% Ethanol weniger herabgesetzt als durch 70% oder 60% Ethanol. Tendenziell verringert Ethanol sogar die durch ein Detergens verursachte Hautveränderung [4]. Daher sind Ethanol-basierte HDM mit ≥ 80% v/v Ethanol Mittel der Wahl.
5. Mythos: Das Risk Assessment der Ethanolresorption durch Händedesinfektion ist klar: Die durch Händedesinfektion resorbierten Ethanolmengen liegen toxikologisch im physiologischen Bereich. Sie führen nicht zum Anstieg des Alkoholismusmarkers Ethylglucuronid, was die Unbedenklichkeit unterstreicht [4]. Propanole werden in vergleichbaren Mengen resorbiert. Da ihr physiologischer Blutspiegel weit unter dem für Ethanol liegt (Tab. 2), sind die Konsequenzen einer berufslebenslangen Anwendung Propanol-basierter HDM unklar. Hierbei ist zu berücksichtigen, dass sich für Pflegepersonal im Nichtrisikobereich während einer Schicht durchschnittlich 110 Indikationen für die Händedesinfektion ergeben [Kramer et al., in Vorbereitung]. Daher ist Ethanol-basierten HDM zumindest in der Neonatologie und bei Kindern < 1 Jahr der Vorzug zu geben.
Alkohol |
Baseline |
Anstieg über Baseline |
|---|---|---|
Ethanol |
0,005 ‰ |
6-fach |
Propan-1-ol |
< 0,001 ‰ |
90-fach |
Propan-2-ol |
< 0,0001‰ |
500-fach |
6. Mythos: Remanente Zusätze erhöhen die Effektivität alkoholischer HDM und sind harmlos: Der Zusatz von antiseptischen Wirkstoffen wie Chlorhexidin, Octenidin, Mecetroniumetilsulfat, 2-Phenylphenol, PVP-Iod, Quats und Triclosan erhöht die Wirksamkeit der Händedesinfektion weder im Testmodell noch epidemiologisch [17], er erhöht aber das Risiko von Nebenwirkungen (z. B. Allergie, Resistenzentwicklung, Schilddrüsengefährdung durch Iod) und wird deshalb nicht empfohlen [4].
7. Mythos: Die Mindesteinwirkzeit für die hygienische Händedesinfektion muss 30 Sekunden betragen: Schon innerhalb von 15 Sekunden wird bei trainiertem Personal die gesamte Hautoberfläche ausreichend benetzt [18]. Ebenso war die Verkürzung auf 15 Sekunden mit keiner Wirkungseinschränkung verbunden [19]. Auch im Stationsalltag wurde die Wirksamkeit der Händedesinfektion durch die Verkürzung von 30 Sekunden auf 15 Sekunden Einwirkungszeit nicht beeinträchtigt, jedoch stieg dadurch die Compliance der Händedesinfektion signifikant an [20].
8. Mythos: Die Messung des HDM-Verbrauchs reicht aus, um die Compliance der Händedesinfektion zu verbessern: Zur Verbesserung der Compliance auf > 50% sind multimodale Interventionsprogramme erforderlich. Sie umfassen regelmäßige Personalfortbildungen, die Verbrauchsmessung des HDM mit Ergebnisrückmeldung und gegebenenfalls gezielter Intervention, die Verbesserung der Verfügbarkeit von HDM, die Nutzung von Erinnerungs- und Werbematerialien sowie die Unterstützung durch die Leitung. Zur nachhaltigen Verbesserung der Compliance nimmt die Prozessoptimierung eine Schlüsselfunktion ein, denn durch optimalen Workflow kann die Anzahl der Indikationen zur Händedesinfektion reduziert werden [4].
9. Mythos: Die behandschuhte Hand darf auf keinen Fall desinfiziert werden: Auf der behandschuhten Hand ist eine tendenziell höhere Wirksamkeit als auf der bloßen Hand erreichbar [4]. Da Mikroperforationen nicht erkennbar sind, soll die behandschuhte Hand nur dann desinfiziert werden, wenn andernfalls der Arbeitsablauf nicht gewährleistet werden kann. Bei sichtbarer Perforation, bei Kontamination mit Blut, Sekreten oder Exkreten sowie mit unbehüllten Viren sowie nach einer Patientenwaschung (Anstieg der Perforationsrate) soll der Handschuh gewechselt werden [4].
Wie und womit desinfizieren?
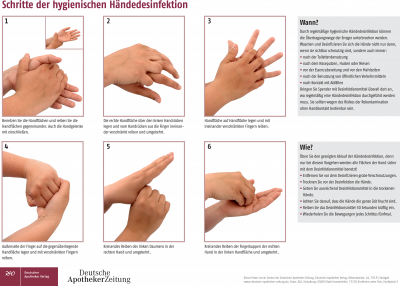
Als Service für die Abonnenten der DAZ haben wir ein Poster erstellt, das die vorbildliche hygienische Händedesinfektion in sechs Schritten zeigt. Sie gelangen dorthin, wenn Sie in die Suchfunktion auf DAZ.online den Webcode J7UP9 eingeben.
Zudem enthält das zweiseitige Merkblatt „Richtig desinfizieren“ eine aktuelle Liste der vom Robert Koch-Institut geprüften und anerkannten Mittel zur Händedesinfektion auf der Basis der Alkohole Ethanol, n-Propanol und Isopropanol. Das Merkblatt können Sie hier downloaden.
Fazit
In Gesundheits- und Pflegeeinrichtungen muss die Notwendigkeit der Händedesinfektion von jedem Teammitglied so verinnerlicht werden wie das Bedürfnis nach Essen und Trinken. Aber auch im häuslichen Bereich sowie in kommunalen Bereichen kann die Händedesinfektion sinnvoll sein.
In Gesundheits- und Pflegeeinrichtungen ist die Vernachlässigung der Händedesinfektion kein Kavaliersdelikt, da sie für den Patienten lebensgefährliche Folgen haben kann. Aber auch Patienten und Besucher können durch Händedesinfektion zu ihrem Infektionsschutz beitragen.
Bei der häuslichen Pflege von Familienangehörigen kann die Händedesinfektion ebenfalls indiziert sein, zum Beispiel vor einem Verbandwechsel, bei der Dekolonisierung von MRSA-Trägern oder vor dem Kontakt mit schwer immunsupprimierten Angehörigen [21, 22]. Ebenso kann die Händedesinfektion zur Unterbrechung von Kreuzkontaminationen innerhalb der Familie bei Erkrankung eines Familienmitglieds durch eine Infektionskrankheit beitragen, zum Beispiel bei akutem Brech-Durchfall durch Noroviren oder bei Schnupfen (Rhinoviren). So sind bei 65% der Personen mit Schnupfen die Hände mit dem Virus kontaminiert [23], bei Rotavirusinfektion noch häufiger [24].
Sofern in anderen öffentlichen Bereichen HDM in Spendern bereitgestellt werden, empfiehlt sich deren Nutzung. Das ist besonders in Zeiten mit erhöhtem Infektionsrisiko relevant, z. B. bei epidemischem Auftreten von Virusgrippe oder von Noro- und Rotavirusinfektionen [25]. |
Literatur
[1] www.emro.who.int/media/news/fight-antibiotic-resistance-its-in-your-hands.html
[2] Kampf G, Kramer A. Händehygiene. In: Kramer A et al (Hrsg). Krankenhaus- und Praxishygiene, 3. Aufl. München: Urban Fischer, 11-15
[3] Pittet D, Allegranzi B, Boyce J. World Health Organization World Alliance for Patient Safety First Global Patient Safety Challenge Core Group of Experts. The World Health Organization Guidelines on Hand Hygiene in Health Care and their consensus recommendations. Infect Control Hosp Epidemiol 2009;30(7):611-22
[4] Kramer A et al. Händehygiene in Einrichtungen des Gesundheitswesens. Empfehlung der Kommission für Krankenhaushygiene und Infektionsprävention (KRINKO) beim Robert Koch-Institut (RKI). Bundesgesundheitsblatt 2016;59:1189-1220
[5] Barker J, Stevens D, Bloom SF. Spread and prevention of some common viral infections in community facilities and domestic homes. J Appl Microbiol 2001,91:7-21
[6] Huang GK, Stewardson AJ, Grayson ML. Back to basics: hand hygiene and isolation. Curr Opin Infect Dis 2014;27(4):379-89
[7] Kramer A et al. Maßnahmen der Basishygiene zur Prävention von Surgical Site Infections (SSI). Zbl Chir 2016;141(05):493-6
[8] Kramer A, Heidecke CD. Der Patient gehört mit ins Boot. kma 2016;21:94-6
[9] Hassel AV et al. Patienten und Angehörige mit an Bord. KU Gesundheitsmanag 2017;80(10):109-11
[10] Ionidis G et al. Development and virucidal activity of a novel alcohol-based hand disinfectant supplemented with urea and citric acid. BMC Infect Dis 2016;16:77
[11] Rheinbaben von F, Steinmann E, Steinmann J. Virusinaktivierung. In: Kramer A et al (Hrsg). Krankenhaus- und Praxishygiene, 3. Aufl. München: Urban Fischer, 56-61
[12] DVV/RKI. Leitlinie der Deutschen Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) e. V. und des Robert Koch-Instituts (RKI) zur Prüfung von chemischen Desinfektionsmitteln auf Wirksamkeit gegen Viren in der Humanmedizin – Fassung vom 1. Dezember 2014. Bundesgesundheitsblatt 2015;58:493-504
[13] DIN EN 14476:2015-12. Quantitativer Suspensionsversuch zur Bestimmung der viruziden Wirkung im humanmedizinischen Bereich – Prüfverfahren und Anforderungen (Phase2/Stufe1). Hamburg: Beuth, 2015
[14] Desinfektionsmittel-Kommission im VAH. Anforderungen und Methoden zur VAH-Zertifizierung chemischer Desinfektionsverfahren. Wiesbaden: mhp, 2015
[15] Kramer A et al. Quantity of ethanol absorption after excessive hand disinfection using three commercially available hand rubs is minimal and below toxic levels for humans. BMC Infect Dis 2007;7:117
[16] Below H et al. Dermal and pulmonary absorption of propan-1-ol and propan-2-ol from hand rubs. Am J Infect Control 2012;40(3):250-7
[17] Kampf G, Suchomel M, Kramer A. Lack of sustained efficacy for alcohol-based surgical hand rubs containing ‘residual active ingredients’ according to EN 12791. J Hosp Inf 2017;95:163-8
[18] Paula H et al. Wettability of hands during 15s and 30s contact intervals: a prospective, randomized cross-over study. Infect Control Hosp Epidemiol (in rev.)
[19] Pires D et al. Hand hygiene with alcohol-based hand rub: how long is long enough? Infect Control Hosp Epidemiol 2017;38(5):547-52
[20] Kramer A et al. Shortening the application time of alcohol-based hand rubs to 15 s may improve frequency of hand antisepsis actions in a neonatal intensive care unit. Inf Contr Hosp Epidemiol; Epub 30.10.2017
[21] Kampf G, Dettenkofer M. Disinfection in the domestic area – what is really meaningful? Hyg Med 2011;36(1/2):8-11
[22] Aiello AE et al. Effect of hand hygiene on infectious disease risk in the community setting: a meta-analysis. Am J Public Health 2008;98(8):1372-81
[23] Gwaltney JM et al. Hand-to-hand transmission of rhinovirus colds. Ann Intern Med 1978;88(4):463-67
[24] Akhter J et al. Viral contamination of environmental surfaces on a general paediatric ward and playroom in a major referral centre in Riyadh. Eur J Epidemiol 1995;11(5):587-90
[25] Apisarnthanarak A et al. Intervention with an infection control bundle to reduce transmission of influenza-like illnesses in a Thai preschool. Inf Contr Hosp Epidemiol 2009;30(9):817-22























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.