
- DAZ.online
- DAZ / AZ
- DAZ 42/2017
- Ein Parasit zur ...
Immunologie
Ein Parasit zur Nahrungsergänzung?
Konfektionierte Schweinepeitschenwurmeier sollen entzündliche Erkrankungen lindern
Parasitische Würmer
Parasitische Würmer gehören zum „Inneren Zoo“ des Menschen. Etwa 60 Arten von Saug-, Band- und Rundwürmern (oder exakt: Trematoden, Zestoden, Nematoden) treten beim Menschen auf; viele waren vor der Einführung strikter Hygienestandards auch in Deutschland weit verbreitet.
Die größte Artenvielfalt zeigen die parasitischen Nematoden oder Rundwürmer (auch: Fadenwürmer), die meist im Darm leben. Sie können Verdauungsstörungen, Durchfälle, Entzündungen und gelegentlich auch schwere Erkrankungen hervorrufen, sind aber in der Regel nicht klinisch relevant, solange sie nicht in sehr großer Zahl auftreten. Die meisten Arten haben sich im Lauf der Evolution auf eine bestimmte Spezies von Wirten spezialisiert und sind für nah verwandte Wirtsarten nicht infektiös. Zum Erfolgsrezept eines „guten“ Parasiten gehört einerseits, dass er seinen Wirt nicht umbringt, denn damit würde er sich die eigene Lebensgrundlage entziehen. Andererseits dürfen Parasiten sich aber auch nicht vom ausgefeilten Immunsystem ihrer Wirte eliminieren lassen und haben deshalb eine Vielzahl von Mechanismen entwickelt, um Immunreaktionen zu verhindern, zu unterlaufen oder in ihrem Sinne zu manipulieren [1]. Parasiten sind also geborene Immunologen und wurden auch schon als „Meister der Manipulation“ bezeichnet.
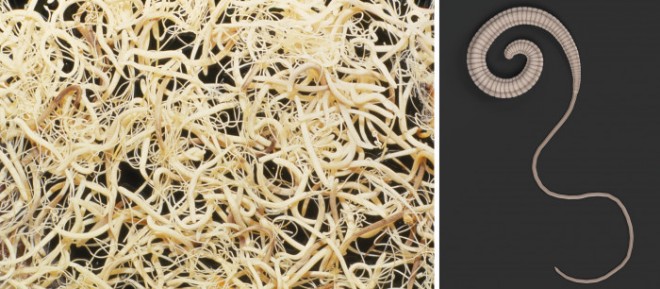
Auch Trichuris suis, der Schweinepeitschenwurm, gehört zu den Nematoden. Andere Arten der Gattung Trichuris infizieren andere Säugetiere, z. B. T. trichiura den Menschen und T. muris die Maus; zur Lebensweise dieser Würmer hat man relativ gute Daten. T. suis ist 3 bis 6 cm lang, wobei die Weibchen etwas länger als die Männchen sind. Die Würmer haben ein dünnes, lang ausgezogenes Vorderende und ein dickes Hinterende, in dem die Reproduktionsorgane liegen. Sie sehen aus wie eine Peitsche mit dickem Griff und langer Schnur, daher der Name „Peitschenwurm“ (Abb. 1 und 2).
Die Trichuris-Arten leben in engem Kontakt mit der Darmmukosa. Ihr dünnes Vorderende ist in die Epithelschicht eingebettet und bewirkt eine Verschmelzung von Zellen, sodass schon fast eine intrazelluläre Lebensweise vorliegt, während das dicke Hinterende frei auf der Darmoberfläche liegt.
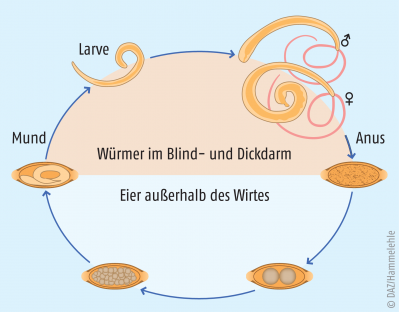
T. suis besiedelt Caecum und Colon (Blind- und Dickdarm) des Schweins. Die nach der Paarung vom Weibchen produzierten Eier sind hellbraun und haben eine charakteristische, Zitronen-ähnliche Form, wobei die beiden Pole mit einem faserigen Pfropfen verschlossen sind. Sie werden mit dem Kot ausgeschieden, und unter Zutritt von Sauerstoff entwickelt sich in ihnen eine Larve. Wenn die Eier oral aufgenommen werden, passieren sie den Magen unbeschadet. Erst am Übergang zwischen Dünn- und Dickdarm lösen sich die Pfropfen auf, und die Larve schlüpft, wenn sie geeignete Stimuli erhält. Sie invadiert dann das Darmepithel, wo sie sich zum Wurm weiterentwickelt (Abb. 3). Auch wenn Menschen die entwickelten Eier von T. suis aufnehmen, schlüpfen die Larven und beginnen ihre Entwicklung, sie kommen allerdings in dem für sie ungeeigneten Wirt Mensch nicht zur Geschlechtsreife. Damit ist eine Infektion mit T. suis selbstlimitierend und nicht ansteckend für andere Menschen.
Zunahme von Allergien, Asthma und Autoimmunerkrankungen
In den letzten Jahrzehnten hat in Deutschland und in anderen Industrieländern die Häufigkeit von Allergien, Asthma und manchen Autoimmunerkrankungen massiv zugenommen [2, 3]. Besonders gut lässt sich dieser Trend für die Allergien darstellen, da hier umfangreiche Daten vorliegen. Während Allergien noch in den 1950er- und 1960er-Jahren selten waren, hat mittlerweile fast jeder fünfte Deutsche eine Allergie, sei es gegen Pollen, Hausstaubmilben oder bestimmte Lebensmittel [2] (Abb. 4).
Etwa 8,5% der Bevölkerung erkranken während ihres Lebens an Asthma [4]. Ebenfalls stark angestiegen sind Autoimmunerkrankungen wie Rheumatoide Arthritis, Typ‑1-Diabetes, Multiple Sklerose oder chronische Darmentzündungen (Colitis ulcerosa, Morbus Crohn), von denen z. B. in Dänemark 5,3% der Bevölkerung betroffen sind [5].
Die Hygienehypothese
In jenen Weltregionen, in denen Menschen noch eine ursprünglichere Lebensweise haben, hat es einen vergleichbaren Anstieg nicht gegeben, und teilweise sind Allergien, Asthma und Autoimmunerkrankungen dort so gut wie unbekannt. Und auch bei landwirtschaftlich tätiger Bevölkerung in Ländern mit „westlichem Lebensstil“ sind diese durch Immunreaktionen bedingten Krankheiten seltener als bei Städtern.
Man hat daraus geschlossen, dass ein Leben in der Natur – in engem Kontakt mit Haustieren, mit ständiger Anwesenheit von Schmutz, Bakterien und Parasiten – Allergien, Asthma und Autoimmunerkrankungen vorbeugt. Jedenfalls ist dies die Kernaussage der „Hygienehypothese“, die mittlerweile von vielen Wissenschaftlern akzeptiert wird. Demnach trainiert eine Konfrontation mit Umweltkeimen und -substanzen die regulatorischen Kreisläufe unseres Immunsystems und hemmt damit überschießende Immunantworten. Gerade eine ständige Exposition im frühen Kindesalter und weiterhin andauernder Kontakt schützen anscheinend vor unangenehmen und z. T. lebensbedrohenden entzündlichen Erkrankungen [6]. Zu solchen Umweltfaktoren gehören auch parasitische Würmer.
Würmer als „Immunbremse“
Schon seit Jahrzehnten werden sporadisch Beobachtungen publiziert, die auf eine negative Korrelation zwischen Wurminfektionen und allergischen Erkrankungen hinweisen. Aber erst eine breiter angelegte Studie, die 2000 in der angesehenen Zeitschrift Lancet veröffentlicht wurde, brachte den Zug ins Rollen. Hier zeigte die Gruppe von Maria Yazdhanbakhsh aus Leiden, dass Kinder in Gabun, die mit dem Wurmparasiten Schistosoma mansoni infiziert waren (in diesem Fall kein Nematode, sondern ein Trematode), weniger allergische Hautreaktionen aufwiesen [7]. Sie konnten dies auf das hemmende Zytokin Interleukin 10 zurückführen, das von Immunzellen infizierter Kindern in viel größeren Mengen gebildet wurde als von den Zellen der Kontrollgruppe. IL-10 wird u. a. von regulatorischen T-Zellen gebildet und reguliert Entzündungsreaktionen herab. In dieselbe Richtung zeigten auch Interventionsstudien, bei denen Kinder mit chronischen Wurminfektionen entwurmt wurden: Die Häufigkeit von allergischen Hautreaktionen und Asthma stieg nach anthelminthischer Therapie deutlich an.
Diesen wegweisenden Studien folgte eine Vielzahl von Versuchen, in denen Mäuse mit Nematoden und anderen Würmern infiziert oder mit Wurmkomponenten behandelt wurden.
Fazit: Sowohl der Kontakt mit lebenden Parasiten als auch mit Parasitenmaterial hemmte verschiedenste Entzündungsreaktionen. Behandelte Mäuse hatten u. a. schwächere Allergien, weniger starke Colitis, schwächer ausgeprägte Entzündungsreaktionen gegen Grippeviren, weniger rheumatische Veränderungen, kleinere Magengeschwüre oder weniger Hirnentzündungen als entsprechende Kontrolltiere. In vielen Fällen war die schwächere Entzündungsreaktion auf das Zytokin IL-10 zurückführbar. Auch regulatorische T-Zellen und immunmodulierende Dendritische Zellen sowie regulatorische Makrophagen wurden als Wirkprinzipien identifiziert. Analysen ergaben außerdem, dass Infektionen mit Wurmparasiten zwar starke Immunantworten induzieren, die entstehenden Reaktionen aber in Richtung der weniger aggressiven TH2-Antwort drängen. Durch diese Abschwächung und Polarisierung der Immunantwort wurden bei mit Würmern infizierten Mäusen sowohl Immunantworten gegen Parasitenkomponenten als auch gegen Antigene anderen Ursprungs herabreguliert. Ganz ähnlich könnten beim Menschen die eigentlich schädlichen Parasiteninfektionen die positive Nebenwirkung haben, überschießende Immunantworten gegen harmlose Antigene zu bremsen.
Alternative zu Darmoperationen?
Könnten sich diese Ergebnisse auch auf Menschen übertragen lassen? Diese Frage stellten sich der Gastroenterologe Joel Weinstock und seine Kollegen von der University of Iowa (USA) Ende des letzten Jahrhunderts. Weinstock war bei seiner Arbeit immer wieder mit Fällen von chronischen Darmentzündungen (Colitis ulcerosa und Morbus Crohn) konfrontiert, bei denen eine Therapie mit konventionellen Medikamenten nicht mehr ansprach. Bei solchen Patienten besteht die letzte Behandlungsoption in der chirurgischen Entfernung des entzündeten Darmabschnittes, was mit dem Anlegen eines künstlichen Darmausganges verbunden ist. Ein solches „Stoma“ schränkt die Lebensqualität stark ein. Außerdem führt eine Entfernung des Dickdarms häufig zur Entstehung von Arthritis, d. h. schmerzhaften und behindernden Gelenkentzündungen. Patienten sind in dieser Lage nur allzu gern bereit, auch exotische Therapien auszuprobieren, bevor sie sich mit einer Darmoperation abfinden.
Weinstock ging von der Überlegung aus, dass eine Modulation von Immunantworten, wie sie Darmnematoden hervorrufen, auch die Entzündungen im Darm seiner Patienten hemmen könnte. Er verabreichte seinen Patienten deshalb mehrfach jeweils mehrere tausend Eier des Schweinepeitschenwurms T. suis. Zwei klinische Studien, die 2005 in angesehenen Zeitschriften veröffentlicht wurden, zeigten ein überraschend gutes Ergebnis dieser Wurmtherapie: Bei 43% der Patienten mit Colitis ulcerosa besserte sich die Erkrankung, während dies nur bei 17% der Patienten in der Placebo-Gruppe der Fall war. Bei Morbus-Crohn-Patienten war eine Remission sogar bei 72,4% der Patienten zu beobachten [8, 9]. Offensichtlich hatten die jungen Würmer das Immunsystem so stark beeinflusst, sodass die chronischen Entzündungen zum Erliegen kamen.
Gewinnung therapeutisch verwendbarer Wurmeier
Diese guten Ergebnisse motivierten die deutsche Firma Dr. Falk Pharma und die amerikanische Firma Coronado Biosciences zur Finanzierung weiterer klinischer Studien. Eine wichtige Voraussetzung dafür war die Produktion von Wurmeiern einer Qualität, die strengsten Sicherheitsstandards entsprach – kein leichtes Unterfangen bei einem „Medikament“, das letztendlich aus dem Darm von Schweinen stammt. Die Lösung bestand darin, dass man spezifische pathogenfreie (SPF-) Schweine infizierte und aus deren Darm gravide weibliche Würmer gewann. Diese wurden nach aufwendigen Waschschritten in keimfreiem Kulturmedium im Brutschrank gehalten, um die von ihnen ausgeschiedenen Eier zu gewinnen, die wiederum intensiv desinfiziert und gewaschen wurden. Um eine längere Haltbarkeit zu gewährleisten, wurde dabei das Herstellungsprotokoll gegenüber den ursprünglichen Studien leicht verändert. Erst nachdem nachgewiesen worden war, dass die produzierten Wurmeier frei von bakteriellen und viralen Pathogenen waren, und auch die Schlupffähigkeit der Larven sichergestellt war, erlaubte die Europäische Arzneimittelagentur die klinische Prüfung von T. suis-Eiern.
Klinische Studien mit Trichuris-suis-Eiern
Zwei größere, Placebo-kontrollierte klinische Studien zur Wirkung von T. suis-Eiern auf Morbus Crohn wurden in Europa bzw. den USA durchgeführt. Sie umfassten 252 bzw. 212 Patienten mit milder bis moderater Ausprägung der Krankheit. Die Therapie verbesserte das Krankheitsbild, allerdings trat auch in den Placebo-Gruppen bei über 40% der Patienten ein positiver Effekt auf. Aufgrund dieser außergewöhnlich hohen Placebo-Wirkung waren keine statistisch signifikanten Unterschiede zwischen Verum- und Placebo-Gruppe festzustellen.
Es starteten auch kleinere klinische Studien zur Wirkung von T. suis auf Zöliakie, Heuschnupfen (allergische Rhinitis), Nussallergie, Psoriasis, Multiple Sklerose und Autismus. Zwar erbrachte keine dieser Studien statistisch signifikante Verbesserungen des Krankheitsbildes. Durchgehend wurde aber bei allen Studien beobachtet, dass keine oder nur geringe Nebenwirkungen auftraten, sodass die Behandlungsmethode als solche unbedenklich ist [10]. Das enttäuschende Ergebnis zwang die Firmen zur Einstellung der Produktion der Wurmeier, was auch den Abbruch mehrerer noch laufender Studien bedeutete, da die für die Therapie benötigten Wurmeier fehlten.
Wurmeier als Novel Food?
Aktueller Stand der Dinge ist, dass die in Hamburg registrierte Firma Enteron Science GmbH jetzt in Deutschland die Zulassung der T. suis-Eier als „Novel Food“ beantragt hat. Produzent der Wurmeier ist die thailändische Firma Tanawisa – ein Familienbetrieb, dessen deutsch-thailändische Eigner die Wurmeier bereits für die klinischen Prüfungen in den USA und Europa nach GMP-Richtlinien herstellten und für ihr Produkt von der thailändischen Food and Drug Administration eine Zulassung als Naturheilmittel erhielten. Würde diesem Antrag stattgegeben, könnte eine europäische Zulassung erfolgen, sofern nicht andere Länder der EU ihr Veto einlegen. Für Novel Food muss keine Wirksamkeit nachgewiesen werden, es muss lediglich die Ungefährlichkeit bescheinigt werden. Nach den positiv verlaufenen, umfangreichen Sicherheitsprüfungen vor der Zulassung und den positiven Erfahrungen bei den klinischen Prüfungen sollte man erwarten, dass diese Unbedenklichkeit anerkannt wird, soweit nicht mittlerweile andere Erkenntnisse vorliegen.
Natürlich wird mancher fragen, ob man etwas zulassen soll, dessen Wirksamkeit nicht zweifelsfrei in klinischen Studien nachgewiesen werden konnte. Ebenso könnte mancher argumentieren, dass man dem Verbraucher den möglicherweise unnützen Kauf eines teuren Produktes ersparen sollte, denn immerhin kosten zehn Dosen Wurmeier zur Behandlung einer erwachsenen Person ca. 2000 Euro. Allerdings spricht gegen eine solche Restriktion, dass die Patienten der ersten klinischen Studien ja von der Behandlung profitiert hatten. Möglicherweise verliefen die späteren großen Studien zu Morbus Crohn negativ, weil daran Patienten in frühen Erkrankungsstadien teilgenommen hatten. Auch die geringen Änderungen im Herstellungsprotokoll könnten für die negativen Ergebnisse der späteren Studien mit verantwortlich gewesen sein.
Für die Zulassung eines Produktes mit garantierter Qualität würde auch sprechen, dass dafür ein Bedarf besteht. Denn gegenwärtig beschaffen interessierte Patienten sich Wurmeier mit fragwürdiger Qualität aus dubiosen Quellen im Internet – zu teils horrenden Preisen.
Pro und kontra
Mich selbst hat das Gespräch mit einer sehr sachkundigen Patientin stark beeindruckt, die überzeugend schilderte, wie sie ihre lebensbedrohliche multiple Nahrungsmittelallergie dank T. suis-Eiern für die Dauer von zwei Jahren verlor. Deshalb – so finde ich – sollte man Patienten die Wurmeier zugänglich machen, dabei allerdings sehr sorgfältig auf Transparenz und gründliche Aufklärung achten. Es ist nämlich nicht zu erwarten, dass T. suis-Eier jedem Menschen gleichermaßen helfen, da sich die genetisch bestimmten Reaktionen des Immunsystems individuell unterscheiden. Deshalb wird nicht jede Person in gleicher Weise auf die von Wurmlarven ausgesendeten Signale zur Immunsuppression ansprechen. Auch ist nicht von vornherein zu erwarten, dass sich das Immunsystem durch die Würmer dauerhaft umstimmen lässt, vielmehr könnte es sich um einen vorübergehenden Effekt handeln. Bei korrekter Aufklärung über diese Randbedingungen sollte man Patienten die Möglichkeit einer Selbstbehandlung mit T. suis-Eiern nicht vorenthalten.
Es stellt sich allerdings die Frage, ob eine Behandlung mit einem lebenden, aufwendig zu produzierenden Organismus in unserer Ära moderner Biotechnologie noch zeitgemäß ist. Mehrere Arbeitsgruppen haben in Mausmodellen molekular definierte Wirkstoffe aus parasitischen Nematoden identifiziert und in aufwendigen Experimenten deren Wirkmechanismen und Zielstrukturen im Immunsystem der Maus bestimmt [11, 12]. Dabei sind hoch potente Moleküle beschrieben worden, die der weiteren Entwicklung harren. Wenn es gelänge, mit solchen von Parasiten abgeschauten Wirkstoffen ganz spezifisch bestimmte unerwünschte Immunantworten zu supprimieren, könnte man damit vielleicht sogar elegantere Wege der Therapie von Allergien und Autoimmunerkrankungen erschließen. |
Literatur
[1] Lucius R, Loos-Frank B. Biologie von Parasiten. 2. Aufl. Springer-Verlag, Heidelberg 2008
[2] Langen U et al. Häufigkeit allergischer Erkrankungen in Deutschland. Bundesgesundheitsbl 2013;56:698-706
[3] Ehehalt S et al. Prediction model for the incidence and prevalence of type 1 diabetes in childhood and adolescence: evidence for a cohort-dependent increase within the next two decades in Germany. Pediatr Diabetes 2012;13:15-20
[4] Bergmann KC et al. Aktueller Stand zur Verbreitung von Allergien in Deutschland. Allergo J Int 2016;25:22-26
[5] Eaton EA et al. Epidemiology of autoimmune diseases in Denmark. J Autoimmun 2007;29:1-9
[6] van den Biggelaar AH et al. Decreased atopy in children infected with Schistosoma haematobium: a role for parasite-induced interleukin-10. Lancet 2000;356(9243):1723-1727
[7] Velasquez-Manoff M. An Epidemic of absence: A new way of understanding allergies and autoimmune diseases. Sribner, New York 2012
[8] Summers RW et al. Trichuris suis therapy for active ulcerative colitis: a randomized controlled trial. Gastroenterology 2005;128:825-32
[9] Summers RW et al. Trichuris suis therapy in Crohn‘s disease. Gut 2005;54:87-90
[10] Elliot DE et al. Nematodes and human therapeutic trials for inflammatory disease. Parasite Immunol 2017;39:e12407
[11] Ziegler T et al. A novel regulatory macrophage induced by a helminth molecule instructs IL-10 in CD4+ cells and protects against mucosal inflammation. J Immunol 2015;194:1555-1564
[12] Rzepecka J et al. Prophylactic and therapeutic treatment with a synthetic analogue of a parasitic worm product prevents experimental arthritis and inhibits IL-1β production via NRF2-mediated counter-regulation of the inflammasome. J Autoimmmun 2015;60:59-73























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.