
- DAZ.online
- DAZ / AZ
- DAZ 41/2017
- Das Kleine groß machen
Prisma
Das Kleine groß machen
Chemie-Nobelpreis 2017
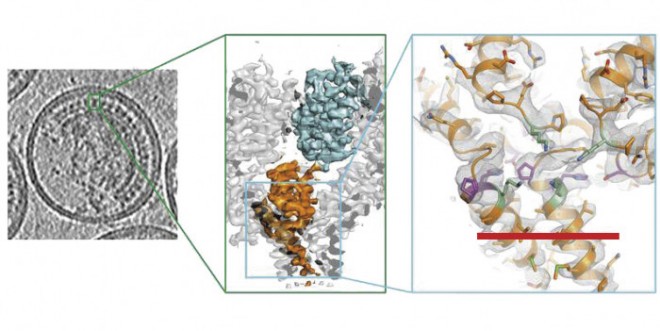
Kryo-Elektronenmikroskopie
Den Nobelpreis teilen sich der Schotte Richard Henderson, der Schweizer Jacques Dubochet und der Deutsch-Amerikaner Joachim Frank. Jeder von ihnen hat mit seinen Arbeitsgruppen einen Beitrag zur Kryo-Elektronenmikroskopie (Kryo-EM) geleistet, die sich neben der Röntgenkristallografie ganz allmählich einen bedeutenden und noch immer noch wichtiger werden Platz in der Strukturanalyse von großen Molekülen erobert hat.
Die Elektronenmikroskopie (EM) war früher nur zur wirklichkeitsgetreuen Abbildung von Biomolekülen geeignet, denn diese mussten zuvor getrocknet und aufwendig mit einer anorganischen Schutzschicht (z. B. Metallsalze) überzogen werden, damit sie im Vakuum und gegenüber der Röntgenbestrahlung stabil waren; damit veränderte sich ihre Struktur, die von der wässrigen Umgebung und von der Wechselwirkung mit anderen Biomolekülen mitbestimmt wird. Henderson hat im Jahr 1975 erstmals ein langes Transmembranprotein, nämlich das in einigen Archäen (keine Bakterien!) enthaltene Bacteriorhodopsin, mit der EM dreidimensional sichtbar gemacht, indem er es mithilfe einer Glucoselösung präparierte. Dabei betrug die erreichbare Auflösung 7 Angström (0,7 nm).
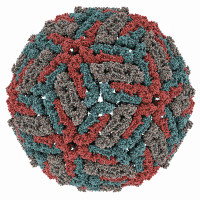
Um auf den Störfaktor Zuckerlösung wie auch die früheren Hilfsmittel verzichten zu können, entwickelte Dubochet, der damals am European Molecular Biology Laboratory in Heidelberg (EMBL) arbeitete, ein Kälteschock-Verfahren. Dabei wird das Lösungsmittel Wasser so schnell auf ca. -190 °C gefroren, dass es nicht kristallisiert, sondern amorph bleibt. Dieses schockgefrorene Wasser (kein Eis!) lenkt die hindurchgesendeten Elektronenstrahlen nicht ab. Mithilfe dieser Kryo-EM konnte Dubochet 1984 erstmals Viren, die eine Masse von ca. 10 bis 300 Millionen Dalton bei einem Durchmesser von 15 bis 440 nm aufweisen, abbilden.
Frank leistete seinen Beitrag zur Kryo-EM, indem er Computerprogramme zur Auswertung der durch die Elektronenstrahlen gewonnenen Daten schrieb und optimierte. Dabei berechnet der Computer aus den identischen, aber zufällig und ungeordnet in der Probe verteilten Biomolekülen zunächst verschiedene zweidimensionale Modelle, aus denen sich dann durch weitere Berechnungen ein einziges dreidimensionales Modell ergibt. Hier ist allerdings zu beachten, dass die erhaltenen Abbildungen immer nur Rekonstruktionen sind, deren Realitätstreue von dem Programm abhängt; je nach Intention kann eine grafische Gestaltung bestimmte Aspekte hervorheben. Das analytische Verfahren selbst ist bis heute im Prinzip gleich geblieben, doch wurde das Auflösevermögen immer mehr verbessert. Nach den Viren kamen die Ribosomen im Zellkern (ca. 2300 kDa und 3 Å) und darauf verschiedene multimere Enzyme, z. B. Dehydrogenasen, an die Reihe (ca. 100 – 300 kDa und 2 – 4 Å). Das kleinste mittels Kryo-EM dargestellte Molekül ist derzeit das Hämoglobin (64 kDa), doch theoretisch dürfte die Grenze dieser Technik bei etwa 20 kDa liegen. Die Struktur der Objekte kann sogar bis zu einzelnen Atomen (Ø 1 Å = 1 nm) aufgeklärt werden.
Späte Anerkennung
Die Preisträger wurden von 1940 bis 1945 geboren und sind mittlerweile im Ruhestand. Die Forschungen, für die sie nun ausgezeichnet werden, liegen bereits Jahrzehnte zurück, aber sie bilden das Fundament für einen immer wichtiger werdenden Wissenschaftszweig. Sie haben wesentlich dazu beigetragen, dass sich die Biochemie heute in einer „explosiven Entwicklung“ befindet, so die Begründung des Nobel-Komitees.
Der Chemie-Nobelpreis wird am 10. Dezember in Stockholm überreicht und ist mit insgesamt neun Millionen schwedischen Kronen dotiert (ca. 940.000 €). Über die Forschungen, die mit dem Medizin-Nobelpreis gewürdigt werden, informiert ein Beitrag auf Seite 37 dieser DAZ. |




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.