
- DAZ.online
- DAZ / AZ
- DAZ 41/2017
- Bakterium mag L-Dopa
Phytoforschung
Bakterium mag L-Dopa
Beeinflusst eine Helicobacter-pylori-Infektion die Parkinson-Therapie mit Levodopa?
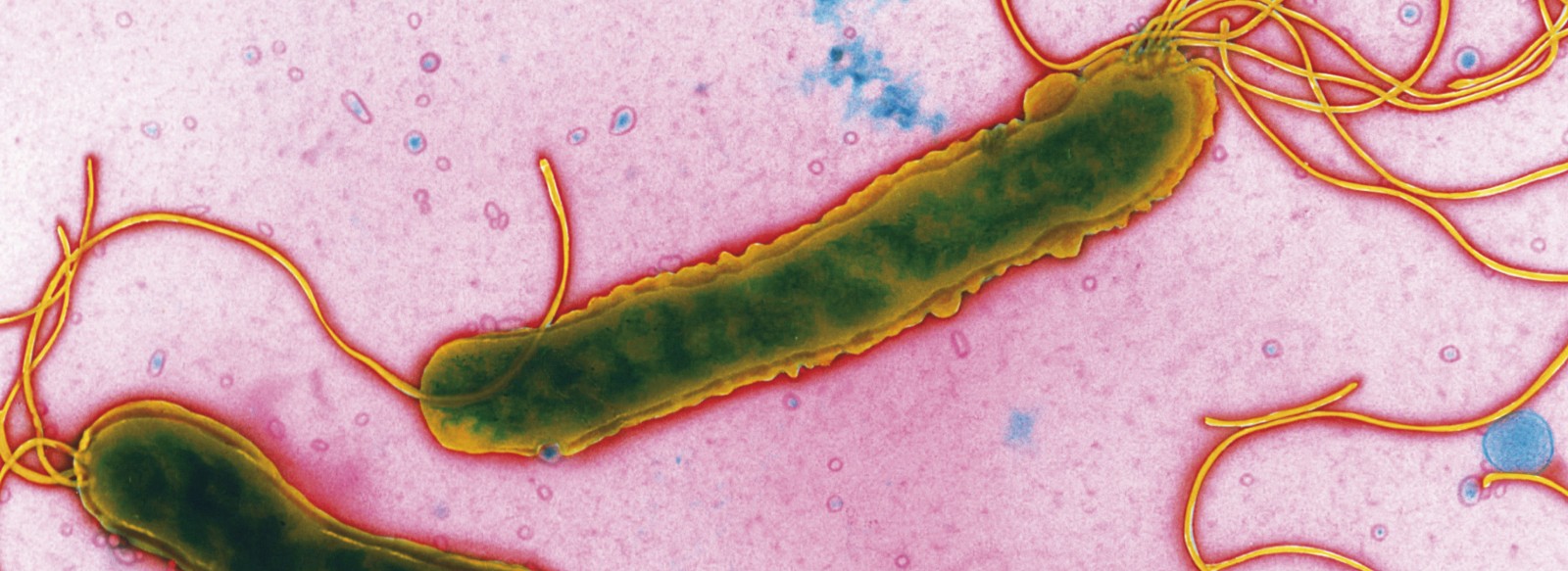
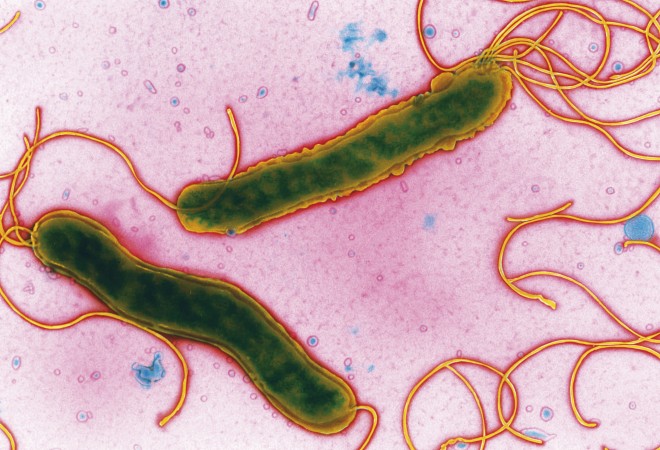
Früher ging man davon aus, dass das aggressive Milieu des menschlichen Magens zur Autosterilität dieses Organs führt. Erst 1983 veröffentlichten Warren und Marshall die Existenz eines spiralförmigen, mikroaerophilen, gramnegativen Bakteriums mit hoher Motilität im menschlichen Magen, welches später als Helicobacter pylori klassifiziert wurde [1]. Neue Daten belegen, dass etwa 50% der Weltbevölkerung mit H. pylori infiziert sind, wobei die Infektionsraten in westlichen Industrienationen mittlerweile rückläufig sind, in vielen Entwicklungsländern aber bis zu 100% betragen [2]. Die Übertragung des Bakteriums erfolgt in der Regel in den ersten fünf Lebensjahren, meist oral-oral, aber auch die fäkal-orale Transmission ist bekannt.
Mehr als 85% der Infizierten bilden keinerlei klinisch relevante Symptomatik aus, während bei den übrigen Personen zuerst eine chronische Gastritis diagnostiziert wird. Hieraus können sich Ulzera des Magens und des Duodenums entwickeln. Auch ein MALT-Lymphom (maligne Entartung des Mucosa-assoziierten-lymphoiden Gewebes, meistens aus B-Lymphozyten bestehend) kann die Folge sein. Aus diesem Grund hat die WHO 1994 H. pylori als Typ‑I-Karzinogen eingestuft [3]. Nach neueren Daten sind H. pylori-Infektionen für etwa 92% der diagnostizierten Magenkarzinome verantwortlich [4].
Ein Leben in der Mucinschicht
Entgegen der landläufigen Meinung befindet sich die Majorität des Bakteriums nicht im freien Bereich des Magens (dies würde implizieren, dass es relativ viel Energie aufbringen müsste, um durch Expression der bakteriellen Urease ein pH-neutrales Milieu um sich herum zu generieren), sondern in der das Magenepithel auskleidenden Mucinschicht; die dem Epithel aufliegenden Bereiche dieser Schleimschicht sind nahezu pH-neutral, die mehr luminal liegenden Bereiche haben niedrigere pH-Werte bis pH = 4. H. pylori kann recht gut in die Mucinschicht eindringen und sich darin auch gut bewegen; dies wird durch einen sehr spezialisierten Flagellenapparat des Bakteriums bewirkt, der es Propeller-ähnlich antreibt. Durch bestimmte Oberflächenproteine kann das Bakterium mit den spezifischen Glykoproteinen des Mucins in Kontakt treten und sich in dieser hochviskosen Schicht verankern, ohne in das freie Magenlumen ausgeschwemmt zu werden.
Virulenzfaktoren
Ein weiterer Teil der Bakterienpopulation kann direkt mit den Zellen des Magenepithels interagieren, indem sogenannte Adhäsine, also Proteine auf der Außenmembran des Bakteriums, hochspezifisch komplementäre Bindungsstrukturen auf der Epithelzelle erkennen und mit diesen in Wechselwirkung treten [5]. Damit dockt das Bakterium an die Epithelzelle an und ist somit physikalisch fest verankert. Diese Adhäsion ist ein ganz wichtiger Schritt zur Etablierung von persistierenden Infektionen. Nachfolgend können H. pylori-spezifische Virulenzfaktoren exprimiert werden, insbesondere das Vacuolating cytotoxin A (VacA) und das Cytotoxin-associated gene A (CagA) [5]. CagA wird über ein spezielles Sekretionssystem in die Wirtszelle transloziert und führt zu deutlich erkennbaren morphologischen Veränderungen, insbesondere zu ihrer Verlängerung; zudem schädigt CagA die Zelle biochemisch durch Interaktion mit intrazellulären Signalwegen. VacA ist ein Poren-bildendes Toxin, welches die Polarität der Epithelzelle stört und deren Apoptose auslöst, aber auch die Proliferation und Effektorfunktion von Immunzellen, speziell T-Lymphozyten, unterbindet. Damit wird ein Gewebeschaden im Epithel gesetzt, der immunologisch nicht oder nur schlecht abgewehrt werden kann. Eine chronische Gastritis ist die Folge dieser Infektion.
Eradikationstherapie
Die klassische Therapie einer H. pylori-Infektion besteht in der antibiotischen Eradikation des Bakteriums. Diese kann meist unproblematisch durchgeführt werden, aber es treten auch immer stärker werdende Resistenzen auf; zudem wird ein sehr hoher Prozentsatz an wiederaufflammenden Infektionen („Recurrance“) diagnostiziert.
Es ist aber auch darauf hinzuweisen, dass die Eradikation von H. pylori das Auftreten anderer Erkrankungen fördern kann; so sind kausale Zusammenhänge zwischen der Eradikation und dem Auftreten von Refluxösophagitis und ösophagealen Adenokarzinomen mittlerweile statistisch evident, was wiederum belegt, dass die H. pylori-Besiedlung des Magens auch protektive Eigenschaften für den Wirtsorganismus hat [6].
Adhäsine als Targets
Die Entwicklung von Wirkstoffen mit neuen Wirkprinzipien ist ein aktuelles Ziel wissenschaftlicher Untersuchungen im Kampf gegen die H. pylori-Infektion. Interessante Angriffspunkte (Targets) sind insbesondere die Adhäsine, die die Adhäsion des Bakteriums an die Wirtszelle vermitteln. Die Inhibition dieser Proteine erscheint als ein probates Mittel für die Intervention zu einem sehr frühen Zeitpunkt – noch vor der eigentlichen Infektion. Die klassische Antibiose hingegen greift im Prinzip immer nur, wenn eine Infektion schon stattgefunden hat.
Die Entwicklung von Inhibitoren der H. pylori-spezifischen Adhäsine ist nicht ganz einfach, da das Bakterium nicht ein singuläres Adhäsin exprimiert, sondern mehrere dieser Proteine auf seiner Außenseite organisiert (z. B. BabA, SabA, AlpA, AlpB, HopH und HopZ). Diese Vielzahl an Adhäsinen befähigt das Bakterium, an verschieden ausgestaltete Magenepithelzellen anzudocken, unabhängig von deren genetisch bedingter Variabilität und teilweise auch unabhängig von Abwehrstrategien des Immunsystems. Die bedeutsamsten Adhäsine, die auch bei der Entwicklung von antiadhäsiven Wirkstoffen als wichtigste Targets genutzt werden, sind BabA (blood-group antigen-binding adhesin) und SabA (sialic acid-binding adhesin). Beide erkennen hochspezifisch Kohlenhydratstrukturen der Blutgruppenantigene auf der Magenepithelzelle und in der Mucinschicht:
- BabA interagiert mit einer fucosylierten Blutgruppen-Zuckerstruktur, die als Lewisb bezeichnet wird, und ist das ganz dominante Adhäsin des Bakteriums.
- SabA erkennt die Kohlenhydrat-Epitope sialyl-Lewisaund sialyl-Lewisx, die durch die Anwesenheit von Sialinsäuren charakterisiert sind.
BabA wird überwiegend im Zuge der Erstbesiedlung des Wirtes exprimiert, während SabA überwiegend an Epithelzellen bindet, die nach einem fortgeschrittenen Entzündungsgeschehen schon stärker sialylierte Oberflächenstrukturen ausgebildet haben. Schon hieraus wird deutlich, wie fein und flexibel H. pylori in Bezug auf Erkennung und Adhäsion der Zielzellen justiert sein kann. Allerdings bieten solche Adhäsionsstrategien auch Möglichkeiten, dieselben durch sehr spezifische Wirkstoffe zu inhibieren.
Natürliche Hemmstoffe der Adhäsion
In den letzten Jahren wurden einige potente Adhäsionshemmer beschrieben, die überwiegend gegen BabA und/oder SabA gerichtet sind. Hierbei handelt es sich fast ausschließlich um Naturstoffe, und zwar meist um komplexe Kohlenhydrate (z. B. Sialyl-Lactose, Pectin-ähnliche Polysaccharide). So wurden Polysaccharide aus Süßholzwurzel (Glycyrrhiza glabra; Abb. 2) als antiadhäsiv beschrieben, was insofern interessant ist, als diese Droge traditionell immer schon zur Behandlung von Gastritis eingesetzt wurde [7]. Allerdings dürfte auch die antiinflammatorische Aktivität des Glycyrrhizins eine Rolle spielen.
Eine nahezu komplette Blockade von BabA und SabA wird durch acetylierte Rhamnogalacturonane aus unreifen Okraschoten, den Früchten von Abelmoschus esculentus (Malvaceae; Abb. 3), bewirkt; auch wässrige Extrakte der Droge wirken gegen H. pylori [8]. Interessanterweise werden unreife Okraschoten in Afrika und auf dem indischen Subkontinent traditionell bei Magenbeschwerden eingesetzt. Die sehr stark ausgeprägte Adhäsionshemmung durch die darin enthaltenen Schleime würde diese traditionelle Anwendung sehr gut erklären.
Bestimmte kurzkettige Peptide, wie sie z. B. aus Erbsenproteinhydrolysaten gewonnen werden können, inhibieren sehr spezifisch BabA [9]. Im Rahmen eines weiten Screenings wurden auch N-Phenylpropenoyl-aminosäureamide (NPAs, z. B. in Kakaosamen vorkommend) als sehr potente Inhibitoren beschrieben [10]. Inwieweit diese Befunde in eine vertiefte präklinische und klinische Entwicklung eingehen werden, bleibt abzuwarten; das diesbezügliche Interesse ist allerdings sehr groß.
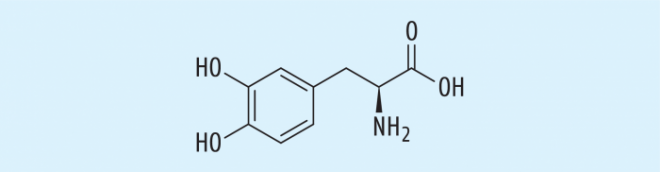
Interaktion mit L-Dopa
Obwohl ungewiss ist, ob diese Untersuchungen zu neuen Arzneimitteln führen werden, erscheint ein Zufallsbefund schon heute für die praktische Pharmazie und Medizin interessant. Im Rahmen der vertieften Untersuchung der o. g. NPAs, die strukturell gesehen Phenylpropan-Derivate darstellen, wurde auch das dihydroxylierte Phenylpropan L‑Dopa (syn. Levodopa, Abb. 4) untersucht. L-Dopa zeigt ebenfalls eine Inhibierung der Adhäsion von H. pylori, allerdings kann L-Dopa auch relativ stark an das Bakterium binden [10]. Der Versuchsaufbau, der dies belegte, war denkbar einfach: Einer Bakterienkultur wurde eine Lösung von L-Dopa mit definierter Konzentration zugegeben, und in vorgegebenen Zeitabständen wurde die L-Dopa-Konzentration im Medium bestimmt. Hierbei zeigten sich zeit- und dosisabhängige Verminderungen des Gehaltes an L-Dopa, woraus geschlussfolgert wurde, dass H. pylori diese Verbindung weitgehend irreversibel binden kann. Die Autoren dieser Studie stellten die Frage, inwieweit eine solche Interaktion ein Problem bei der Behandlung von H. pylori-infizierten Parkinson-Patienten mit L-Dopa sein könnte [11].
Beeinflussung der Resorption von L-Dopa
Diese schon 2009 veröffentlichte Studie fand anfangs nur geringe Beachtung, was sich aber seit 2013 dramatisch änderte. Im Rahmen einer kleinen klinischen Studie (n = 75) wurde signifikant gezeigt, dass H. pylori-infizierte Parkinson-Patienten unter L-Dopa-Therapie unter größeren Schwankungen der Parkinson-typischen Symptome litten als ein nicht-infiziertes Vergleichskollektiv [12]. Unter Rückgriff auf die ursprüngliche Untersuchung, nachdem das Bakterium L-Dopa bindet, vermuten nun auch diese Autoren, dass H. pylori für die Schwankungen in der Bioverfügbarkeit des Arzneistoffes verantwortlich sein könnte.
2014 hat eine polnische Arbeitsgruppe gezeigt, dass sich grundlegende pharmakokinetische Kennzahlen von L-Dopa und seiner Metaboliten in H. pylori-infizierten und nicht infizierten Parkinson-Patienten nicht signifikant ändern; allerdings waren die Patientenzahlen in dieser Studie relativ gering und die intraindividuellen Schwankungen recht hoch [13]. Dagegen konnte später in einem gut ausgewählten, großen Kollektiv gezeigt werden, dass die Eradikation des Bakteriums die Resorption von Levodopa erhöht, was auch mit einem verminderten Auftreten von motorischen Fluktuationen einherging [14]. Diese Fluktuationen sind durch den plötzlichen Wechsel von guter Beweglichkeit und Akinese gekennzeichnet (On-off-Phänomene); sie treten häufig nach längerer Behandlungsdauer mit L-Dopa auf, können aber auch Hinweise auf schwankende Bioverfügbarkeiten des Wirkstoffes nach oraler Gabe sein.
Neben der direkten Bindung des L-Dopa an das Bakterium werden mittlerweile noch andere Faktoren seitens H. pylori diskutiert, die die Wirksamkeit von L-Dopa reduzieren können, so z. B. die Zerstörung von Zellen im oberen Duodenum durch das zytotoxische Bakterium (dieser Darmbereich ist das wichtigste gastrointestinale Segment für die L-Dopa-Resorption). Auch Veränderungen des gastrischen pH-Werts durch H. pylori werden diskutiert, was wiederum Veränderungen der Löslichkeit von L-Dopa nach sich ziehen kann. Ferner wird mittlerweile berücksichtigt, dass bei Parkinson-Patienten meist eine Verringerung der Magenmotilität zu beobachten ist, wodurch die Kontaktzeit zwischen Bakterium und L-Dopa verlängert wird.
Im Prinzip wurde die Wechselwirkung von H. pylori mit L-Dopa auch in einer 2017 veröffentlichten klinischen Studie nochmals bestätigt [15], die gezeigt hat, dass die Eradikation des Bakteriums zu einer signifikant verbesserten Ansprechrate auf L-Dopa in Bezug auf die motorischen Symptome führte.
Fazit
Zusammenfassend lässt sich festhalten, dass es einen erwiesenen Zusammenhang zwischen H. pylori-Infektionen und effektiver L-Dopa-Therapie gibt. Dies sollte auch im Rahmen einer professionellen Parkinson-Therapie beachtet werden.
Dem besonderen Wechselspiel zwischen bakterieller Besiedlung und pharmakokinetischen/pharmakologischen Eigenschaften von Arzneimitteln wurde bisher definitiv zu wenig Aufmerksamkeit gewidmet. Es ist davon auszugehen, dass auch andere orale Arzneistoffe unter Umständen mit H. pylori interagieren können, sodass veränderte pharmakokinetische Profile resultieren könnten.
Wenn aber schon ein einzelnes Bakterium im Magen eine Standardarzneimitteltherapie derart beeinflussen kann, stellt sich auch die Frage, welchen Einfluss das hochkomplexe Mikrobiom im unteren Dünndarm und im Dickdarm auf Arzneimittel hat. Hierfür sind weiterführende Forschungen in nächster Zeit sicher einzuplanen. Vielleicht könnte dies auch die bei vielen Arzneimitteln in der klinischen Praxis beobachteten großen Streubreiten erklären helfen. |
Literatur
[1] Warren JR, Marshall BJ. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983;1:1273-1275
[2] Oleastro M, Ménard A. The role of Helicobacter pylori outer membrane proteins in adherence and pathogenesis. Biology 2013;2:1110-1134
[3] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Schistosomes, liver flukes and Helicobacter pylori. IARC Monogr Eval Carcinog Risks Hum 1994;61:1-241
[4] Gonzalez CA et al. Helicobacter pylori infection assessed by ELISA and by immunoblot and noncardia gastric cancer risk in a prospective study: the Eurgast-EPIC project. Ann Oncol 2012;23:1320-1324
[5] Salama NR, Hartung ML, Müller A. Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori. Nature Rev Microbiol 2013;11:385-399
[6] O‘Connor A, O‘Morain CA, Ford AC. Population screening and treatment of Helicobacter pylori infection. Nature Rev Gastroenterol Hepatol 2017:230-240
[7] Wittschier N, Faller G, Hensel A. Aqueous extracts and polysaccharides from liquorice roots (Glycyrrhiza glabra L.) inhibit adhesion of Helicobacter pylori to human gastric mucosa. J Ethnopharmacol 2009;125:218-223
[8] Messing J, Thöle C, Niehues M, Shevtsova A, Borén T, Hensel A. Antiadhesive properties from Abelmoschus esculentus (Okra) immature fruit extract against Helicobacter pylori adhesion. PLoS One 2014;9:e84836
[9] Niehues M, Euler M, Georgi G, Mank M, Stahl B, Hensel A. Peptides from Pisum sativum L. enzymatic protein digest with anti-adhesive activity against Helicobacter pylori: Structure-activity and inhibitory activity against BabA, SabA, HpaA and a fibronectin-binding adhesin. Mol Nutr Food Res 2010;54:1851-1861
[10] Niehues M, Stark T, Keller D, Hofmann T, Hensel A. Antiadhesion as a functional concept: antiadhesive N-phenylpropenoyl-L-amino acid amides as specific inhibitors of the Helicobacter pylori BabA outer membrane protein: structure-activity relationship and functional aspects. Mol Nutr Food Res 2011;55:1104-17
[11] Niehues M, Hensel A. In vitro interaction of L-dopa with bacterial adhesins of Helicobacter pylori: an explanation for clinicial differences in bioavailability? J Pharm Pharmacol 2009;61:1303-1307
[12] Rahne KE, Tagesson C, Nyholm D. Motor fluctuations and Helicobacter pylori in Parkinson‘s disease. J Neurol 2013;260:2974-2980
[13] Narożańska E et al. Pharmacokinetics of levodopa in patients with Parkinson disease and motor fluctuations depending on the presence of Helicobacter pylori infection. Clin Neuropharmacol 2014;37:96-99
[14] Çamcı G, Oğuz S. Association between Parkinson‘s Disease and Helicobacter pylori. J Clin Neurol 2016;12:147-150
[15] Liu H et al. Eradication of Helicobacter pylori infection might improve clinical status of patients with Parkinson‘s disease, especially on bradykinesia. Clin Neurol Neurosurg 2017;160:101-104























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.