
- DAZ.online
- DAZ / AZ
- DAZ 32/2017
- Chirurgie am humanen ...
Forschung
Chirurgie am humanen Embryo-Genom
Erfolgreicher Einsatz der CRISPR/Cas9-Technologie löst Euphorie und Skepsis aus
Man fühlte sich irgendwie erinnert an den bekannten Apple-Hype, wenn das Cupertino-Unternehmen zu einer seiner legendären Mammutveranstaltungen einlädt, auf der neue Hardware mit dem Logo eines angebissenen Apfels vorgestellt wird.
Ein Hauch von Apple
Bereits Mitte vorletzter Woche berichtete das Magazin „MIT Technology Review“ in seiner Ausgabe vom 26.7.2017 (https://www.technologyreview.com/s/608350/first-human-embryos-edited-in-us/), dass es einer Forschergruppe um Shoukhrat Mitalipov von der Oregon Health and Science University, in Portland, Oregon, gelungen sei, die DNA menschlicher Embryonen effektiv zu korrigieren. Mehr wurde nicht verraten. Bevor die wissenschaftliche Arbeit nicht von Nature publiziert worden sei, stünde man für Fragen nicht zu Verfügung, so die Meldung, die auf allen möglichen Wissenschaftskanälen zu lesen und zu hören war. Aber ähnlich, wie verschiedene Details von neueinzuführenden Apple-Geräten nach und nach, nicht selten völlig korrekt, durchsickern, wurde auch in diesem Fall spekuliert, dass Mitalipov und seinen Kollegen für zwei entscheidende Probleme beim Einsatz der CRIPSR/Cas9-Technologie an Embryonen ein Durchbruch gelungen war: Zum einen, eine bis dahin inakzeptabel hohe Rate von „Off-target”-Mutationen dramatisch zu reduzieren, und zum anderen, die Bildung von Mosaik-Organismen nahezu vollständig zu vermeiden.
Seit Mittwoch letzter Woche wissen wir nun Bescheid. Und ähnlich wie bei Apple-Produkten wurde auch in diesem Fall tatsächlich weitgehend korrekt spekuliert. Dennoch schaffte es ein wichtiges Detail der Arbeiten, bis zur Publikation geheim zu bleiben. Denn es war einfach nicht durchgesickert, worauf die Korrekturen zielten, die es den Wissenschaftlern wert waren, so weit an die Grenzen des ethisch Vertretbaren und rechtlich Tolerierten bei der Manipulation des menschlichen Programms während seiner Entstehung zu gehen.
Skandal oder seriöse Forschung?
Spätestens an dieser Stelle werden die meisten Leser dieses Textes sich bereits eine Meinung gebildet haben: Geht gar nicht! Oder?
Vielleicht ist das aber zu voreilig. Man sollte besser einen etwas tieferen Blick riskieren, um seriös meinungskompetent zu sein.
So seien ein paar wichtige Fakten vorausgeschickt:
- Es handelt sich hier um ein hochqualifiziertes Grundlagen-Forschungsprojekt. Von einem „Designer-Baby“ war nie die Rede. Zu keinem Zeitpunkt war daran gedacht, eine durch CRISPR/Cas9 korrigierte Blastozyste einer Leihmutter zur Austragung zu implantieren. Ausschließlich für Forschungszwecke wurden insgesamt 167 Eizellen verbraucht, die man Frauen nach hormoneller Stimulation entnommen hatte.
- Tatsächlich widmeten sich die Wissenschaftler einem signifikanten medizinischen Problem. Der Samenspender für diese Arbeiten litt an Familiärer hypertropher Kardiomyopathie (HCM), einer schweren Erkrankung des Herzmuskels, die autosomal dominant vererbt wird. Bei dieser Erkrankung kommt es zu einer Verdickung der Muskulatur des linken Ventrikels und in der Folge zu einer diastolischen Dysfunktion und einer Verminderung der Ejektionsfraktion. Vor allem Kinder sind hochgradig gefährdet, an einem plötzlichen Herztod zu versterben.
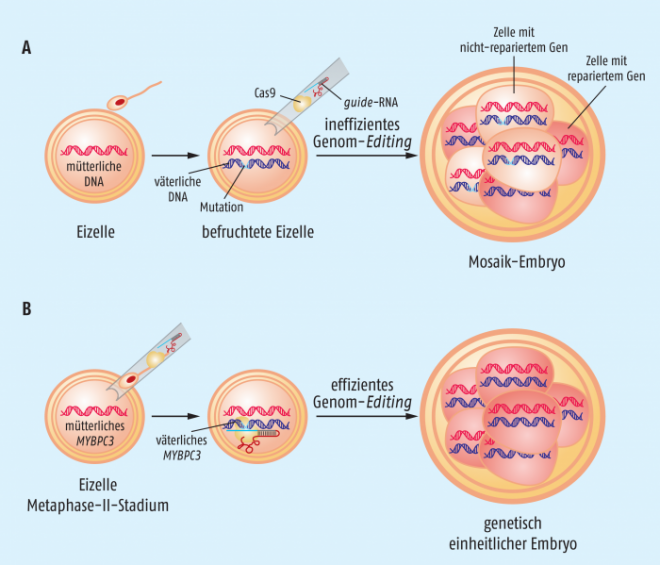
- Die Fragestellungen der Wissenschaftler basierten auf konkreten Hypothesen. Drei Studien chinesischer Arbeitsgruppen hatten sich bereits mit der Anwendung der CRISPR/Cas9-Technologie an menschlichen Embryonen befasst und dabei sehr enttäuschende Ergebnisse erzielt. Eines der Probleme war eine nicht akzeptable Anzahl von „Off-target“-Effekten, d. h. das CRISPR/Cas9-System korrigierte nicht nur die ausgewählte Mutation, sondern modifizierte auch unkontrolliert viele andere Positionen im Genom des Embryos. Ein anderes Problem war die Bildung von „Mosaik-Organismen“. Darunter versteht man, dass nicht alle Zellen eines Embryos die gewünschte Modifikation tragen, sondern korrigierte und nicht korrigierte Zellen nebeneinander existieren, wobei die Konsequenzen unvorhersehbar sind.
- Dass sie am Rande des ethisch Vertretbaren und rechtlich Tolerierten forschten, war den Wissenschaftlern nur zu bewusst. Denn in den USA ist es nicht erlaubt, öffentliche Fördermittel für die Forschung mit humanen Embryonen einzusetzen. Daher wurden die Kosten für dieses Projekt privat getragen.
Die Lösung der Probleme
Das Prinzip der CRISPR/Cas9-Technologie ist im nebenstehenden Kasten beschrieben.
Die Leistung der Gruppe um Shoukhrat Mitalipov besteht darin, dieses potente Werkzeug hoch intelligent eingesetzt zu haben. So ist es nicht auszuschließen, dass durch diese Arbeit die Option, gefährliche Mutationen und deren Konsequenzen bereits im Stadium der Befruchtung zu korrigieren, wesentlich realistischer geworden ist.
Der experimentelle Durchbruch der Wissenschaftler basiert wahrscheinlich auf folgendem rationalen Konzept:
Eizellen gesunder Spenderinnen wurden mit dem Samen eines Trägers einer bestimmten Mutation im sogenannten MYBPC3-Gen befruchtet. Diese Mutation ist ursächlich für die dominant vererbbare HCM verantwortlich, so dass bei einer normalen Zeugung zu 50% mit einem kranken Kind gerechnet werden muss.
Zur In-vitro-Fertilisation wurde jeweils ein Spermium zusammen mit dem Cas9-Enzym, einer guide-RNA, die das Enzym exakt an die Mutation lenkt, und einer einzelsträngigen kurzen DNA, die die intakte Erbinformation für das MYBPC3-Gen trägt, in eine Eizelle injiziert, die sich in der Metaphase II befindet, in der alle Eizellen vor einer Befruchtung arretiert sind. Diese Art der künstlichen Befruchtung wird auch als intrazytoplasmatische Spermieninjektion (ICSI) bezeichnet und ist eine durchaus gängige Methode im Rahmen einer assistierten In-vitro-Fertilisation.
Der Ansatz scheint zwei entscheidende Vorteile zu haben:
- Durch die gleichzeitige Induktion des Korrekturprozesses mit der Fertilisation findet der Korrekturprozess zu einem Zeitpunkt statt, zu dem zweifelsfrei nur eine einzige mutierte Genomkopie in der Eizelle vorliegt.
- Zum anderen vergeht bis zur ersten DNA-Replikation so viel Zeit, dass das labile Cas9-Enzym bereits abgebaut ist, bevor durch die Replikation die Anzahl der Mutanten-Allele schnell wächst. Dies reduziert die Wahrscheinlichkeit für „Off-target“-Aktivitäten des Cas9-Enzyms, und gleichzeitig ist der Korrekturvorgang abgeschlossen, bevor die erste Zellteilung einsetzt, so dass – falls alles optimal läuft – keine Chance für die Bildung von Mosaik-Organismen besteht.
Nebenbei bemerkt wurde hier genau genommen auch nicht an Embryonen manipuliert. Streng genommen handelt es sich um eine klassische In-vitro-Fertilisation, der ein paar interessante Komponenten zugemischt wurden.
Genom-Manipulationen mit CRISPR/Cas9
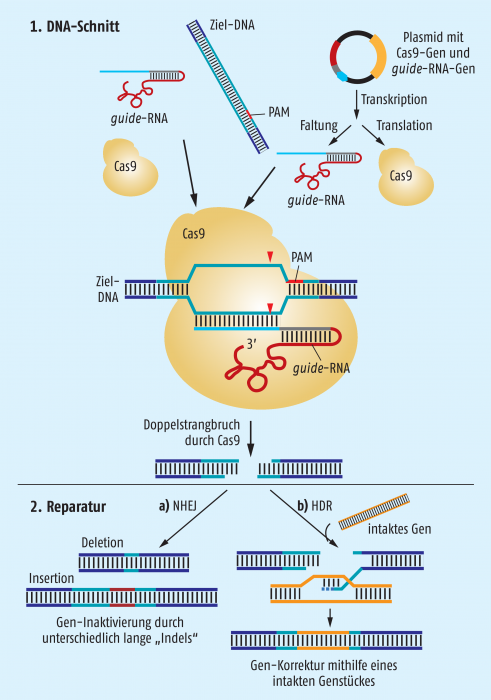
Vor genau 10 Jahren wurde das CRISPR/Cas9-System als eine Art adaptives Immunsystem der Bakterien beschrieben. Mittlerweile wurden daraus Methoden entwickelt, um mit geringem Aufwand zielgenau Genome zu verändern. Das Grundprinzip besteht aus zwei Schritten (Abb. 2): 1. Schneiden der DNA innerhalb einer Zielsequenz und 2. Reparatur des entstandenen DNA-Schadens.
1. Für das Schneiden der DNA reichen das Protein Cas9 und eine sogenannte guide-RNA. Die guide-RNA bindet Cas9 und dirigiert das Enzym an eine komplementäre Sequenz von ca. 20 Nukleotiden im Genom der Zelle, die manipuliert werden soll. Wichtig ist, dass unmittelbar benachbart zur Zielsequenz im Genom ein sogenanntes protospacer-adjacent motif (PAM) vorkommt, das normalerweise aus der Nukleotidfolge 5’-NGG-3’ besteht, wobei N ein beliebiges Nukleotid sein kann. Mittlerweile gibt es verschiedene Online-Tools, die Genome nach PAMs absuchen können und beim Erstellen einer geeigneten guide-RNA-Sequenz für jedes beliebige genomische Ziel behilflich sind.
Sobald sich der Komplex aus guide-RNA, Ziel-DNA und Cas9 gebildet hat, schneidet das Protein beide Stränge der DNA.
In der praktischen Umsetzung kann entweder Cas9 und guide-RNA als fertige Moleküle (Abb. 2, links oben) oder aber in Form ihrer genetischen Information über ein Plasmid in die Zelle eingebracht werden (Abb. 2, rechts oben). Im ersten Fall können guide-RNA und Cas9 „direkt loslegen“ und das Genom sofort schneiden, werden aber nach kurzer Zeit in der Zelle abgebaut. Im zweiten Fall muss die Zelle zunächst selbst das Enzym und die guide-RNA synthetisieren, bevor die Ziel-DNA geschnitten werden kann. Es kommt also zu einer leichten Verzögerung, dafür wird aber über einige Zeit immer wieder neue guide-RNA und Enzym produziert.
2. Der entstandene DNA-Schnitt muss in der Zelle möglichst umgehend repariert werden, wofür natürlicherweise immer geeignete Enzyme zur Verfügung stehen. Zwei verschiedene Wege können dabei eingeschlagen werden: a) die einfache Verknüpfung der entstandenen DNA-Enden, was auch als nonhomologous end-joining (NHEJ) bezeichnet wird und b) die Reparatur durch homologe Rekombination (homology-directed repair, HDR). Bei der wesentlich häufigeren, einfachen Verknüpfung NHEJ entstehen allerdings in der Regel Fehler durch Einbau bzw. Abbau einzelner Nukleotide an den DNA-Enden, wodurch die Information der Ziel-DNA üblicherweise zerstört wird. Diese Fehler durch kleine Insertionen und Deletionen werden im Fachjargon zum Begriff Indels zusammengefasst und werden immer dann toleriert, wenn man die Funktion eines Gens studieren will, indem man es inaktiviert.
Sehr viel aufwendiger und deshalb auch wesentlich seltener ist die Reparatur über homologe Rekombination HDR. Für diese Reparatur muss eine intakte Kopie der Zielsequenz vorhanden sein, damit die beteiligten Enzyme die entstandenen DNA-Enden anhand der Vorlage verbinden und – falls nötig – fehlende Nukleotide korrekt einbauen können. Im Versuchsansatz wird meist zusätzlich zu Cas9 und der guide-RNA eine entsprechende DNA-Vorlage mit dazu gegeben, um die Wahrscheinlichkeit für eine HDR zu erhöhen.
Auch Rationalität schließt Überraschungen nicht aus
Trotz der beeindruckenden Rationalität, mit der die Wissenschaftler ganz klar definierte Probleme angesprochen und gelöst haben, blieb zumindest eine Überraschung nicht aus.
Wie im Kastentext erläutert wird, dient das CRISPR/Cas9-System zunächst lediglich dazu, an einer ganz bestimmten Stelle die doppelsträngige DNA aufzuschneiden. Danach setzen zelluläre Prozesse ein, in deren Verlauf mithilfe der mitinjizierten Korrektur-DNA der ursprüngliche Fehler repariert wird.
Dieser Korrekturprozess lief bei den hier beschriebenen Experimenten offensichtlich anders ab. Zur Überraschung der Wissenschaftler diente nicht die Korrektur-DNA als Matrize für die Reparatur der aufgeschnittenen DNA, sondern das intakte Allel der weiblichen Spenderin. Was dies in letzter Konsequenz bedeutet, können die Autoren momentan nicht sagen. Dieses Rätsel muss durch weitere Arbeiten gelöst werden.
Die Bilanz
Insgesamt dokumentieren die Wissenschaftler um Shoukhrat Mitalipov erstaunliche Resultate. 58 Eizellen wurden durch eine modifizierte intrazytoplasmatische Injektion mit Spermien befruchtet, die ein mutiertes MYBPC3-Gen trugen. Daraus resultierten 42 Embryonen, die homozygot zwei normale Kopien des MYBPC3-Gens trugen. Nur ein Embryo hatte eine Mosaik-Konstellation. Dabei erwies es sich als vorteilhaft, dass die Korrektur durch CRISPR/Cas9 mit der Befruchtung initiiert wurde. Injizierten die Wissenschaftler das CRISPR/Cas9-System 18 Stunden nach der Befruchtung, resultierten 13 von 54 behandelten Embryonen in einer Mosaik-Konstellation.
Die Diskussion geht weiter, und das ist auch notwendig und gut. Dass bei aller Seriosität der hier vorgestellten Forschung auch wieder Designer-Phantasien Wellen schlagen, ist wohl ein nicht vermeidbarer Kollateraleffekt. Den Kollateralschaden gilt es zu verhindern, ohne reflexartig jegliche seriöse Forschung mit CRISPR/Cas9 auch an der Keimbahn zu blockieren. Denn es gibt viele verzweifelte Menschen, die dringend auf Lösungen in dieser Richtung warten.
Und dennoch: Es gibt auch eine seriös kritische Seite an dieser Forschung, die nicht unerwähnt bleiben sollte. Denn man kann tatsächlich kritisch fragen, ob in dieser Konstellation eine Genomkorrektur, wie sie hier sehr erfolgreich gelang, überhaupt erforderlich wäre. Diese Zweifel kommen auf, da der hier gewählte Ansatz zwingend eine In-vitro-Fertilisation und eine anschließende umfassende pränatale Diagnostik (PID) erfordert. Es ist dieser letzte Punkt, der die Zweifel begründet. Denn statistisch ist bei der Fertilisation einer Oozyte einer gesunden Mutter mit den Spermien eines Trägers eines fehlerhaften MYBPC3-Gens mit einer 50%igen Wahrscheinlichkeit mit einem gesunden Embryo zu rechnen. Wenn also eine PID erforderlich ist, würde man unter den gezeugten Embryonen sehr schnell einen gesunden Embryo finden.
Keine Frage also: Die Publikation muss und wird kritisch diskutiert werden. |
Literatur:
Ma, H., Marti-Gutierrez, N., Park, S.-W., et al.: Correction of a pathogenic gene mutation in human embryos. Nature (2017), doi:10.1038/nature23305
Winblad, N., Lanner, F.: At the heart of gene edits in human embryos. Nature (2017), doi:10.1038/nature23533
Ledford, H.: CRISPR fixes embryo error. Nature 548(2017),13-14























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.