
- DAZ.online
- DAZ / AZ
- DAZ 25/2017
- Nützlich und gefährlich
Toxikologie
Nützlich und gefährlich
Asbest-assoziierte Erkrankungen nehmen noch immer zu
Asbest (griech. asbestos, „unvergänglich“) ist eine Sammelbezeichnung für eine Gruppe von natürlichen, silikatischen Mineralien, die eine feinfaserige Struktur und eine besondere Thermostabilität aufweisen, weswegen sie schon 1820 Bestandteile in feuerfester Feuerwehr-Kleidung waren. Sie umfasst bekannte Asbest-Arten wie Chrysotil (Weiß-Asbest), und Amphibol-Asbeste, zu denen Krokydolith (Blau-Asbest), Amosit (Braun-Asbest) und Tremolit zählen. Der Siegeszug des Asbests im 20. Jahrhundert begann mit der Entdeckung seiner besonderen Eigenschaften. Asbeste sind zugfest, biegsam, elastischer als Stahldraht sowie sehr beständig. Zudem sind sie nicht brennbar, bis 1000 °C hitzebeständig und gegenüber den meisten Säuren und Laugen inert. Je nach Art sind sie bis in feinste Fasern zerteilbar. Aufgrund dieser Eigenschaften sowie der hohen mechanischen Beanspruchbarkeit wurde Asbest ab 1900 in Form von Eternit als Faserzement verwendet. Ab Mitte der 30er-Jahre wurde der Einsatz von Asbest mit der Ausbreitung neuer Technologien breitflächiger und fand zwischen 1960 und 1970 seinen Höhepunkt mit der Verarbeitung von mehr als 200.000 Tonnen Asbest pro Jahr zur Herstellung von Filtern, Säcken, Elektroinstallationen sowie Bremsbelägen, Dichtungen und Baustoffen wie Spachtelmassen, Fliesenkleber, Anstrichen und Fensterkitt. Über 90% der verwendeten Asbest-Menge bestand aus Chrysotil. Als Spritz-Asbest wurde es unter anderem zur Dämmung von Rohrleitungen oder zum Brandschutz von Stahlträgern angebracht. Auch Dach- und Fußbodenbeläge, Blumenkästen, Untersetzer sowie Bauteile von Haushaltsgegenständen (beispielsweise von Toastern, Kaffeemaschinen, Haartrockenhauben, Föhnen sowie Staubsaugern) bestanden aus Asbest. Sogar in Zahnpasta waren die Silikat-Mineralien enthalten. Nicht ohne Grund wurde es als „Mineral der 1000 Möglichkeiten“ bezeichnet. Jedoch zeigten sich mit dem jahrzehntelangen, großflächigen Einsatz auch allmählich die Gefahren für die menschliche Gesundheit, die vom Asbest ausgehen.
Erste Assoziationen zwischen hoher Asbest-Exposition und einem gehäuften Auftreten von Pleuramesotheliomen wurde 1960 bei Asbest-Arbeitern beschrieben [11]. Im Jahr 1970 nahm die Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe der Deutschen Forschungsgemeinschaft (DFG) Asbest erstmalig in die Gruppe krebserzeugender Arbeitsstoffe auf [20]. Weitere 20 Jahre vergingen, bis es zum Verbot der Produktion und Verwendung von Asbest in Deutschland kam, da die Kausalität zwischen Asbest und dem Auftreten von Lungen- und Pleuratumoren über lange Zeit angezweifelt wurde.
Krank durch Asbest – nicht nur die Dosis macht’s
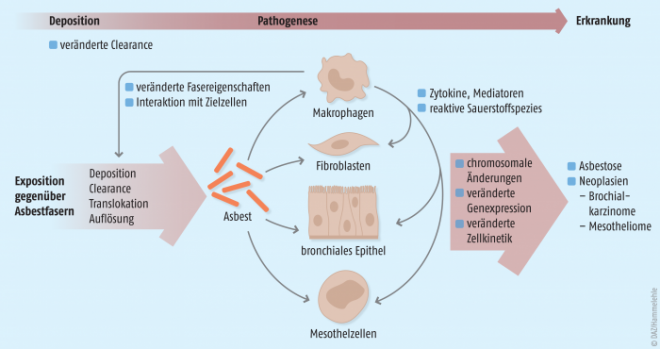
Das Gesundheitsrisiko von Asbest liegt in seiner besonderen Faserstruktur begründet. Durch mechanische oder chemische Beanspruchung des Minerals, z. B. Bearbeitung, Verschleiß oder Verwitterung, entstehen unzählige nadelähnliche Fasern, die leicht eingeatmet werden können. Gelangt Asbest tief in die Lunge, können über unterschiedliche Mechanismen Erkrankungen wie Asbestose, Bronchialkarzinome oder Mesotheliome induziert werden (Abb. 1).
Schlüsselfaktoren für die Pathogenität von Asbest sind die drei sogenannten „Ds“: Dosis, Dauerhaftigkeit (Biopersistenz) sowie Dimensionen (Länge und Durchmesser) der Fasern. Unter der Dosis wird die Menge der eingeatmeten Fasern, die die Zielzellen erreichen, verstanden. Wie bei allen pharmakologischen bzw. toxikologischen Wirkungen ist auch hier eine gewisse Dosis notwendig, um pathologische Veränderungen der Lunge zu verursachen. Wo diese Grenzschwelle liegt, lässt sich nicht vorhersagen, da die Empfindlichkeit gegenüber Asbest-Staub beim Menschen individuell unterschiedlich ist. Nicht jeder Mensch mit Asbest-Fasern in der Lunge erkrankt, trotzdem kann bereits ein vergleichsweise geringer bzw. kurzzeitiger Kontakt mit Asbest die Bildung von Tumoren initiieren.
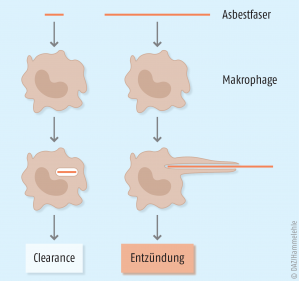
Die Menge des Asbest-Staubes, die in den Bereich der tiefen Atemwege gelangt, wird vor allem von der Dimension der Fasern beeinflusst. Sehr große Asbest-Partikel werden in den oberen Atemwegen zurückgehalten. Auch über die mukoziliäre Clearance, einer der Selbstreinigungsmechanismen der Lunge, werden Teile des Asbest-Staubes entfernt. Asbest-Fasern von kritischer Größe jedoch, das heißt mit einer Länge von mehr als 5 µm, einem Durchmesser von weniger als 3 µm und einem Länge-zu-Durchmesser-Verhältnis von mindestens 3:1, dringen bis zu den Alveolen vor und sind im besonderen Maße pathogen. Diese lungengängigen Fasern, die auch als „WHO-Fasern“ bezeichnet werden, können nur schwer aus der Lunge entfernt werden, wodurch das Organ zu einer „Faserfalle“ wird. Kurze Asbest-Fasern können noch durch Makrophagen aufgenommen und aufgelöst werden. Kritische Fasern mit einer Länge > 10 µm werden dagegen nicht mehr vollständig phagozytiert, da ihre Länge die Größe der Makrophagen überragt. Dies führt zur sogenannten „frustrierten Phagozytose“ (Abb. 2). Chemotaktische und fibrogene Mediatoren werden ausgeschüttet sowie reaktive Sauer- und Stickstoffverbindungen freigesetzt, was letztendlich zu einer Entzündung des Lungengewebes führt [1].
Erschwerend kommt hinzu, dass Asbest ein sehr beständiges und inertes Mineral ist. Trotz der physikalisch-chemischen und physiologischen Abbau-Prozesse in der Lunge können die Fasern dank ihrer hohen Biopersistenz nur langsam aufgelöst werden. Allerdings unterscheiden sich die Asbest-Arten in ihrer Biopersistenz. Es zeigte sich, dass Amphibol-Fasern im Lungengewebe wesentlich beständiger sind als Chrysotilfasern [2]. Da Chrysotil jedoch oft mit Tremolit-Asbest verunreinigt ist, bestehen oft Mischexpositionen gegenüber Amphibol-Asbest und Chrysotil.
Tödliche Langzeitfolgen
Typisch für alle Asbest-bedingten Erkrankungen ist ihre lange Latenzzeit. Von der Exposition mit Asbest-Staub bis zur Entwicklung einer Asbestose oder Bildung eines Tumors können mitunter mehrere Jahrzehnte vergehen. Grund sind die faserbedingten Mechanismen, die zur Erkrankung führen. Persistieren die Asbest-Fasern in der Lunge, können sie eine chronische Entzündung des Lungengewebes verursachen. Dadurch werden Fibrozyten aktiviert, die zur Bildung von Kollagen Typ III stimuliert werden. Es kommt zu einer langsam fortschreitenden Vernarbung des Lungengewebes. Diese chronische Bindegewebsvermehrung bzw. Fibrose der Lunge wird auch als Asbestose bezeichnet. Sie entsteht erst nach langanhaltenden, hohen Expositionen gegenüber Asbest-Staub z. B. durch eine berufliche Belastung. Die Asbestose ist nicht heilbar und zu Beginn meist symptomlos. Im Verlauf der Erkrankung können jedoch Reizhusten, Auswurf, Kurzatmigkeit und Atemnot auftreten, da durch die Bindegewebsvermehrung allmählich der Gasaustausch der Alveolen erschwert wird und es zu einer verminderten Sauerstoffsättigung des Blutes kommt.
Meist gehen mit der Asbestose auch pathologische Veränderungen der Pleura einher, die häufig sogar früher als die eigentliche Fibrose auftreten. Sie zeigen sich als hyaline oder verkalkte Pleuraplaques oder diffuse Bindegewebsneubildungen. Sie entstehen, wenn die Asbest-Fasern Richtung Pleura driften, wodurch auch Pleuraergüsse möglich sind. In einigen Fällen treten zusätzlich sogenannte Asbest-Körperchen auf. Sie bestehen aus Asbest-Fasern, die von einer eisenhaltigen Eiweißhülle umgeben sind. Diese bildet sich aus abgestorbenen Makrophagen, die an den zu langen Asbest-Fasern zugrunde gegangen sind.
Asbestose
- durch berufliche Exposition
- bereits um 1900 erstmalig diagnostiziert, ab 1936 als Berufskrankheit anerkannt
- erhöhtes Lungenkrebsrisiko – bei Veränderungen der Pleura auch erhöhtes Mesotheliomrisiko
- Latenzzeit: durchschnittlich 30 Jahre
Neben der Asbestose können die persistierenden Asbest-Fasern auch die Bildung von Tumoren induzieren. Insbesondere Bronchialkarzinome sowie Mesotheliome des Brust- und Bauchfells (Pleura- und Peritonealmesotheliom) gelten aufgrund von umfangreichen epidemiologischen Studien und anderer Evidenzen hinsichtlich des Kausalzusammenhangs als gesicherte Folgen einer Asbest-Exposition. Auch Kehlkopfkrebs (Larynxkarzinom), Eierstockkrebs und Tumore am Herzbeutel (Perikard-Tumore) wurden im Zusammenhang mit Asbest beobachtet [2].
Entscheidend für die Tumorentstehung sind Asbest-Fasern von kritischer Größe, wie bereits erläutert wurde. Sie weisen im Vergleich zu Fasern mit anderen Ausmaßen ein besonders hohes kanzerogenes Potenzial auf. Gleichwohl ist die Menge der kritischen Fasern ebenfalls ausschlaggebend. Auch wenn in der Theorie bereits eine Faser für die Induktion eines Tumors ausreicht, so existiert dennoch eine Dosisabhängigkeit zwischen Asbest und Asbest-assoziierten Lungenerkrankungen. Auffällig ist dabei, dass beim Bronchialkarzinom und Mesotheliom bereits Expositionen im Niedrigdosisbereich zur Induktion tumoröser Erkrankungen ausreichen [3].
Asbest-bedingtes Bronchialkarzinom
- Zusammenhang erstmalig um 1945 entdeckt
- ab 1977 als Berufskrankheit anerkannt
- Voraussetzung für Anerkennung:
gleichzeitig röntgenologisch diagnostizierte Asbestose oder histologisch nachgewiesene Minimalasbestose oder vorausgegangene Exposition von 25 Faserjahren
- Latenzzeit: durchschnittlich 40 Jahre
Als Ursache für die Entstehung von Asbest-bedingten Tumoren werden unterschiedliche molekulare Mechanismen angesehen, die auf einer Vielzahl von In-vitro-Studien basieren und tierexperimentell bestätigt werden konnten [1, 4, 5]. Zum einen wird durch die Bildung freier Radikale, die durch die entzündlichen Prozesse in der Lunge freigesetzt werden, die DNA des Lungengewebes bzw. der Pleura geschädigt. Dies kann Mutationen hervorrufen, die zur Bildung von Tumoren führt. Des Weiteren interagieren die Asbest-Fasern mit der Zellteilung, aktivieren Signalkaskaden und regen die Proliferation an, wodurch das Tumorwachstum unterstützt wird. Auch können Fasern auf ihrer Oberfläche andere kanzerogene Substanzen z. B. aus Zigarettenrauch transportieren und wirken somit als Ko-Kanzerogen. Mehrere Studien zeigen einen ausgeprägten synergistischen Effekt zwischen der Belastung mit Asbest-Staub und dem Zigarettenkonsum [6 – 9].
Auf dem Höhepunkt der Mesotheliom-Epidemie
Das Mesotheliom ist im Gegensatz zum Bronchialkarzinom eine sehr seltene Krebserkrankung. Im Durchschnitt treten in der Normalbevölkerung ein bis zwei Fälle pro einer Million Einwohner auf. Kommt es zu einer – meist beruflichen – Asbest-Belastung, erhöhen sich die Erkrankungsfälle um mehr als das 40-Fache [10]. Wegen der sehr niedrigen Spontaninzidenz konnte die kanzerogene Wirkung des Asbestes bereits 1960 in relativ kleinen epidemiologischen Studien bei Asbest-Arbeitern entdeckt werden [11]. Heute stehen zahlreiche, umfangreiche epidemiologische Studien zur Verfügung, die diese Assoziation bestätigen [2, 12]. Dagegen sind die epidemiologischen Nachweismöglichkeiten beim Bronchialkarzinom generell schwieriger, da Lungenkrebs zu den häufigsten Krebsarten in der Bevölkerung zählt. Eine statistische Absicherung wird zudem wegen der langen Latenzzeit erschwert. Auch bei der Entstehung eines Mesothelioms besteht meist eine sehr lange Zeit zwischen Exposition und Erkrankung. Im Durchschnitt liegen 40 Jahre zwischen der Asbest-Exposition, die vergleichsweise gering und kurzzeitig sein kann, und dem Auftreten erster Symptome. Das mittlere Erkrankungsalter beträgt dabei 74 Jahre. Problematisch ist zudem, dass die klinischen Symptome in der Regel unspezifisch sind. Meist treten diffuse Atembeschwerden wie Dyspnoe auf und werden seltener von Schmerzen aufgrund von Pleuraergüssen begleitet. Nach einem verdächtigen Röntgenbefund kann in der Regel eine bioptische oder zytologische Diagnosesicherung erfolgen. Seit mehreren Jahren werden in Deutschland mehr als 1500 Neuerkrankungen per anno verzeichnet [13]. Dabei liegt die tatsächliche Erkrankungsrate vermutlich um einige hundert Fälle höher, da eine zweifelsfreie Diagnose nicht immer gestellt wird. Eine Abnahme der Erkrankungsrate ist anhand der aktuellen Daten in den nächsten Jahren nicht zu erwarten. Die Mesotheliom-Epidemie wird in Deutschland erst zum Ende dieses Jahrzehnts ihren Höhepunkt erreichen. Mit einer Zunahme der Neuerkrankungen ist also in den kommenden Jahren noch zu rechnen (s. Tab. 1) [14, 19].
Land |
Inzidenz bei Peak(Erkrankungen pro 1 Million) |
Peak(Jahr / Zeitraum) |
erwartete Todesfälle(im Jahr des Maximums) |
|---|---|---|---|
Australien |
40 |
2010 |
1000 |
Großbritannien |
38 |
2016 |
2040 |
Deutschland |
20 |
2015 bis 2020 |
1600 |
Frankreich |
20 |
2020 bis 2040 |
1300 |
USA |
15 |
2010 |
2800 |
Japan |
15 |
2025 bis 2033 |
1200 |
Spanien |
11 |
2016 |
520 |
Niederlande |
10 |
2028 |
900 |
Die Prognose der Mesotheliom-Erkrankung ist denkbar schlecht. Eine Heilung ist nicht möglich. Das Therapieziel sind lebensverlängernde Maßnahmen sowie eine Verbesserung der Lebensqualität. Nach der Diagnose stirbt die Hälfte aller Betroffenen innerhalb eines Jahres an den Folgen der Krankheit. Die Fünf-Jahres-Überlebensrate liegt in Deutschland unter 10%. Insgesamt sterben jährlich mehr als 1300 Menschen allein am Mesotheliom [13]. Große Hoffnung wird in die Identifizierung von Biomarkern aus dem Blutserum gesetzt, um eine bessere Früherkennung und Prognose für den Betroffenen zu ermöglichen. Insbesondere das membranständige Glykoprotein Mesothelin, das von Tumoren wie dem Mesotheliom überexprimiert wird, wurde von der amerikanischen Aufsichtsbehörde FDA (Food and Drug Administration) für den klinischen Einsatz anerkannt und gilt aufgrund seiner hohen Genauigkeit als vielversprechender Biomarker in der Mesotheliom-Früherkennung [15].
Mesotheliom
- charakteristischer Asbest-induzierter Tumor
- ab 1977 als Berufskrankheit anerkannt
- häufigstes beruflich verursachtes Karzinom
- häufigste Form ist das Pleuramesotheliom
- Initialsymptom: persistierende oder rezidivierende Pleuraergüsse
- in 50% der Fälle verkalkte Pleurablätter
- ungünstige Prognose
- Latenzzeit: durchschnittlich 40 Jahre
Anerkennung als Berufskrankheit
Mehr als 90% der Mesotheliom-Erkrankungen können auf eine frühere, meist berufliche Asbest-Belastung zurückgeführt werden, weswegen das Mesotheliom als „Signaltumor“ in der Arbeitsmedizin gilt [14]. Daher besteht bei jeder Diagnose einer malignen Mesotheliom-Erkrankung auch der Verdacht einer Berufskrankheit. Durch die Anerkennung als Berufskrankheit hat der Betroffene Anspruch auf Leistungen aus der gesetzlichen Unfallversicherung. Diese reichen von therapeutischen Maßnahmen bis hin zu Rentenzahlungen.
Neben der beruflichen Exposition, die am häufigsten auftritt, sind auch indirekte Gefährdungen z. B. durch Kontakt mit der Arbeitskleidung von Asbest-Arbeitern in einem gemeinsamen Haushalt oder durch die Nachbarschaft mit ehemaligen Asbest-verarbeitenden Betrieben zu berücksichtigen. Denn auch verhältnismäßig niedrige Belastungen mit Asbest-Staub über einen längeren Zeitraum führen offenbar zu Mesotheliomen. Daher sind gründliche Erhebungen zur Arbeitsanamnese durch erfahrene Sachverständige notwendig, um auch bei Latenzzeiten von mehr als 60 Jahren Kenntnis über mögliche Expositionen zu erlangen. Dabei werden auch medizinische Nebenbefunde wie Pleuraplaques, Asbest-Körperchen und Asbest-Fasern in der Lunge, als Hinweise auf eine zurückliegende Exposition hinzugezogen.
Schwieriger ist die Anerkennung von Bronchial- oder Kehlkopfkarzinomen als Berufskrankheit. Durch die lange Latenzzeit sowie das häufigere Auftreten dieser Tumorerkrankungen können nicht immer Rückschlüsse auf eine frühere Belastung mit Asbest-Staub gezogen werden. Daher sind sogenannte Brückenbefunde notwendig, die einen Kausalzusammenhang zwischen Exposition und Erkrankung herstellen. Dazu zählen das gleichzeitige Auftreten einer Asbestose, Erkrankungen der Pleura oder der Nachweis der Einwirkung einer kumulativen Asbest-Faserstaubdosis am Arbeitsplatz von mindestens 25 Faserjahren. Das Faserjahr ist ein Schätzmaß aus der Arbeitsmedizin und definiert die Exposition gegenüber einer Konzentration von 1 × 106 Asbestfasern einer kritischen Größe pro m3 Luft während eines Jahres bei täglicher, achtstündiger Arbeitszeit. Jedoch stellen einige Wissenschaftler den Grenzwert von 25 Faserjahren als geeigneten Parameter für die gutachterliche Beurteilung infrage. Zum einen divergieren die Berechnungen basierend auf verschiedenen Expositionsszenarien erheblich, zum anderen existiert nur eine geringe Beziehung zwischen der berechneten kumulativen Asbest-Faserstaubdosis und der ermittelten Belastung mit Asbest-Staub in der Lunge. Diese ist nicht nur von der Biopersistenz der unterschiedlichen Asbest-Fasern abhängig, sondern auch individuell sehr unterschiedlich [16].
Kein Ende der Asbest-Belastung
Auch in den nächsten Jahrzehnten muss mit weiteren Neuerkrankungen in Deutschland gerechnet werden. Schätzungsweise existieren über 3000 verschiedene, Asbest-haltige Arbeitsmaterialien, die in unzähligen Gebäuden verbaut wurden. Die Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA) geht davon aus, dass sich noch 80% der ursprünglich verwendeten Asbest-haltigen Bauteile im heutigen Gebäudebestand befinden [17]. Sind die Fasern dabei festgebunden, stellen sie in der Regel keine gesundheitliche Gefahr dar. Erst durch Umbau- und Sanierungsarbeiten werden Fasern in großen Mengen freigesetzt und können für anwesende Personen zu einem nicht zu unterschätzenden Gesundheitsrisiko werden. Daher sollten bei Verdacht auf Asbest-haltige Materialien spezialisierte Sachverständige und Prüfinstitute herangezogen werden. Einige Apotheken bieten auch Asbest-Tests an, bei denen die Proben zu anerkannten Analyse-Laboren eingeschickt werden. Ebenso sollte die Demontage und Entsorgung von einer Fachfirma mit entsprechendem Sachkundenachweis durchgeführt werden.
Anders sieht es in Ländern wie Russland, Brasilien oder China aus. Dort wird noch bis heute Asbest abgebaut und kommerziell verwendet. Weltweit werden mehr als zwei Millionen Tonnen Asbest pro Jahr gefördert und als billiges Baumaterial in Entwicklungsländer exportiert [18]. Laut der Weltgesundheitsorganisation (WHO) arbeiten rund 125 Millionen Menschen an Asbest-exponierten Arbeitsplätzen [19]. Das Ziel, ein weltweites Asbest-Verbot zu erlangen, um den weiteren Anstieg der Zahl der Erkrankungen zu verhindern, scheint daher in weite Ferne zu rücken. |
Literatur
[1] Marquardt H, Schäfer SG, Barth H. Lehrbuch der Toxikologie. 3. Auflage 2013. Wissenschaftliche Verlagsgesellschaft Stuttgart
[2] IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100 C. IARC Working Group on the Evaluation of Carcinogenic Risk to Humans. International Agency for Research on Cancer 2012
[3] Jamrozik E, de Klerk N, Musk AW. Asbestos-related disease. Intern Med J 2011;41(5):372-380
[4] Barrett JC. Cellular and molecular mechanisms of asbestos carcinogenicity: implications for biopersistence. Environ Health Perspect 1994;102(5):19-23
[5] Liu G, Beri R, Mueller A, Kamp DW. Molecular mechanisms of asbestos-induced lung epithelial cell apoptosis. Chem Biol Interact 2010;188(2):309-318
[6] Selikoff IJ, Hammond EC. Asbestos and smoking. JAMA 1979;242(5):458-459
[7] Inamura K, Ninomiya H, Nomura K et al. Combined effects of asbestos and cigarette smoke on the development of lung adenocarcinoma: different carcinogens may cause different genomic changes. Oncol Rep 2014;32(2):475-482
[8] Hurbánková M, Hraškov D, Beňo M et al. Combined effect of selected mineral fibres and tobacco smoke on respiratory tract in rats. Cent Eur J Public Health 2014;22(3):159-163
[9] Ngamwong Y, Tangamornsuksan W, Lohitnavy O et al. Additive Synergism between Asbestos and Smoking in Lung Cancer Risk: A Systematic Review and Meta-Analysis. PLoS One 2015;10(8):e0135798
[10] Delgermaa V, Takahashi K, Park EK et al. Global mesothelioma deaths reported to the World Health Organization between 1994 and 2008. Bull World Health Organ 2011;89(10):716-724,724A-724C
[11] Wagner JC, Sleggs CA, Marchand P. Diffuse pleural mesothelioma and asbestos exposure in the North Western Cape Province. Br J Ind Med 1960;17:260-271
[12] Liu B, van Gerwen M, Bonassi S, Taioli E. IASLC Mesothelioma Taskforce. Epidemiology of Environmental Exposure and Malignant Mesothelioma. J Thorac Oncol 2017 2017;pii:S1556-0864(17)30278-2, doi: 10.1016/j.jtho.2017.04.002 [Epub ahead of print]
[13] Krebs in Deutschland 2011/2012. 10. Ausgabe. Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg). Berlin, 2015
[14] Neumann V, Lцseke S, Nowak D, Herth FJF, Tannapfel A. Malignes Pleuramesotheliom. Dtsch Ärztebl Int 2013;110(18): 319-326
[15] Creaney J, Robinson BW. Malignant mesothelioma biomarkers - from discovery to use in clinical practise for diagnosis, monitoring, screening and treatment. Chest 2016, 10.1016/j.chest.2016.12.004
[16] Fischer M, Günther S, Müller KM. Faserjahr, Asbestbelastung der Lungen, Asbestosen. Pneumologie 2000;54(4):155-159
[17] Nationales Asbest-Profil Deutschland. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA), 1. Auflage, Dortmund 2015
[18] Stayner L, Welch LS, Lemen R. The worldwide pandemic of asbestos-related diseases. Annu Rev Public Health 2013;34:205-216
[19] Chyrsotile Asbestos. World Health Organization 2014
[20] Deutsche Forschungsgemeinschaft - Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe: Maximale Arbeitsplatzkonzentrationen 1970, Mitteilung VI, S. 24, Harald Boldt Verlag, Boppard
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.