
- DAZ.online
- DAZ / AZ
- DAZ 19/2017
- Neues Small molecule ...
Arzneimittel und Therapie
Neues Small molecule gegen Rheuma eingeführt
Oraler JAK-Inhibitor Tofacitinib greift wie Baricitinib in das Entzündungsgeschehen ein
Der Wirkstoff zeichnet sich in dieser Indikation durch ein frühes Ansprechen, eine vergleichbare Wirksamkeit wie Biologika und eine langfristige Effektivität und Sicherheit aus. Positiv für die Akzeptanz der Patienten dürfte der orale Applikationsweg sein. Derzeit wird Tofacitinib in weiteren Indikationen, beispielsweise Psoriasis und Psoriasis-Arthritis untersucht.
Trotz zahlreicher therapeutischer Optionen zeigen Studien immer wieder, dass viele von Rheuma Betroffene unzureichend behandelt sind. Für diese Patienten gibt es seit wenigen Wochen gleich zwei neue Optionen: Nach dem Inhibitor der Januskinasen (JAK) 1 und 2 Baricitinib (Olumiant®) hat die EMA nun auch den JAK-Inhibitor Tofacitinib (Xeljanz®) zugelassen. Er ist in Kombination mit Methotrexat (MTX) indiziert bei erwachsenen Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis (RA), die auf ein oder mehrere krankheitsmodifizierende antirheumatische Arzneimittel unzureichend angesprochen oder diese nicht vertragen haben. Tofacitinib kann auch als Monotherapie gegeben werden, wenn MTX nicht toleriert wird oder diese Behandlung ungeeignet ist.
Wirkprinzip JAK-Inhibition
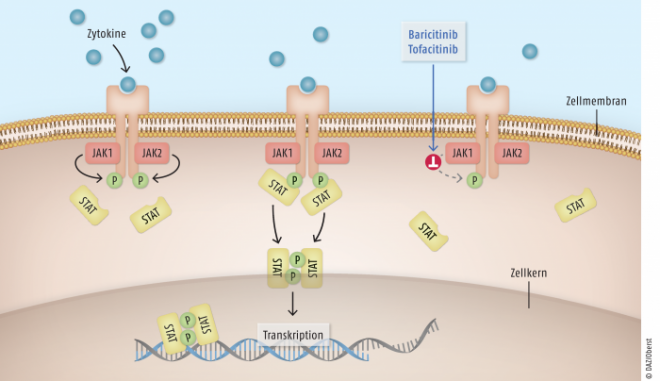
Tofacitinib ist ein potenter, selektiver Inhibitor der Januskinasen (JAKs), von denen bisher vier Vertreter (JAK 1-3, TyK2) bekannt sind. Die Bezeichnung JAK leitet sich vom römischen Gott Janus ab, der in zwei entgegengesetzte Richtungen blicken kann. In Analogie dazu nehmen JAK extrazellulär ankommende Signale von Zytokinen und Wachstumsfaktoren auf und leiten sie intrazellulär weiter, wobei sie stets paarweise agieren. Dabei sind verschiedene Kombinationen wie JAK1/JAK 2, JAK1/JAK3 etc. möglich. Jede JAK-Paarung besitzt bestimmte Funktionen. So ist beispielsweise JAK2/JAK2 an der Erythropoese beteiligt. Auch viele proinflammatorische Zytokine, die in die Pathogenese der rheumatoiden Arthritis involviert sind, nutzen JAKs zur intrazellulären Signalweiterleitung.
Die beiden JAK-Moleküle befinden sich intrazellulär am membranständigen Rezeptor. Bindet extrazellulär ein Zytokin, kommt es zur Rezeptor-Dimerisierung und zur Phosphorylierung der beiden JAKs. Anschließend werden zwei STAT-Moleküle (STAT: signal transducer and activator of transcription) gebunden und ebenfalls phosphoryliert und dimerisiert. Die STAT-Dimere wandern anschließend in den Zellkern und bewirken dort beispielsweise die Transkription von Genen, die proinflammatorische Proteine kodieren (Abb.). Diese stimulieren schließlich entzündliche Prozesse und die Differenzierung von Immunzellen. Tofacitinib besitzt eine strukturelle Ähnlichkeit zu ATP, jedoch keine Triphosphat-Gruppe. Das kleine Molekül („small molecule“) bindet an das katalytische Zentrum der JAK und hemmt damit alle nachfolgenden Prozesse wie die Signalübertragung von Interleukinen (IL-2, IL-4, IL-6, IL-7, IL-9, IL-15 und IL-21) und von Typ-I- und Typ-II-Interferonen. Dies führt zu einer Modulation der immunologischen und inflammatorischen Folgereaktionen und idealerweise zu einer Abnahme der RA-Krankheitsaktivität.
Weltweit über 90.000 Patienten
Tofacitinib wurde bisher in klinischen Studien mit mehr als 6000 Patienten, darunter sechs Phase-III-Studien untersucht, berichtete PD Dr. Peter-Andreas Löschmann auf der Einführungspressekonferenz von Xeljanz® am 4. Mai 2017 in Berlin. Seit der Zulassung in den USA wurden weltweit mehr als 90.000 Patienten behandelt. In den Phase-III-Studien erhielten sie Tofacitinib entweder als Monotherapie, in Kombination mit Methotrexat (MTX) oder mit anderen Wirkstoffen (DMARDs). Zu den primären Endpunkten zählten das ACR20-Ansprechen (eine mindestens 20%ige Verbesserung der Krankheitszeichen und Symptome zum Ausgangswert) und die klinische Remission, definiert als das Erreichen einer Krankheitsaktivität < 2,6, gemessen mit dem Disease Activity Score 28-4 (DAS28-4 [ESR]). Bezüglich des ACR20 erreichten bereits in den ersten zwei Behandlungswochen signifikant mehr Patienten unter einer Tofacitinib-Monotherapie (zweimal täglich 5 mg) sowie einer Kombinationstherapie mit DMARDs ein signifikant besseres Ansprechen als Placebo. Dieses Ansprechen konnte gegenüber Placebo bei der Monotherapie bis zum Monat 3, bei der Kombinationstherapie bis zum Monat 6 aufrechterhalten oder verbessert werden. Die im sechsten Behandlungsmonat gemessene klinische Remission (DAS28-4 (ESR)-Score) war in vier Studien ebenfalls signifikant besser als Placebo und in einer Studie zudem vergleichbar mit Adalimumab.
Immunsuppression erhöht Infektionsgefahr
Zur Langzeitsicherheit von Tofacitinib liegen umfangreiche Daten aus bis zu 8,5 Behandlungsjahren vor. Wie alle immunsupprimierenden Therapien erhöht auch eine Behandlung mit Tofacitinib das Infektionsrisiko, was sich in den Phase-III-Studien im sehr häufigen Auftreten von Infektionen wie Bronchitis, Harnwegsinfektionen, Infektionen der oberen Atemwege sowie Gürtelrosen zeigte. Die Inzidenzrate für schwere Infektionen lag bei 2,7 pro 100 Patientenjahren. Bei längerer Tofacitinib-Anwendung stieg sie jedoch nicht an. In den ersten Behandlungsmonaten können sich auch die Lipidspiegel erhöhen, sie bleiben jedoch anschließend stabil. Bisher wurde kein Anstieg kardiovaskulärer Ereignisse beobachtet. In einer Postmarketing-Studie wird diese Nebenwirkung über fünf Jahre weiter beobachtet.
Cave: Herpes-Infektion
Da die Behandlung das Risiko für die Reaktivierung einer Herpes-Infektion erhöht, sollte als prophylaktische Maßnahme neben einem Tuberkulose-Screening auch eine Impfung gegen Herpes zoster gemäß den Impfempfehlungen in Betracht gezogen werden. Patienten mit aktiven Infektionen, einschließlich lokalisierter Infektionen, sollten Tofacitinib nicht erhalten. In der Schwangerschaft und bei schwerer Leberfunktionsstörung ist Tofacitinib kontraindiziert. Die allgemein empfohlene Dosis beträgt zweimal täglich 5 mg. In bestimmten Fällen sollte sie auf einmal täglich 5 mg reduziert werden, und zwar bei Patienten, die starke Inhibitoren von Cytochrom P450 3A4 erhalten (z. B. Ketoconazol), bei Patienten, die gleichzeitig mindestens ein Arzneimittel erhalten, das zu einer mittelstarken Hemmung von CYP3A4 und zu einer starken Hemmung von CYP2C19 führt (z. B. Fluconazol) sowie bei Patienten mit schwerer Nierenfunktionsstörung oder mittelschwer eingeschränkter Leberfunktion. |
Quelle
Albrecht K et al. Clinical remission in rheumatoid arthritis. Data from the early arthritis cohort study CAPEA. Z Rheumatol 2016;75(1):90-6, doi: 10.1007/s00393-015-0019-5
Fachinformation Xeljanz® 5 mg Filmtabletten, Stand März 2017





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.