
- DAZ.online
- DAZ / AZ
- DAZ 14/2017
- Pharmakotherapie beim ...
Pharmakotherapie
Pharmakotherapie beim Parkinson-Syndrom
Grundlagen für das Medikationsmanagement
Die Pharmakotherapie beschäftigt sich mit dem Nutzen der Medikation in der betreffenden Indikation. Sie richtet sich nach den Ergebnissen klinischer Studien, Reviews und Metaanalysen, die letztlich in die entsprechenden Leitlinien einfließen. Ausschlaggebend ist die Evidenzlage, denn ein pharmakologisch sinnvoller Ansatz muss nicht zwangsläufig zu einem Therapieerfolg führen. Neue Studienergebnisse, aber auch Leitlinien führen immer wieder zu Kontroversen. In der Serie Pharmakotherapie wird der aktuelle Stand ausgewählter Indikationen beleuchtet. Sie gibt damit Sicherheit in der noch recht jungen pharmazeutischen Disziplin.
Epidemiologie
Das idiopathische Parkinson-Syndrom (IPS) ist für die Mehrzahl der Parkinson-Syndrome verantwortlich, die Prävalenz nimmt mit steigender Lebenserwartung zu [1]. In Europa sind 1 bis 2% der über 60-Jährigen von Parkinson betroffen, man rechnet mit ca. 300.000 Patienten in Deutschland [2, 3]. Aufgrund epidemiologischer Erhebungen wird vermutet, dass Umwelteinflüsse und Lebensstil die Krankheit deutlicher begünstigen als der genetische Hintergrund [4]. Bei Erkrankungsausbruch in jüngeren Lebensjahren (Early-onset Parkinson‘s disease, EOPD) stehen Polymorphismen und monogenetische Formen hingegen im Vordergrund. Männer und Frauen sind in etwa gleich häufig betroffen [5]. Die durchschnittlichen Medikationskosten pro Patient und Jahr wurden für Deutschland in 2011 mit 2960 Euro angegeben [6], durch Patentausläufe bei den teuren Dopamin-Agonisten dürften die Medikationskosten inzwischen allerdings deutlich niedriger liegen.
Pathophysiologie und Ätiologie
Vom idiopathischen Parkinson-Syndrom müssen die Parkinson-Plus- oder atypischen Parkinson-Syndrome abgegrenzt werden, die in Kombination mit weiteren neurodegenerativen Erkrankungen auftreten. Die Multisystematrophie (MSA), die progressive supranukleäre Blickparese (PSP) und die Lewy-Körper-Demenz gehören zu den bekannteren Parkinson-Plus-Syndromen und sprechen zudem schlechter auf eine Pharmakotherapie an. Sekundäre Parkinson-Formen entstehen hingegen durch unterschiedliche (z. B. einmalige) Gewebsschädigungen der maßgeblichen Hirnareale und verlaufen daher oft nicht progressiv, zum Bespiel nach Resektion oder Trauma. Anders stellt es sich beim idiopathischen Parkinson-Syndrom dar, das – wenn auch in individuell stark unterschiedlichem Maße – immer progredient verläuft.
Bestimmend für die Symptomatik ist bei allen Parkinson-Syndromen der Untergang dopaminerger Zellen in der Substantia nigra. Dort bilden sich die typischen Lewy-Körperchen aus, die vorwiegend aus α-Synuclein und Ubiquitin, aber auch aus anderen Protein-Ablagerungen bestehen. Es kommt zu exzessivem oxidativem Stress [7].
Oft besteht ein Zusammenhang zwischen Diagnosezeitpunkt und Verlauf. Wird ein idiopathisches Parkinson-Syndrom in jüngeren Jahren diagnostiziert, beruht es häufiger auf monogenetischen Ursachen, die Erkrankung verläuft dann oft aggressiver. Monogenetische Formen sind aber selten und abhängig vom Genlocus sind die Symptome auch dann sehr unterschiedlich ausgeprägt, so dass diese Aussage nicht immer zutreffen muss. Während sich der Verlauf unter PARK8-Mutationen (Defekt der Leucin-reichen Repeat-Kinase, LRRK2 [8]) kaum vom idiopathischen Parkinson-Syndrom unterscheidet, sind Patienten mit PARK2-Mutation (Defekt der Ubiquitin-Protein-Ligase Parkin) bereits in jungen Jahren symptomatisch [9]. PINK1-Mutationen werden ebenfalls mit dem Auftreten des Parkinsons in frühen Jahren in Verbindung gebracht [10]. Für Großbritannien wurde in einer Studie mit EOPD-Patienten eine Häufigkeit von 8,6% für PARK2 (Parkin), 3,7% für PINK1 und 0,4% für PARK7 festgestellt [11].
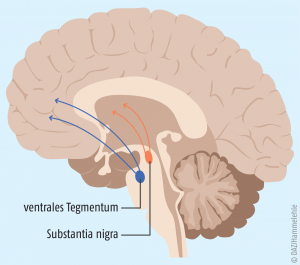
Beim idiopathischen Parkinson-Syndrom sind zunächst verschiedene Neurone der Pars compacta als Teil der Substantia nigra (SNc) betroffen. Im Krankheitsverlauf degenerieren dann zunehmend auch Neurone des ventralen Tegmentums (Area tegmentalis ventralis), und dort der sogenannten A10-Zellgruppe, die mit der Projektion zum limbischen Cortex in Zusammenhang steht (Emotionen und Triebverhalten) [12, 13] (siehe Abb. 1).
Ein Ungleichgewicht in diesem Bereich wird daher mit nicht-motorischen Parkinson-Symptomen, speziell auch der Depression in Verbindung gebracht. Nicht-motorische Symptome sind so gesehen direkte Parkinson-Symptome und nicht zufällig auftretende Begleiterkrankungen.
Biochemie und Pharmakologie
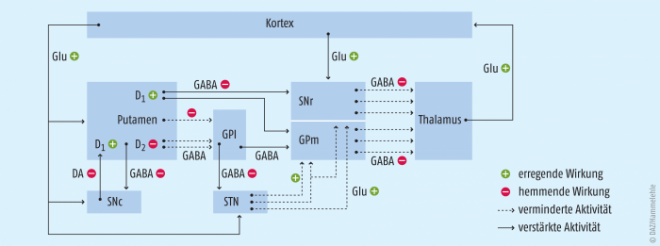
Mit dem Zelluntergang in der Substantia nigra geht der Verlust der Dopamin-Produktion einher. Bei einem Verlust von ca. 60 % der dopaminergen Zellen in der Substantia nigra kommt es zu den für Parkinson typischen Symptomen. Mangels kausaler Therapieformen erübrigen sich dennoch eine frühzeitigere Diagnose oder ein Screening. Die nigrostriatalen Neuronen spielen eine bedeutende Rolle bei der extrapyramidalen Willkürkontrolle. In diesem Bereich hat Glutamat eine erregende Funktion, während Dopamin und Gamma-Aminobuttersäure (GABA) hemmende Neurotransmitter sind. Das Gleichgewicht dieser drei Transmitter ist für die Ausführung willkürlicher Bewegungen ausschlaggebend. Da beim Morbus Parkinson vorwiegend dopaminerge Neuronen degenerieren, sind die im motorischen Zusammenspiel hemmenden glutamatergen thalamokortikalen Bahnen unverhältnismäßig stark aktiv, somit resultiert eine Hypokinese (siehe Abb. 2).
Ein mögliches pharmakologisches Target ist auch α-Synuclein. Die Anhäufung von sterisch verändertem (misfolded) und agglutiniertem α-Synuclein in den Lewy-Körperchen ist eine wahrscheinliche Ursache für den Zelluntergang. Die pathologische Form des α-Synucleins breitet sich wohl im Nervensystem aus, ist also quasi infektiös, wenn auch nicht übertragbar [14]. Mit steigendem Eisen-Blutspiegel nimmt das Risiko ab, an Parkinson zu erkranken, obwohl sich Eisen in der Substantia nigra vermehrt einlagert [15]. Ein Paradoxon. Da das glutamaterge und das cholinerge System übermäßig stark aktiviert sind, ergeben sich auch hier pharmakologische Ansatzpunkte. Obwohl das Krankheitsverständnis deutlich zugenommen hat, bleiben weiterhin viele Fragen offen. So lassen sich viele nicht-motorische Symptome schwer erklären. Ein erhoffter Durchbruch in der kausalen pharmakologischen Behandlung steht trotz intensiver Forschung weiterhin aus.
Beim Parkinson ist im Ergebnis also das Zusammenspiel von Basalganglien, Thalamus und Cortex betroffen, die veränderte Erregungsleitung ist auch elektrophysiologisch nachweisbar [16]. Wesentlicher Aspekt in der Therapie der Parkinson-Syndrome bleibt aus pharmakologischer Sicht derzeit der Ausgleich des Dopamin-Mangels am D2-Rezeptor im zentralen Nervensystem (ZNS). Dopamin wird im synaptischen Spalt von den Monoaminoxidasen A und B (MAO-A und MAO-B) und der Catechol-O-Methyltransferase (COMT) abgebaut. Hier ergeben sich Ansatzpunkte zur Verlängerung der Dopamin-Wirkung (MAO-B-Hemmer, COMT-Hemmer). Gamma-Aminobuttersäure (GABA) ist ein Gegenspieler des Dopamins, so dass dessen relative Wirkung auch durch eine GABA-Hemmung verstärkt werden kann (z. B. NMDA-Rezeptorantagonisten Amantadin und Budipin). Serotonin und Noradrenalin spielen im Krankheitsgeschehen eine Rolle, die aber eher unklar ist [17].
Symptome und klinische Präsentation
Kardinalsymptome des idiopathischen Parkinson-Syndroms sind Bradykinese, Ruhetremor, Rigor und - je nach Definition – posturale Instabilität (Haltungsschwäche). Der Ruhetremor tritt beim Parkinson stets asymmetrisch auf. Mimikverlust, Trippelgang, Artikulationsschwierigkeiten und Schluckstörungen sind weitere motorische Symptome. Ein Verlust des Geruchssinns wird häufig schon in frühen Stadien bemerkt. Die Krankheit äußert sich im weiteren Verlauf aber auch durch nicht-motorische Symptome, die jedenfalls teilweise direkt auf die neuronale Beeinträchtigung zurückzuführen sind. Depressionen, Halluzinationen, Obstipation und Schlafstörungen sind typische Ausprägungen. Zusätzlich beeinträchtigen häufig auch starke Muskelschmerzen die Lebensqualität der Betroffenen.
Diagnostik/Einteilung
Diagnostik
Die Diagnose soll durch Spezialisten gestellt werden, wenn Bradykinese zusammen mit mindestens einem weiteren Kardinalsymptom festgestellt wird. Weitere Symptome unterstützen die Diagnose. Wichtig ist auch eine Bildgebung des Kopfes (CT oder MRT), um andere Ursachen auszuschließen (Tumor, Gefäßerkrankungen). Bei unklarer Diagnose kann eine Verbesserung der Motorik nach Levodopa-Gabe unterstützend getestet werden. Eine nuklearmedizinische Dopamin-Transporter-Szintigrafie (DAT-Scan) gilt als sicherste Diagnostik, wird aber nur in schwierigen Fällen eingesetzt.
Einteilung
Die Krankheitsstadien werden üblicherweise anhand der Skala nach Hoehn und Yahr eingeteilt:
- Stadium 0: keine Anzeichen der Erkrankung
- Stadium 1: einseitige Erkrankung
- Stadium 1.5: einseitige Erkrankung und axiale Beteiligung
- Stadium 2: beidseitige Erkrankung ohne Gleichgewichtsstörungen
- Stadium 2.5: leichte beidseitige Erkrankung mit Ausgleich beim Zugtest
- Stadium 3: leichte bis mäßige beidseitige Erkrankung, leichte Haltungsinstabilität, körperlich unabhängig
- Stadium 4: starke Behinderung, kann noch ohne Hilfe laufen und stehen
- Stadium 5: ohne Hilfe an den Rollstuhl gefesselt oder bettlägerig
Eine wesentlich feinere Abstufung ergibt sich anhand der Unified Parkinson`s Disease Rating Scale (UPDRS), die in verschiedenen Versionen angepasst wurde. Sie erfasst die Schwere der Erkrankung zwischen 0 (keine Beeinträchtigung) und 199 (schwerstmögliche Beeinträchtigung). Die UPDRS wird vor allem zur Beurteilung von Veränderungen durch Therapieumstellungen und in Studien eingesetzt.
Therapieprinzipien
Die Therapie des idiopathischen Parkinson-Syndroms beruht auf mehreren Säulen. Neben der Pharmakotherapie haben auch die Physiotherapie und die Logopädie einen hohen Stellenwert in der Behandlung. Der Erfolg der Physiotherapie wird neuerdings auch wieder kontrovers diskutiert [18, 19]. Eine weitere Behandlungsmöglichkeit ist die Tiefe Hirnstimulation, die speziell auf die motorischen Symptome großen Einfluss haben kann und bei bestimmten Patientengruppen auch schon in frühen Stadien eingesetzt werden kann [20, 21]. Aufgrund der komplizierten Therapie kann die Teilnahme an Selbsthilfegruppen die Gesundheitskompetenz der Patienten stark verbessern und so einen großen Einfluss auf die Therapie haben. In diesem Zusammenhang spielt auch die Betreuung durch die Apotheke eine große Rolle.
Pharmakotherapie
Die extreme motorische Abhängigkeit des Patienten von der dopaminergen Stimulation ist wichtig für das Verständnis der Pharmakotherapie. Änderungen dürfen stets nur graduell und an einem einzelnen Wirkstoff vorgenommen werden, mehrfache und drastische Eingriffe in die Therapie können dramatisch enden. Ein Absetzen der Medikamente bei Operationen, durch Gepäckverlust auf Reisen oder durch andere Umstände ist ein therapeutischer Notfall und sollte auch in der Apotheke entsprechend bewertet werden (Hilfeleistungspflicht).
Prinzipiell beginnt man die Behandlung des idiopathischen Parkinson-Syndroms mit einem Wirkstoff in Monotherapie, steigert die Dosierung und addiert im Krankheitsverlauf einen weiteren Wirkstoff, steigert die Dosierung erneut und verfährt in dieser Art und Weise auch mit dem dritten Wirkstoff. So einfach die Theorie, so schwierig ist die Einstellung jedoch in der Praxis. Die S3-Leitlinie der Deutschen Gesellschaft für Neurologie (DGN) zum idiopathischen Parkinson-Syndrom (IPS) ist 2016 neu erstellt worden und berücksichtigt viele Erkenntnisse der letzten Jahre zur klinischen Pharmakotherapie [22].
Kasuistiken
Gerd Z. ist ein 73-jähriger rüstiger Rentner mit idiopathischem Parkinson-Syndrom Stadium 3 nach Hoehn und Yahr. Weitere Diagnosen: Hypertonie, koronare Herzkrankheit (KHK), Depression und Skoliose. Er klagt über asymmetrischen Tremor, Freezing mehrfach täglich, Traurigkeit und Rückenschmerzen.
Die Medikation besteht aus:
Ropinirol 4 mg retard 1-0-0
Ramipril 5 mg 1-0-0
ASS 100 0-1-0
Frieda B. ist eine 81-jährige Dame mit fortgeschrittenem idiopathischem Parkinson-Syndrom, Stadium 4 nach Hoehn und Yahr. Weitere Diagnosen: Katarakt, Osteoporose, Halluzinationen, Dekubitus bei Bettlägerigkeit. Die Kommunikation ist schwierig, sie klagt über den Allgemeinzustand, starken Tremor der linken Hand, Schlafstörungen mit Albträumen und Schmerzen, auch berichtet sie über häufige Off-Phasen. Die Medikation besteht aus:
Madopar LT® 1-0-0-0-0-0
Levodopa/Benserazid 0-1-1-1-1-0
Madopar retard® 0-0-0-0-0-1
Rotigotin 6 mg TTS -0-0-0-0-0
Rasagilin 1 mg 1-0-0-0-0-0
Diclofenac 50 mg 1-0-1-0-1-0
Macrogol Beutel (nach Bedarf)
Später diskutieren Sie die Fälle mit dem verantwortlichen Psychiater. Wie bringen Sie sich ein? Haben Sie Anmerkungen? Im folgenden Text sind für die konkreten Fallbeispiele wichtige Informationen mit → markiert.
Initiale Therapie
Nach der Erstdiagnose stellt sich zunächst die Frage, wann mit der Pharmakotherapie begonnen werden sollte. Während man früher der Meinung war, dass man möglichst spät beginnen sollte, hat sich dieses Bild inzwischen umgedreht. Zugunsten einer besseren Lebensqualität in jüngeren Jahren beginnt man eine Therapie jetzt idealerweise direkt nach der Diagnosestellung. Bei der Auswahl des geeigneten Wirkstoffes geht man zudem weniger dogmatisch vor als früher. Tendenziell sollte man bei älteren Patienten mit Levodopa starten, bei jungen Patienten eher nicht. Der Grund liegt darin, dass Levodopa die subjektiv beste Wirkung besitzt, allerdings früher oder später an Wirkung verliert bzw. zu starken Fluktuationen führt, also dem Wechsel von Über- und Unterdosierungen. Ob die Fluktuationen allerdings durch die Dauer der Levodopa-Therapie oder durch das Fortschreiten der Erkrankung bedingt sind, wird diskutiert. Klarer scheint mit der PD-MED-Studie, dass die Unterschiede zwischen den drei dopaminergen Hauptsäulen Levodopa, Dopamin(D2)-Agonisten und MAO-B-Hemmern geringer sind als zuvor vermutet [23]. Auf die früher starre Altersgrenze von 70 Jahren für einen Therapiebeginn mit Levodopa wurde in der aktuellen Leitlinie verzichtet, der Patient sollte in die Entscheidung mit einbezogen werden. Da MAO-B-Hemmer besonders gut vertragen werden, würden sie sich bei jüngeren Patienten aber als initialer Therapieversuch anbieten, die deutsche Leitlinie schlägt in diesen Fällen allerdings D2-Agonisten als mögliche erste Wahl vor.
→ Im Fall von Gerd Z. wurde aufgrund seines guten Allgemeinzustandes offensichtlich zunächst auf eine Behandlung mit Levodopa verzichtet.
Krankheitsverlauf
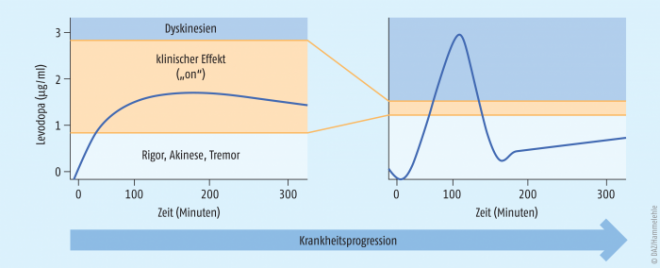
Schwieriger wird die Therapie im Krankheitsverlauf. Hier wechseln Phasen von übermäßiger dopaminerger Stimulierung mit unwillkürlicher Überbewegung (Peak-dose–Dyskinesien) mit Phasen von subtherapeutischer Stimulierung ab, den sogenannten Off-Phasen. Die Bewegungsunfähigkeit im Off wird als Freezing bezeichnet, die Betroffenen können dann z. B. ihr Bein nicht heben und nicht laufen, was entsprechend unangenehm ist. Im Gegensatz dazu müssen Überdosierungen durch übermäßige Dopamin-Stimulation mit daraus möglicherweise resultierenden Hyperkinesien und Halluzinationen vermieden werden. Momentaufnahmen des Patienten sind zur Beurteilung spätestens dann nicht mehr hilfreich. Eine Feineinstellung kann während stationärer Aufenthalte versucht werden, alternativ bietet sich die videounterstützte Therapie an, bei der der Patient sich zu unterschiedlichen Tageszeiten und Verfassungen präsentieren kann.
→ Frieda B. hingegen erhält bereits alle drei Säulen der dopaminergen Stimulierung und zeigt mit den Halluzinationen entweder Anzeichen einer Überdosierung oder eines fortgeschrittenen Krankheitsverlaufes. Hier wäre die Gabe von Quetiapin oder Clozapin die einzige Therapieoption, andere Antipsychotika dürfen als D2-Antagonisten nicht eingesetzt werden.
Endstadium
Nach langjähriger Therapie und mit zunehmendem Ausreizen der Pharmakotherapie und der anderen therapeutischen Optionen (Tiefe Hirnstimulation) ist mit deutlichen Behinderungen zu rechnen. Bewegungsunfähigkeit, Schlafstörungen, Schluckbeschwerden und Schmerzen erschweren den Alltag und fesseln den Patienten früher oder später ans Bett. Halluzinationen und Dyskinesien werden durch die dopaminerge Medikation unerträglich, so dass es ab einem gewissen Punkt günstig sein kann, die Dopamin-Agonisten abzusetzen und unter Inkaufnahme von motorischen Komplikationen nur noch mit Levodopa und COMT-Hemmer (gegebenenfalls plus MAO-B-Hemmer) zu arbeiten. Pflegerische Maßnahmen und der Umgang mit Komplikationen (Infektionen, Aspiration) stehen dann im Vordergrund der Bemühungen.
Wirkstoffe im klinischen Einsatz
Levodopa
Levodopa wird als ZNS-gängiges Prodrug stets mit einem Decarboxylase-Hemmer versehen, der nicht zentralgängig ist und damit in der Peripherie die vorzeitige Aktivierung und somit Nebenwirkungen verhindert. Die beiden eingesetzten Vertreter Benserazid und Carbidopa unterscheiden sich klinisch kaum. Da die Patienten die Wirkung des Levodopas aber direkt und unmittelbar verspüren (oder auch eben nicht), wird dies unter informierten Betroffenen kontrovers diskutiert, ebenso die Wirkunterschiede zwischen den verschiedenen Generika. Levodopa-Retardformulierungen werden hauptsächlich zur Überbrückung für die Nacht eingesetzt, während die löslichen Tabletten (Madopar® LT) besonders früh morgens und bei akuter Unterversorgung die Beweglichkeit wiederherstellen sollen. Typisch für Levodopa ist ein im Krankheitsverlauf immer enger werdendes therapeutisches Fenster, das zunehmend zu Fluktuationen führt, also dem schnellen Wechsel zwischen Über- und Unterdosierung, On- und Off-Phasen (siehe Abb. 3).
Durch die Gabe eines Catechol-O-Methyltransferase(COMT)-Hemmers können die Blutspiegel etwas geglättet werden. Entacapon ist in fixer Kombination mit Levodopa und Carbidopa (z. B. Stalevo®)erhältlich oder auch getrennt (z. B. Comtess®). Es wird auch dann zu jeder Levodopa-Gabe eingenommen. Tolcapon (Tasmar®) ist zwar stärker wirksam als Entacapon, wird aber wegen häufiger Leberschädigungen nur noch unter der Auflage zweiwöchentlicher Leberenzym-Kontrolle angewendet und spielt therapeutisch kaum noch eine Rolle. Neu zugelassen wurde 2016 Opicapon (Ongentys®), das nur einmal täglich gegeben werden muss. Bei der Auswahl der COMT-Hemmer Entacapon versus Opicapon sollte also vor allem eine etwaige Dysphagie berücksichtigt werden (Kapselgröße und Anzahl).
→ Im Patientenbeispiel wäre Frieda B. eine klassische Kandidatin für den Einsatz eines COMT-Hemmers. Sie klagt über häufige Fluktuationen. Entacapon kann zu jeder Levodopa-Gabe kombiniert werden. Möglicherweise kann bei Frieda B. dann auch ein Levodopa-Einnahmezeitpunkt entfallen. Sofern Frieda B. die großen Kombi-Kapseln aufgrund ihrer Dysphagie nicht schlucken kann, wird Entacapon einzeln gegeben. Treten auch hier Probleme auf, ist Opicapon mit der einmal täglichen Gabe eine gute Alternative.
Die Nebenwirkungen der Levodopa-Therapie lassen sich aus der dopaminergen Stimulation ableiten: Übelkeit und Hypotonie treten besonders initial auf und lassen sich durch Gabe von Domperidon lindern, Halluzinationen und Müdigkeit sind besonders unter hohen Dosierungen bei fortgeschrittenem Krankheitsbild ein Problem. Da Levodopa aus Patientensicht die beste Wirkung aller Parkinson-Medikamente entfaltet (Honeymoon-Phase), soll es besonders bei begrenzter Lebenserwartung und moderatem Progressionsrisiko direkt als erster Wirkstoff gegeben werden. Eine Besonderheit bei Levodopa ist die konkurrierende Aufnahme mit Eiweißen (bzw. Monoaminen). Es muss daher nüchtern gegeben werden, was bei der Anzahl der Einnahmezeitpunkte im fortgeschrittenen Stadium eine besondere Herausforderung darstellen kann. Levodopa kann in besonders schweren Fällen auch als Gel per Pumpe und Sonde gegeben werden. Es werden dann ein morgendlicher Bolus, eine Erhaltungsdosis und ein vom Patienten auslösbarer Bolus festgelegt.
D2-Dopamin-Agonisten
Auch die Dopamin-Agonisten wirken wie Levodopa am D2-Rezeptor und wurden ursprünglich aus dem Mutterkorn isoliert. Diese sogenannten Ergot-Dopamin-Agonisten werden wegen des Auftretens von Herzklappenfibrosen aber nur noch als Reservemedikation eingesetzt. Die Nicht-Ergot-Dopamin-Agonisten unterscheiden sich leicht in ihrer Affinität zum D1-, D2- und D3-Rezeptor, wobei die Hauptwirkung immer über den D2-Rezeptor vermittelt ist. Müdigkeit und Halluzinationen sind häufige therapielimitierende Nebenwirkungen. Ein wesentlicher Vorteil gegenüber Levodopa ist die bessere Kinetik: Ropinirol, Pramipexol und Rotigotin (als TTS) sind als 24-Stunden-Formulierung verfügbar. Piribedil muss zwar dreimal täglich eingenommen werden, scheint aber weniger zu sedieren als die anderen Dopaminagonisten [24]. Die weiteren Nebenwirkungen entsprechen denen des Levodopas. Besonders auffällig ist bei den Dopamin-Agonisten die Einschränkung der Impulskontrolle mit entsprechender Folge für den Spiel- und Sexualtrieb. Alle Wirkstoffe dieser Klasse müssen besonders langsam aufdosiert werden. D2-Dopamin-Agonisten werden typischerweise bei jüngeren Patienten als Erstmedikation, als add on nach dem MAO-B-Hemmer oder ergänzend unter bestehender Levodopa-Therapie zur Verstärkung der Wirkung und zum Überbrücken von Phasen der Unterversorgung z. B. nachts eingesetzt.
MAO-B-Hemmer
Die MAO-B-Hemmer Selegilin, Rasagilin und Safinamid galten bis vor wenigen Jahren als relativ schwache Wirkstoffe in der Parkinson-Therapie. In der PD-MED-Studie wurde aber festgestellt, dass sie ähnlich stark wirken wie Levodopa und Dopaminagonisten und dass der Effekt auch über längere Zeit anhält, auch dies wurde zuvor oft anders bewertet.
Die Hemmung der Monoaminoxidase wirkt sich zwar nicht nur auf Dopamin, sondern auch auf andere Monoamine aus, der Cheese-Effekt mit Bluthochdruckkrisen nach tyraminreicher Kost kann bei den selektiven MAO-B-Hemmern vernachlässigt werden [25]. Rasagilin wird sehr gut vertragen und scheint leicht neuroprotektiv zu wirken [26], die klinische Relevanz der Neuroprotektion ist aber trotz entsprechender Hinweise auch in der TEMPO-Studie nicht erkennbar und nicht erforscht [27]. Das neuere Safinamid reguliert zusätzlich zur MAO-B-Hemmung die erhöhte Glutamat-Freisetzung, klinisch scheint es etwas stärker gegen Tremor zu wirken als die anderen MAO-B-Hemmer.
Interessiert an klinischer Pharmazie?
Dann besuchen Sie doch das Pharmakotherapie-Symposium und diskutieren mit führenden Experten über die Zukunft der Pharmazie, die aktuellen Therapiestandards und das Medikationsmanagement der wichtigsten kardiovaskulären Erkrankungen. Aus den USA berichten Prof. Dr. Hartmut Derendorf und Prof. Dr. Paul Doering über das Entwicklungspotenzial der Pharmazie und das breite Tätigkeitsfeld, in dem klinische Pharmazeuten tätig werden können.
Experten aus der niedergelassenen Praxis für Allgemeinmedizin, der Universitätsklinik für Kardiologie und Angiologie und der Apotheke beleuchten ihre Sicht zur Versorgungssituation und zum Medikationsmanagement an den Beispielen Arteriosklerose, KHK und lipidsenkende Therapie. Welche Daten stehen wem zur Verfügung und welches Zusammenspiel ist nötig, um ein optimales Therapieergebnis zu erzielen?
Veranstaltet wird das Symposium von der University of Florida (College of Pharmacy) in Zusammenarbeit mit der Apothekerstiftung Westfalen-Lippe, der Deutschen Apotheker Zeitung und mit freundlicher Unterstützung durch Dermasence-Medizinische Hautpflege.
Symposium für Pharmakotherapie, Medikationsmanagement und patientenorientierte Pharmazie, Münster, 14. Juni 2017, 9.00 Uhr bis 17.00 Uhr. Weitere Informationen unter www.pharmakotherapie-symposium.de
NMDA-Antagonisten
Als Antagonist am N-Methyl-D-Aspartat(NMDA)-Rezeptor reduziert Amantadin die Wirkung von Glutamat an diesem Rezeptor. Glutamat ist in diesem Bereich ein Gegenspieler zu Dopamin, so dass sich die Dopamin-Wirkung relativ verstärkt. Amantadin wird seit den 1960er-Jahren gegen Parkinson eingesetzt, hat aber deutlich an Bedeutung verloren. Uitti et al. stellten in einer retrospektiven Auswertung eine Lebensverlängerung unter durchschnittlich 36-monatiger Amantadin-Gabe fest [28]. Aufgrund zahlreicher unerwünschter Wirkungen wird es vor allem dann eingesetzt, wenn therapieresistente Symptome wie Dyskinesien, Akinese, Rigor und behandlungsresistenter Tremor auftreten. Unerwünschte Wirkungen wie Schlafstörungen bei Einnahme nach dem Mittag sind durch eine Retardformulierung (Nurelin®, USA) und die nächtliche Gabe möglicherweise vermeidbar, während Verstopfung, Halluzinationen, Benommenheit und Mundtrockenheit dosisabhängig zunehmen [29]. Eine Rolle spielen hierbei sicher die anticholinergen Eigenschaften. Amantadin ist daher wie die Anticholinergika bei Demenz nicht geeignet. Bei akinetischer Krise oder zum Überbrücken während längerer Operationen kann es als Infusion eingesetzt werden. Auch Budipin ist ein schwacher NMDA-Antagonist mit zusätzlicher antimuskarinerger Komponente und reversibler MAO-B-Hemmung. Es wird ähnlich wie Amantadin besonders bei hartnäckigen Dyskinesien und Tremor eingesetzt. Problematisch sind QT-Zeit-Verlängerungen, weshalb eine Verordnung nur noch nach Verpflichtungserklärung zur Einhaltung der EKG-Kontrollen erfolgen darf.
Anticholinergika
Wenn dem Ruhetremor anders nicht begegnet werden kann, ist die Gabe von Anticholinergika (z. B. Biperiden) manchmal unvermeidbar. Wegen der schon durch die motorischen Symptome erhöhten Sturzneigung von Parkinsonpatienten ist dies entsprechend ungünstig.
Apomorphin
Das Morphin-Derivat wirkt direkt agonistisch an postsynaptischen D1- und D2-Rezeptoren. In Off-Phasen kann der Patient sich selbst bzw. ein Betreuer Apomorphin injizieren und so schnell wieder die Beweglichkeit verbessern. Ein Apomorphin-Pen (z. B. Apo-go®) ist hierfür zugelassen und erhältlich. |
Erweitertes Medikationsmanagement und AMTS
Tipps zum Umsetzen auf Station und in der Offizin
Wichtig ist es, bei Patienten mit Morbus Parkinson Dopamin-Antagonisten jeder Art zu vermeiden. Da Übelkeit initial durch die dopaminergen Wirkstoffe selbst hervorgerufen wird und Halluzinationen im fortgeschrittenen Stadium und bedingt durch hohe Dosierungen ebenfalls häufig auftreten, finden sich im Medikationsplan von Parkinson-Patienten immer wieder Wirkstoffe wie Metoclopramid und ungeeignete Antipsychotika. Gegen Übelkeit kann bei Parkinson unbedenklich Domperidon eingesetzt werden, als Antipsychotika kommen nur Quetiapin und Clozapin infrage. Kontraindikationen und unerwünschte Wirkungen (QT-Zeit-Verlängerung bei Domperidon, Agranulozytose bei Clozapin) müssen natürlich weiterhin beachtet werden. Dysphagie ist bei Parkinson-Patienten häufig und aufgrund der vielen Einnahmezeitpunkte besonders beschwerlich. Hier ist ein besonderes Augenmerk auf die Arzneiformen zu legen (große Kombiarzneimittel oder viele kleinere Kapseln und Tabletten). Auch müssen besondere Dosierhilfen mit entsprechend vielen Fächern pro Tag verwendet werden. Bei motorischen Problemen bei der Tablettenentnahme ist auch das Stellen in Blisterkarten oder Schlauchblistern eine mögliche Hilfe für den Patienten.
Pharmakotherapeutische Highlights auf einen Blick
- Nach gesicherter Diagnose soll die Pharmakotherapie des idiopathischen Parkinson-Syndroms möglichst zeitnah angesetzt werden, um die Lebensqualität aufrechtzuerhalten.
- Die initiale Therapie wird nicht mehr dogmatisch anhand einer konkreten Altersgrenze gewählt, sondern orientiert sich an Allgemeinzustand und Patientenwünschen.
- Bei Fluktuationen kann die Levodopa-Gabe zunächst mit einem COMT-Hemmer kombiniert werden.
- Besonderes Augenmerk soll in einem Medikationsmanagement auf die Behandlung der nicht-motorischen Parkinson-Symptome wie Schlafstörungen, Depression, Schmerz und Obstipation gelegt werden.
- Die Gesundheitskompetenz des Patienten und die Spezialisierung der Behandler sind mitentscheidend für den Therapieerfolg.
Wichtig ist auch die Behandlung der nicht-motorischen Parkinson-Symptome. Gegen Depressionen bei Parkinson können prinzipiell sowohl Tricyclica als auch SSRI eingesetzt werden.
→ Im Falle von Gerd Z. zeigt sich eine unbehandelte Depression, die weiter abzuklären ist und gegebenenfalls z. B. mit Citalopram in geriatrischer Dosierung (max. 20 mg) behandelt werden könnte.
Bei Obstipation und Parkinson ist Macrogol ausnahmsweise erstattungsfähig und kann zulasten der gesetzlichen Krankenkassen verordnet werden. Bei Schlafstörungen und nächtlicher Akinese ist zunächst auf eine ausreichende dopaminerge Versorgung während der Nacht zu achten. Über 24 Stunden wirkende Dopamin-Agonisten wie das Rotigotin TTS oder Ropinirol-Retard können dann eingesetzt werden. Ist die Versorgung mit Dopamin-Agonisten nicht mehr ausreichend, so kann gemäß Leitlinie Zopiclon zur Verordnung empfohlen werden. |
Literatur
[1] Yamawaki M, Kusumi M, Kowa H, Nakashima K. Changes in prevalence and incidence of Parkinson‘s disease in Japan during a quarter of a century. Neuroepidemiology 2009;32:263–269, doi:10.1159/000201565
[2] Rijk MC de, Launer LJ, Berger K, Breteler MM, Dartigues JF, Baldereschi M et al. Prevalence of Parkinson‘s disease in Europe: A collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group. Neurology 2000;54:21-23
[3] Campenhausen S von, Bornschein B, Wick R, Botzel K, Sampaio C, Poewe W et al. Prevalence and incidence of Parkinson‘s disease in Europe. Eur Neuropsychopharmacol 2005;15:473–4790, doi:10.1016/j.euroneuro.2005.04.007
[4] Tan LCS, Venketasubramanian N, Hong CY, Sahadevan S, Chin JJ, Krishnamoorthy ESet al. Prevalence of Parkinson disease in Singapore: Chinese vs Malays vs Indians. Neurology 2004;62:1999–2004
[5] Pringsheim T, Jette N, Frolkis A, Steeves TDL. The prevalence of Parkinson‘s disease: a systematic review and meta-analysis. Mov Disord 2014;29:1583–1590, doi:10.1002/mds.25945
[6] Reese JP, Winter Y, Balzer-Geldsetzer M, Botzel K, Eggert K, Oertel WH et al. Morbus Parkinson: Krankheitskosten einer ambulanten Patientenkohorte. Gesundheitswesen 2011;73:22–29, doi:10.1055/s-0030-1247571
[7] Lotharius J, Brundin P. Pathogenesis of Parkinson‘s disease: dopamine, vesicles and alpha-synuclein. Nat Rev Neurosci 2002;3:932–942, doi:10.1038/nrn983
[8] Steger M, Tonelli F, Ito G, Davies P, Trost M, Vetter M et al. Phosphoproteomics reveals that Parkinson‘s disease kinase LRRK2 regulates a subset of Rab GTPases. Elife 2016, doi:10.7554/eLife.12813
[9] Bonifati V. Genetics of Parkinson‘s disease-state of the art, 2013. Parkinsonism Relat Disord 2014;20(Suppl1):23-28, doi:10.1016/S1353-8020(13)70009-9
[10] Kalinderi K, Bostantjopoulou S, Fidani L. The genetic background of Parkinson‘s disease: current progress and future prospects. Acta Neurol Scand 2016;134:314–326, doi:10.1111/ane.12563
[11] Kilarski LL, Pearson JP, Newsway V, Majounie E, Knipe MDW, Misbahuddin A et al. Systematic review and UK-based study of PARK2 (parkin), PINK1, PARK7 (DJ-1) and LRRK2 in early-onset Parkinson‘s disease. Mov Disord. 2012;27:1522–1529, doi:10.1002/mds.25132
[12] Alexander GE. Biology of Parkinson‘s disease: pathogenesis and pathophysiology of a multisystem neurodegenerative disorder. Dialogues Clin Neurosci 2004;6:259–280
[13] Galvan A, Wichmann T. Pathophysiology of parkinsonism. Clin Neurophysiol. 2008;119:1459–1474, doi:10.1016/j.clinph.2008.03.017
[14] Ulusoy A, Rusconi R, Perez-Revuelta BI, Musgrove RE, Helwig M, Winzen-Reichert B, Di Monte DA. Caudo-rostral brain spreading of alpha-synuclein through vagal connections. EMBO Mol Med 2013;5:1119–1127, doi:10.1002/emmm.201302475
[15] Pichler I, Del Greco M F, Gogele M, Lill CM, Bertram L, Do CB et al. Serum iron levels and the risk of Parkinson disease: a Mendelian randomization study. PLoS Med. 2013;10:e1001462. doi:10.1371/journal.pmed.1001462
[16] Galvan A, Devergnas A, Wichmann T. Alterations in neuronal activity in basal ganglia-thalamocortical circuits in the parkinsonian state. Front Neuroanat 2015;9:5. doi:10.3389/fnana.2015.00005
[17] Wen M-C, Chan LL, Tan LCS, Tan EK. Depression, anxiety, and apathy in Parkinson‘s disease: insights from neuroimaging studies. Eur J Neurol 2016;23:1001–1019, doi:10.1111/ene.13002
[18] Clarke CE, Walker MF, Sackley CM. Physiotherapy and Occupational Therapy and Mild to Moderate Parkinson Disease-Reply. JAMA Neurol 2016;73:894–895, doi:10.1001/jamaneurol.2016.1283.
[19] Tomlinson CL, Herd CP, Clarke CE, Meek C, Patel S, Stowe R et al. Physiotherapy for Parkinson‘s disease: a comparison of techniques. Cochrane Database Syst Rev 2014:CD002815, doi:10.1002/14651858.CD002815.pub2
[20] Mestre TA, Espay AJ, Marras C, Eckman MH, Pollak P, Lang AE. Subthalamic nucleus-deep brain stimulation for early motor complications in Parkinson‘s disease-the EARLYSTIM trial: early is not always better. Mov Disord 2014;29:1751–1756, doi:10.1002/mds.26024
[21] Schuepbach WMM, Rau J, Knudsen K, Volkmann J, Krack P, Timmermann L et al. Neurostimulation for Parkinson‘s disease with early motor complications. N Engl J Med 2013;368:610–622, doi:10.1056/NEJMoa1205158
[22] Idiopathisches Parkinsonsyndrom. S3-Leitlinie der Deutschen Gesellschaft für Neurologie 2016, Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften.www.dgn.org/images/red_leitlinien/LL_2016/PDFs_Download/030010_LL_langfassung_ips_2016.pdf
[23] Gray R, Ives N, Rick C, Patel S, Gray A, Jenkinson C et al. Long-term effectiveness of dopamine agonists and monoamine oxidase B inhibitors compared with levodopa as initial treatment for Parkinson‘s disease (PD MED): a large, open-label, pragmatic randomised trial. Lancet 2014;384:1196–1205, doi:10.1016/S0140-6736(14)60683-8
[24] Eggert K, Ohlwein C, Kassubek J, Wolz M, Kupsch A, Ceballos-Baumann A et al. Influence of the nonergot dopamine agonist piribedil on vigilance in patients With Parkinson Disease and excessive daytime sleepiness (PiViCog-PD): an 11-week randomized comparison trial against pramipexole and ropinirole. Clin Neuropharmacol 2014;37:116–122, doi:10.1097/WNF.0000000000000041
[25] Goren T, Adar L, Sasson N, Weiss YM. Clinical pharmacology tyramine challenge study to determine the selectivity of the monoamine oxidase type B (MAO-B) inhibitor rasagiline. J Clin Pharmacol 2010;50:1420–1428, doi:10.1177/0091270010369674
[26] Badinter F, Amit T, Bar-Am O, Youdim MBH, Weinreb O. Beneficial behavioral, neurochemical and molecular effects of 1-(R)-aminoindan in aged mice. Neuropharmacology 2015;99:264–272, doi:10.1016/j.neuropharm.2015.05.041
[27] Parkinson Study Group. A controlled trial of rasagiline in early Parkinson disease: the TEMPO Study. Arch Neurol 2002;59:1937–1943
[28] Uitti RJ, Rajput AH, Ahlskog JE, Offord KP, Schroeder DR, Ho MM et al. Amantadine treatment is an independent predictor of improved survival in Parkinson‘s disease. Neurology 1996;46:1551–1556
[29] Pahwa R, Tanner CM, Hauser RA, Sethi K, Isaacson S, Truong D et al. Amantadine extended release for levodopa-induced dyskinesia in Parkinson‘s disease (EASED Study). Mov Disord 2015;30:788–795, doi:10.1002/mds.26159
[30] Hansen J, Lambert D. Netters Klinische Anatomie. Thieme Verlag 2006
[31] Gerlach M, Reichmann H, Riederer P, Götz W (editors). Die Parkinson-Krankheit: Grundlagen, Klinik, Therapie. 3. überarbeitete und erweiterte Auflage, Wien, Springer Verlag 2003






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.