
- DAZ.online
- DAZ / AZ
- DAZ 11/2017
- Extrapolieren hilft
Klinische Studien
Extrapolieren hilft
Durchführung klinischer Studien mit Kindern kann vereinfacht werden
Patientenpopulationen von Kindern und Jugendlichen sind aufgrund des individuellen Entwicklungsstandes und der Begleiterkrankungen heterogen, und das Einholen der Zustimmung für die Teilnahme an einer klinischen Studie ist oft schwierig. Deswegen ist die Anzahl der pädiatrischen Patienten, die in eine bestimmte klinische Studie eingeschlossen werden können, begrenzt – umso mehr, je seltener die Krankheit ist. Folglich ist es oft sehr schwierig, alle von den Behörden für die Zulassung eines Medikamentes geforderten Daten zu generieren.
Auf der anderen Seite werden in klinischen Studien für die Entwicklung und Zulassung eines Medikamentes für Erwachsene viele aussagekräftige Daten zur Wirksamkeit und Unbedenklichkeit (Sicherheit) des untersuchten Arzneimittels erhoben. Durch Extrapolationen, Modelle und Simulationen (M&S) können diese Daten für die Entwicklung des Arzneimittels in der pädiatrischen Patientengruppe genutzt werden. Dadurch sind weniger Studiendaten für die Zulassung in dieser Patientengruppe notwendig, ohne dabei Abstriche bei der Wertigkeit der Daten machen zu müssen.
Die Extrapolation von Daten bei der Entwicklung von Arzneimitteln für Kinder wird bereits genutzt [1, 2]. Voraussetzung ist, dass die betreffende Krankheit sowohl zwischen erwachsenen und pädiatrischen Patienten als auch innerhalb der pädiatrischen Altersgruppen ähnlich verläuft.
Es stehen verschiedene Datenquellen zur Verfügung. Herangezogen werden können beispielsweise Studiendaten, die an anderen Altersgruppen erhoben wurden oder bei denen ein Wirkstoff in einer anderen Indikation eingesetzt wurde. Zur Extrapolation gehören jedoch auch Annahmen, die zum Zeitpunkt der Studiendurchführung nicht immer mit Daten belegt werden können und somit eine gewisse Unsicherheit in die Vorhersagen bringen. Bei extrapolierten Daten müssen daher Abstriche in Kauf genommen werden, und daher ist diese Methode nur zulässig, wenn die für eine klinische Studie erforderliche Anzahl der Patienten nicht zur Verfügung steht und wenn die Extrapolationen wissenschaftlich vertretbar sind – und nicht das Ergebnis einer Intuition.
Die wissenschaftlich fundierte Extrapolation ist eine vielversprechende und zukunftsweisende Methode für die klinische Forschung, die aber aktuell bei der Zulassung von Arzneimitteln noch nicht hinreichend etabliert ist [3]. Das liegt vor allem daran, dass Vorhersagen von altersabhängigen Unterschieden in der Pharmakodynamik, Pharmakokinetik sowie bei der Wirksamkeit und Sicherheit eines Arzneimittels schwierig sind und derzeit nur sehr wenige allgemeingültige Regeln existieren. Der kindliche Organismus hat seine eigenen Regeln, die sich aufgrund des schnellen Wachstums, des anderen Stoffwechsels und der Entwicklung kontinuierlich ändern und auch interindividuelle Unterschiede aufweisen [4, 5].
Die europäische Zulassungsbehörde (European Medicines Agency, EMA) hat zusammen mit verschiedenen Arbeitsgruppen, die sich mit der Methodik klinischer Studien beschäftigen, ein Positionspapier erarbeitet, das den Rahmen für die Nutzung der Extrapolation in der klinischen Entwicklung vorgibt [6]. Es definiert, wann, wie und in welchem Ausmaß eine Extrapolation bei der Entwicklung und Zulassung von Arzneimitteln für pädiatrische Patienten genutzt werden kann.
Wann sind Extrapolationen möglich?
Daten zur Anwendung eines Arzneimittels bei Kindern lassen sich aus bereits durchgeführten Studien mit Erwachsenen und anderen pädiatrischen Altersgruppen unter Nutzung der richtigen Faktoren simulieren. Dadurch können verschiedene Studiendesigns für die zu beantwortende Fragestellung bei Kindern und Jugendlichen bewertet und optimiert werden. Basierend auf bereits existierenden Daten lässt sich die optimale Dosis für Kinder und Jugendliche vorhersagen und die Dosisfindungsstudie vereinfachen. Oft genügt dann eine gute Pharmakokinetik/Pharmakodynamik-Studie (PK/PD-Studie) zur Zulassung in einer Altersgruppe.
Sind bereits pädiatrische Daten vorhanden, können zu ihrer Vervollständigung Studien mit begrenzten Fallzahlen durchgeführt werden. Damit wird das wichtige ethische Prinzip bewahrt, dass möglichst wenige Kinder zusätzlichen Risiken, z. B. durch die Anwendung eines neuen Medikamentes oder zusätzliche Blutentnahmen, ausgesetzt werden sollen.
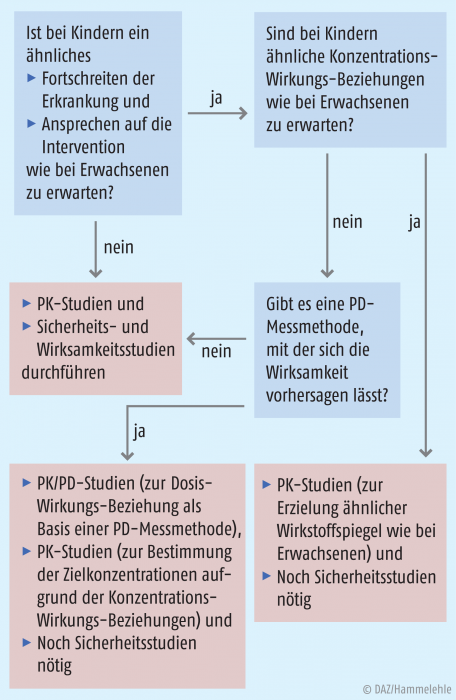
Prinzipiell kann der Wirksamkeitsnachweis eines Medikamentes nur dann von Erwachsenen auf pädiatrische Patienten übertragen werden, wenn die Krankheit bei Kindern ähnlich wie bei Erwachsenen verläuft und auch die Reaktion auf eine medikamentöse Intervention ähnlich ist. Zudem muss ein pharmakodynamischer Parameter (PD-Parameter) als Surrogat für die Wirksamkeit vorhanden sein. Nicht jeder Endpunkt aus einer Studie mit Erwachsenen lässt sich bei Kindern anwenden. Geringere kognitive und motorische Fähigkeiten lassen dies oft nicht zu.
Andererseits müssen die Behörden Faktoren wie die Machbarkeit einer klinischen Studie, ethische Bedenken und bestehende medizinische Bedürfnisse berücksichtigen, wenn es darum geht, Extrapolationen und Modelle als pivotale Evidenz für die Zulassung zu akzeptieren.
Modelle basieren auf (prä-)klinischen Daten. Die Simulation kann immer nur so gut sein wie die Daten, auf denen das Modell basiert. In die Modellierung sollten daher alle bekannten Unterschiede der Patientenpopulationen hinsichtlich Resorption, Verteilung, Metabolismus und Elimination des Wirkstoffs, Pathophysiologie, klinischer Manifestation und Fortschreiten der Erkrankung sowie bereits erhobene valide Wirksamkeits- und Sicherheitsdaten einfließen. Sobald neue Daten vorliegen, sollte das bisherige Modell entsprechend überprüft und verfeinert werden.
Somit sind Extrapolationen nur ein Hilfsmittel, wenn wesentliche Daten vorliegen, aber die Gewinnung eines vollständigen Datensatzes (Wirksamkeit und Dosisfindung in allen Altersgruppen) nicht möglich ist. Abbildung 1 gibt einen Überblick, unter welchen Voraussetzungen auf bestimmte Studien verzichtet werden kann. Obwohl es generell möglich ist, das Auftreten unerwünschter Arzneimittelwirkungen in Abhängigkeit von der Dosis oder der Wirkstoffkonzentration zu simulieren, ist eine Extrapolation von Sicherheitsdaten von Erwachsenen auf Kinder in der Regel nicht möglich, da unerwünschte Arzneimittelwirkungen altersabhängig auftreten können [7, 8].
Stufen der Extrapolation
Es gibt eine Vielzahl an Möglichkeiten, Modelle und Simulationen in der klinischen Entwicklung einzusetzen. Eine vollständige Extrapolation würde bedeuten, dass keine Daten zur Wirksamkeit, Sicherheit und Dosisfindung an Studienteilnehmern erhoben werden müssen. Dies ist bei den bekannten Unterschieden zwischen Erwachsenen und pädiatrischen Patienten in der pädiatrischen Arzneimittelentwicklung nicht möglich. Kann die Wirksamkeit sicher extrapoliert werden, sind „nur noch“ Studien zur Dosisfindung (PK/PD-Studien) und Sicherheitsdaten zur Komplementierung der Zulassungsdaten nötig. Die PD-Parameter können dann als Surrogate verwendet werden, um beispielsweise die Wirksamkeit in verschiedenen Altersgruppen zu bewerten.
Denkbar ist auch eine teilweise Extrapolation, bei der vorhandene Daten genutzt werden, um eine Reduktion der Fallzahl zu begründen oder das Signifikanzniveau zu reduzieren (Tab. 1). Einen Sonderfall stellt die Interpolation dar. Liegen beispielsweise ausreichend Daten für Säuglinge, Kleinkinder bis zwei Jahre und Jugendliche vor, können Daten für die dazwischenliegenden Altersgruppen interpoliert werden.
Definition |
Studien mit Kindern? |
Erläuterung |
|---|---|---|
vollständige Extrapolation |
PK/PD-Studien zur Dosisfindung, Erhebung von Sicherheitsdaten |
|
partielle Extrapolation |
Fallserie, Einzelfallstudie (n-of-1 trial) |
möglich, wenn verringerte statistische Teststärke akzeptiert wird |
einfache und adaptive PK-Methoden (z.B. Bayesian) |
Ausmaß der Extrapolation ist abhängig von den Vordaten und ihrer Validität |
|
|
Studien mit verringerter Teststärke/Fallzahl (diverse Altersgruppen),
Sicherheitsstudie mit zusätzlichen Wirksamkeitsendpunkten
|
möglich, wenn Wirksamkeitsdaten aus präliminaren Studien ähnliche Wirkung wie bei Erwachsenen zeigen |
|
partielle Extrapolation (FDA) bzw. keine Extrapolation (EMA) |
1 einzige klinische Studie mit Kindern in allen relevanten Altersgruppen |
randomisierte Placebo-kontrollierte Doppelblindstudie zur Wirksamkeit und Sicherheit |
keine Extrapolation |
2 vergleichende klinische Studien mit Kindern in allen relevanten Altersgruppen |
randomisierte Placebo-kontrollierte Doppelblindstudien zur Wirksamkeit und Sicherheit |
Pharmakokinetische Modelle
Physiologie-basierte pharmakokinetische (PBPK) Modelle sind mechanistische Modelle, in denen anatomische, physiologische, physische und chemische Vorgänge bei der Resorption, Verteilung, dem Metabolismus und der Elimination eines Wirkstoffes mathematisch beschrieben werden. In solche Modelle fließen beispielsweise Daten aus präklinischen Studien oder klinischen Studien mit Erwachsenen ein. Anhand des Modells lässt sich dann eine geeignete Startdosis für eine erstmalige Verabreichung an eine pädiatrischen Altersgruppe berechnen [9, 10]. Fließen zusätzlich pharmakodynamische Daten, z. B. eine unterschiedliche Rezeptorexpression oder -affinität, in das Modell ein, wird dieses als PBPK/PD-Modell bezeichnet.
Populations-basierte pharmakokinetische (PopPK) Modelle beschreiben das Ausmaß der Variabilität einer Arzneimittelkonzentration bei verschiedenen Individuen der Zielpopulation und die zugehörigen Einflussfaktoren (z. B. Alter, Gewicht, Geschlecht, Stadium der Erkrankung). Im Gegensatz zu klassischen PK-Studien, werden für PopPK-Modelle deutlich weniger Teilnehmer herangezogen. Zudem ist es möglich, mit nur wenigen Messwerten pro Patient zu arbeiten, die je nach Teilnehmer zu verschiedenen Zeitpunkten nach der Applikation des Wirkstoffes erfasst werden. Hierdurch kann die Häufigkeit von Blutentnahmen reduziert und so die Bereitschaft zu Studienteilnahme erhöht werden oder z. B. eine Studie an Neugeborenen überhaupt erst möglich werden. Auch hier ist es möglich, das Modell um pharmakodynamische Aspekte zu erweitern (PopPK/PD).
Modelle von Erkrankungen (disease models) sind mechanistische Modelle, die den natürlichen Verlauf einer Erkrankung beschreiben. Außerdem ist es möglich, den Zusammenhang zwischen klinischen Endpunkten und Dosis bzw. Wirkstoffkonzentration in eigenen Modellen zu ermitteln (response models).
Abkürzungen
EMA: European Medicines Agency
PDCO: Paediatric Committee (Ausschuss der EMA)
M&S: Modelle und Simulationen
PD: Pharmakodynamik
PK: Pharmakokinetik
PB: Physiologie-basiert
Pop: Populations-basiert
PIP: Paediatric Investigation Plan (päd. Prüfkonzept)
Extrapolationen in pädiatrischen Prüfplänen
Zwischen 2007 und 2015 wurden Extrapolationen in insgesamt 52 Entscheidungen des Pädiatrieausschusses (Paediatric Committee, PDCO) der EMA zu pädiatrischen Prüfkonzepten (Paediatric Investigation Plans, PIPs) explizit erwähnt, 47 davon bereits zwischen 2007 und 2010 [10]. Dabei stellen PopPK-Modelle mit Abstand die am häufigsten angewandte Form von M&S dar (n = 27). Am zweithäufigsten sind PopPK/PD-Modelle. Alle anderen Modelle sind nur vereinzelt vertreten. In erster Linie wird M&S in PIPs für die Dosisfindung und Dosisoptimierung eingesetzt und von den Behörden akzeptiert. Eine statistische Auswertung der EMA zeigte, dass Extrapolationen in pädiatrischen Prüfplänen die Fallzahlen reduzieren. Der Effekt ist jedoch unterschiedlich ausgeprägt und stark abhängig vom Indikationsgebiet.
Der PDCO hat nur bei der Hälfte der von ihm bewerteten PIPs, in denen eine Extrapolation angewandt wurde, diese Extrapolation als verpflichtend für die Durchführung des jeweiligen pädiatrischen Entwicklungsprogramms angesehen [10]. Dies und die Tatsache, dass der PDCO zwischen 2007 und 2015 knapp 1000 PIPs bewertet hat zeigt, dass M&S bisher nur eine geringe Rolle bei der Entwicklung von Arzneimitteln für Kinder spielt.
Typische Anwendungsgebiete
Besonders häufig sind Extrapolationen in PIPs für Arzneimittel zur Behandlung von Infektionen. Dies ist naheliegend, da der Wirkmechanismus gegen die Erreger bei Erwachsenen und Kindern identisch ist. Wenn PK-Studien zeigen, dass im Zielgewebe eine ähnliche Wirkstoffkonzentration erreicht wird, kann auf eine ähnliche Wirksamkeit geschlossen werden.
Auch bei Kombinationspräparaten kann die Wirksamkeit auf pädiatrische Patienten extrapoliert werden, wenn sowohl ausreichende Studiendaten für die Wirksamkeit der einzelnen Wirkstoffe bei Kindern als auch Studiendaten für die Wirksamkeit des Kombinationspräparates bei Erwachsenen vorliegen.
Schwierig ist eine Extrapolation hingegen bei Impfstoffen, neurologischen/psychiatrischen Erkrankungen oder allergischen Erkrankungen.
Zusammenfassung und Ausblick
M&S kann klinische Studien bei Kindern nicht völlig ersetzen. Es bietet aber die Möglichkeit, das Studiendesign zu optimieren, die Fallzahlen zu senken und bei der Dosisfindung zu helfen, solange die wissenschaftliche Ableitung schlüssig und transparent ist. Im Gegensatz zu früher, als M&S lediglich für explorative Voruntersuchungen eingesetzt wurde, wird es heute in zunehmendem Maß von den Behörden für die Zulassung von Arzneimitteln für Kinder akzeptiert. Voraussetzung ist, dass die gewählte Methode angemessen und gerechtfertigt ist. Ein früher Kontakt des Herstellers mit den Behörden und ein interdisziplinärer Austausch sind beim M&S ausdrücklich erwünscht. |
Literatur
[1] European Medicines Agency. Note for Guidance on Clinical Investigation of Medicinal Products in the Paediatric Population (CPMP/ICH/2711/99). 2001
[2] European Medicines Agency. Guideline on the Role of Pharmakokinetics in the Developement of Medicinal Products in the Paediatric Population (EMEA/CHMP/EWP/147013/2004), Corrigendum. 2006
[3] European Medicines Agency. Public workshop on extrapolation of efficacy and safety in medicine development across age group – Outcome of a multi-stakeholder meeting with experts and regulators held at EMA on Tuesday 17 May and Wednesday 18 May 2016 (EMA/478467/2016)
[4] Kearns GL, et al. Developmental pharmacology – drug disposition, action, and therapy in infants and children. N Engl J Med 2003;349:1157-67
[5] Anderson BJ, et al. Understanding dosing: children are small adults, neonates are immature children. Arch Dis Child 2013;98:737-44
[6] European Medicines Agency. Reflection paper on extrapolation of efficacy and safety in paediatric medicine development (Draft) (EMA/199678/2016). 2016
[7] Rocchi F, et al. The development of medicines for children. Pharmacol Res 2011;64:169-75
[8] Tomasi P. Paediatric Clinical Trials: Need for Capacity Building. J Clin Stud 2013;5:10-16
[9] Manolis E, et al. Proposals for model-based paediatric medicinal development within the current European Union regulatory framework. Br J Clin Pharmacol 2009;68:493-501
[10] Manolis E, et al. Role of modeling and simulation in pediatric investigation plans. Paediatr Anaesth 2011;21:214-21

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.