
- DAZ.online
- DAZ / AZ
- DAZ 1/2017
- Pharmakotherapie Gicht
Pharmakotherapie
Pharmakotherapie Gicht
Grundlagen für das Medikationsmanagement
Die Pharmakotherapie beschäftigt sich mit dem Nutzen der Medikation in der betreffenden Indikation. Wie baut man die Therapie auf, welche Optionen sind erste Wahl und wie sieht die Behandlung bei speziellen Patientengruppen aus, wie bei Komplikationen und Komorbiditäten? Dieser Artikel soll bei der Orientierung helfen und dabei unterstützen, die bestmögliche Behandlungsstrategie zu finden. Klinische Studien und Leitlinien werden vorgestellt und ihr Stellenwert in der Therapie beleuchtet. Die Pharmakotherapie ist somit die Wissenschaft für eine Patienten-orientierte Pharmazie.
Epidemiologie
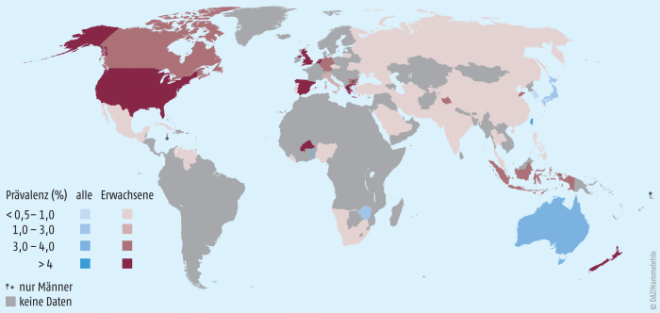
Die Prävalenz der Gicht zeigt erhebliche regionale und ethnische Unterschiede. Abbildung 1 zeigt die weltweite Prävalenz, die vor allem in den Industriestaaten und den Küstenregionen hoch ist.
Mindestens 1 bis 4% aller Erwachsenen in den Industrienationen erkranken aufgrund veränderter Ernährungs- und Lebensgewohnheiten an Gicht als Folge einer Hyperurikämie [2, 3, 4]. Männer erkranken deutlich häufiger als Frauen. Gicht ist somit die häufigste entzündliche Arthritis bei Männern mit einem altersabhängigen Anstieg.
Kasuistiken
A.S. ist ein 51-jähriger Patient mit Bluthochdruck, Hyperlipidämie und akuten starken Schmerzen im Fuß, die über Nacht aufgetreten sind. Der Patient zeigt die für einen akuten Gichtanfall typische Symptomatik mit humpelndem Gang und Schmerzen. Er gibt an, dass er in den letzten Jahren konstant an Gewicht zugenommen hat und momentan bei einer Größe von 188 cm 119 kg wiegt (BMI: 33,4). Es sei das zweite Mal, dass er solche starken Gelenkschmerzen verspüre. Auffällige Laborparameter sind: Leukozyten: 12.000/µl; BKS: 35 mm/Stunde, CRP: 11 mg/l, Harnsäure: 10,5 mg/dl. Derzeit eingenommene Arzneimittel sind: Hydrochlorothiazid (HCT) 25 mg morgens; Acetylsalicylsäure (ASS) 100 mg mittags und Simvastatin 40 mg abends. Neu verordnet worden sind Naproxen 500 mg 20 Stück, Colchicin 0,5 mg Tabletten 20 Stück und Allopurinol 100 mg 50 Stück.
B.F. ist ein übergewichtiger 78-jähriger Patient mit Bluthochdruck. Er wird mit Verdacht auf einen akuten Gichtanfall und mit akutem Nierenversagen in die Ambulanz eines Krankenhauses eingewiesen. Seit der letzten Woche wird sein Bluthochdruck mit HCT 25 mg 1-0-0 behandelt. Er berichtet, dass er gestern auf dem Schützenfest seines Dorfes gefeiert hat und sehr viel Alkohol konsumiert habe.
Laborwerte: Na: 145 mmol/l, Kalium: 3,6 mmol/l, Harnsäure: 11,5 mg/dl, Harnstoff: 40 mg/dl, Serum-Creatinin: 3,0 mg/dl, Glucose: 105 mg/dl, Gesamtcholesterol: 180 mg/dl, HDL-Cholesterol: 50 mg/dl, LDL-Cholesterol: 92 mg/dl, Triglyceride: 190 mg/dl, Leukozyten: 12.800/µl
Im folgenden Text sind für die konkreten Fallbeispiele wichtige Informationen mit → markiert.
Ätiologie und Pathophysiologie
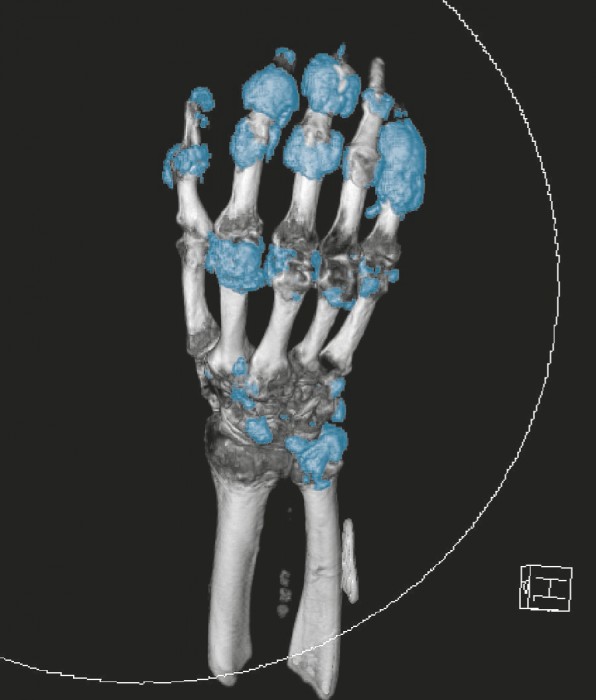
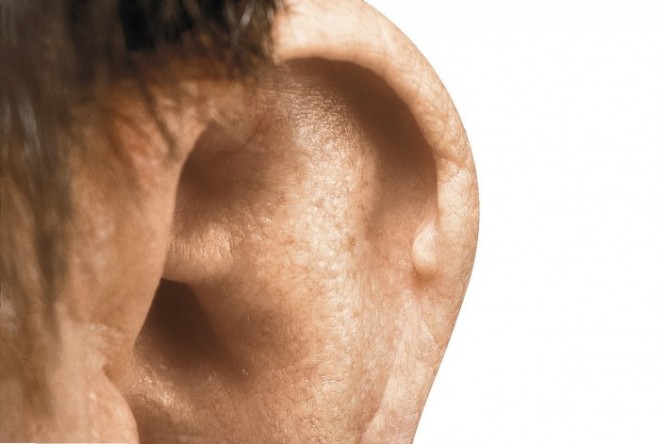
Harnsäure ist das Endprodukt des Purin-Stoffwechsels, erhöhte Harnsäure-Werte entstehen entweder durch eine verminderte renale Exkretion der Harnsäure, durch die vermehrte Zufuhr an Purinen aus der Nahrung oder durch den endogenen Abbau körpereigener Zellen. Ein erhöhter Harnsäure-Wert (sogenannte Hyperurikämie) liegt ab einem Wert von 6,5 mg/dl vor. Ab dieser Konzentration übersättigt die Harnsäure. Sie übersteigt ihre Löslichkeit in Plasmawasser bei 37°C und einem pH-Wert von 7,4 und kann auskristallisieren. Die Präzipitation dieser Kristalle erfolgt bevorzugt peri- oder intraartikulär, allerdings können sie sich auch in anderen Geweben ablagern und klinisch als Tophi tast- und sichtbar werden (Abb. 2 und Abb. 3). Diese Kristalle werden von der unspezifischen Immunabwehr als fremd erkannt. Durch Phagozytose von Monozyten/Makrophagen [5] im Gelenk und Freisetzung von inflammatorischen Mediatoren wie Zytokinen (Interleukin [IL] 1β, IL-6, TNFα, IL-8 und Granulozyten-Kolonie-stimulierenden Faktor [G-CSF]) kommt es zu einem akuten Gichtanfall. Auslöser sind vor allem rasche Änderungen des Harnsäure-Spiegels. Dies kann z. B. durch eine Erhöhung nach einem purinreichen Essen, nach Alkoholkonsum sowie nach einer Hungerkur oder durch eine Erniedrigung der Harnsäure-Konzentration zu Beginn einer harnsäuresenkenden Therapie ausgelöst werden. Abgelagerte Urat-Kristalle verursachen somit eine entzündliche Reaktion des Immunsystems und sind ursächlich für einen akuten Gichtanfall. Ist die Hyperurikämie durch eine renale Ausscheidungsschwäche für Harnsäure oder einen angeborenen Enzymdefekt bedingt, spricht man auch von primärer Hyperurikämie. Eine sekundäre Hyperurikämie liegt bei Erkrankungen außerhalb des Purin-Stoffwechsels vor, wie z. B. bei einer Niereninsuffizienz, Polycythemia vera oder bestimmten Formen von Leukämie. Eine sekundäre Hyperurikämie kann auch durch bestimmte Arzneimittel hervorgerufen werden (s. Kasten „Arzneimittel, die Hyperurikämie und Gicht hervorrufen können“) [6]. Nicht alle Patienten mit erhöhtem Urat-Spiegel entwickeln eine Gicht.
Arzneimittel, die Hyperurikämie und Gicht hervorrufen können
- Diuretika (Schleifendiuretika und Thiazide)
- Nicotinsäure
- Salicylate (ASS in niedriger Dosis)
- Pyrazinamid
- Levodopa
- Ethambutol
- zytotoxische Arzneimittel
- Ciclosporin
Schleifendiuretika und Thiazide sollten nur mit strenger Indikationsstellung und Überwachung der Serum-Harnsäurespiegel eingesetzt werden.
Es gibt vermehrt Hinweise, dass die asymptomatische Hyperurikämie mit einer erhöhten kardiovaskulären Morbidität und Mortalität einhergeht und somit einen unabhängigen kardiovaskulären Risikofaktor darstellt. Studien belegen, dass eine Erhöhung der Serum-Harnsäure um 1 mg/dl das Risiko, einen Diabetes mellitus zu entwickeln, um 20% erhöht [7]. Durch die subklinische Harnsäure-Ablagerung kann es bereits im asymptomatischen Stadium zur Aktivierung proinflammatorischer Zytokine und somit zur Auslösung von Arteriosklerose kommen.
Weiterhin gibt es Hinweise, dass erhöhte Harnsäure-Werte über eine gesteigerte Aktivität der Xanthinoxidase zu vermehrtem oxidativen Stress, Abnahme von NO, vaskulären Inflammationsprozessen und Verschlechterung der Nierenfunktion führen kann [8]. Es wurde in Untersuchungen gezeigt, dass durch die medikamentöse Senkung des Harnsäure-Spiegels kardiovaskuläre Risiken günstig beeinflusst wurden [9, 10] und das Auftreten eines Herzinfarktes durch eine Medikation mit z. B. Allopurinol signifikant vermindert werden konnte [11]. Diese Daten betonen den Bedarf für größere randomisierte Interventionsstudien, die den Einfluss einer harnsäuresenkenden Therapie auf das kardiovaskuläre wie auch renale Risiko untersuchen.
Symptome und klinische Präsentation
Gicht präsentiert sich in drei klinischen Stadien. Das erste Stadium wird als asymptomatische Hyperurikämie bezeichnet. Im zweiten Stadium der Erkrankung manifestiert sich die Gichtarthritis, es kommt zur Bildung von Kristallen meist in peripheren Gelenken der unteren Extremitäten und somit zu periodischen Gichtanfällen. Die dadurch entstandene akute Arthritis beginnt oft während der Nacht und beinhaltet hochakute Schmerzen, Überwärmung, Rötung und Schwellung. Das am häufigsten initial betroffene Gelenk ist das Großzehengrundgelenk, in der Häufigkeit folgen Mittelfuß, Sprunggelenk mit Achillessehne und Knie. Der Anfall klingt meist nach einigen Tagen wieder ab und symptomfreie Phasen von unterschiedlicher Dauer schließen sich an. Beim Auftreten erneuter Gichtanfälle kann sich sowohl die zeitliche Dynamik als auch die Schmerzqualität verändern. Die Intervalle werden kürzer und es können auch andere Gelenke betroffen sein. Diese Anfälle werden meist nicht mehr als so schmerzhaft erlebt, wie der erste Anfall. Zumeist dauern die entzündlichen Episoden länger an und sind nicht mehr selbstlimitierend.
Dieses Stadium kann nach Jahren in das dritte klinische Stadium übergehen. Es entsteht eine chronische, manchmal tophische Gicht (Abb. 3), die auch durch wiederkehrende Schübe gekennzeichnet ist und sich in einer polyartikulären Arthritis mit Destruktionen niederschlägt. 10 bis 20% der Patienten haben Nierensteine (Urat- oder Oxalat-Nephrolithiasis) [12].
Diagnostik
Die beschriebenen Symptome des akuten Gichtanfalls zählen zu den diagnostischen Kriterien. Diagnostisch näher eingrenzen kann man die Gicht durch den Nachweis von nadelförmigen, stark negativ doppelbrechenden Urat-Kristallen in der Synovialflüssigkeit oder im Tophus, die sowohl während des akuten Anfalls als auch im symptomfreien Intervall vorliegen.
Als wichtigste Differenzialdiagnose einer akuten Monoarthritis muss eine septische Arthritis ausgeschlossen werden. Der Serum-Harnsäurespiegel ist kein eindeutiges Merkmal, da er im akuten Anfall auch erniedrigt sein kann (< 6 mg/dl).
→ Patient A.S. präsentiert sich wiederholt mit den typischen starken Schmerzen, die über Nacht aufgetreten sind. Der Harnsäure-Wert liegt bei 10,5 mg/dl. Sein ACR/EULAR-Score liegt bei 10. Somit bestätigt sich die Diagnose Gichtarthritis.
→ Bei Patient B.F. bestätigt sich die Diagnose durch eine Untersuchung der Synovialflüssigkeit aus dem betroffenen Gelenk mit Nachweis der typischen Urat-Kristalle. Ein weiteres Scoring kann somit entfallen.
Bildgebende Verfahren
In der Bildgebung können bei der klassischen Röntgenaufnahme nur knöcherne Veränderungen sichtbar gemacht werden, die im späten Krankheitsverlauf auftreten. Tophi lassen sich computertomografisch wie auch sonografisch darstellen. Die Dual-Energy-CT (DECT) ist in der Lage, mit unterschiedlichen CT-Röhrenspannungen zu arbeiten und somit eine Sensitivität und Spezifität von jeweils nahe 90% zu erreichen. Mit dieser Methode sind auch subklinische Tophi detektierbar (Abb. 2).
Score
Als Diagnosehilfestellung können auch die ACR/EULAR-Kriterien eingesetzt werden (Tab. 1), um die Wahrscheinlichkeit für eine Gichtarthritis abzuschätzen. Werte größer gleich 8 Punkte gelten als sichere Diagnose für eine Gichtarthritis. Online ist eine Berechnungshilfe unter www.goutclassificationcalculator.auckland.ac.nz verfügbar.
Vorgehen |
Kriterien |
Kategorien |
|---|---|---|
Schritt 1 |
Eingangskriterium |
mindestens eine Episode mit Schwellung, Schmerz, oder schmerzhafter Spannung in einem peripheren Gelenk oder Schleimbeutel |
Schritt 2 |
ausreichendes Kriterium
Bei Vorliegen dieses Kriteriums kann die weitere Klassifikation (Schritt 3) entfallen.
|
Vorliegen von Urat-Kristallen in einem befallenen Gelenk oder Schleimbeutel (z. B. in der Synovialflüssigkeit) oder Vorliegen von Tophi |
Schritt 3 |
Wenn kein ausreichendes Kriterium vorliegt, werden weitere Kriterien beurteilt und mit einem Punktescore bewertet. Ein Score ≥ 8 bestätigt eine Gichtarthritis. |
Beurteilung des klinischen Bildes (betroffene Gelenke, Verlauf und Charakteristika der symptomatischen Episoden), Laborparameter (Serum-Harnsäurespiegel) und Bildgebung (computertomografisch oder sonografisch) |
Gesamttherapie
Nicht-pharmakotherapeutische Interventionen wie Schulung des Patienten zu Ernährung, Gewichtsreduktion und Lebensstil sind gerade mit Blick auch auf das mögliche kardiovaskuläre Risiko die Basis der Therapie einer Hyperurikämie.
Schulungsinhalte sollten purinarme Diät (Verzicht auf Innereien, fructosehaltige Softdrinks, Bier, Alkohol, sparsamer Konsum von Hülsenfrüchten), Gewichtsreduktion bei Adipositas, notwendige Trinkmenge, sportliche Aktivitäten mit moderatem Ausdauertraining zwei- bis dreimal pro Woche und das Wissen über die Vermeidung hyperurikämisch wirkender Medikamente beinhalten. Weiterhin sollte der Patient individuell anhand der patientenspezifischen Auslösefaktoren und Komorbiditäten über die Aspekte seiner Gichterkrankung informiert werden. Dies beinhaltet die Genese und den Verlauf der Erkrankung sowie die Notwendigkeit der Therapie und der Therapietreue. Das Therapieziel, einen Harnsäure-Wert im Serum < 6 mg/dl (< 360 μmol/l) zu erreichen, gilt es im Gespräch mit dem Patienten zu verdeutlichen.
Fructose – gefährlich bei Gicht?!
Übermäßiger Fructose-Konsum gilt aufgrund der spezifischen Verstoffwechselung von Fructose als Risikofaktor für Gicht. Durch den übermäßigen Verzehr von Fructose kommt es zum verstärkten Purin-Abbau und somit zu einem Harnsäure-Anstieg. Dies betrifft Lebensmittel, die mit Saccharose (Disaccharid aus Glucose und Fructose, „Haushaltszucker“) oder Fructose gesüßt worden sind (auch Fruchtschorlen) oder denen Glucose-Fructose-Sirup (high fructose corn syrup) zugesetzt worden ist [14].
Pharmakotherapeutische Therapieprinzipien
Unterschieden werden muss zwischen der symptomatischen antientzündlichen Behandlung des akuten Anfalls und der kausalen langfristigen Therapie der Hyperurikämie inklusive der zugrundeliegenden metabolischen Störungen.
Die systematische Erfassung von Komorbiditäten und kardiovaskulären Risikofaktoren wie Nierenfunktionsstörungen, koronare Herzkrankheit (KHK), Herzinsuffizienz, periphere arterielle Verschlusskrankheit (pAVK), Übergewicht, Hyperlipidämie, Bluthochdruck, Diabetes und Erfassung des Raucherstatus sind bei Patienten mit Hyperurikämie und Gicht besonders wichtig.
→ Patient B.F.: Risikofaktoren, die zu dem akuten Gichtanfall geführt haben, sind: männliches Geschlecht, Bluthochdruck, akutes Nierenversagen, Dehydratation aufgrund des hohen Alkoholkonsums und Übergewicht. Weiterhin kann Hydrochlorothiazid den Harnsäure-Spiegel im Serum erhöhen und somit einen akuten Anfall auslösen.
Neue Leitlinie veröffentlicht
Seit August 2016 existiert nun auch von der Deutschen Gesellschaft für Rheumatologie (DGRh) eine evidenzbasierte S2e-Leitlinie zur Gichtarthritis für Deutschland [15].
Die europäischen Empfehlungen der European League Against Rheumatism (EULAR) zum Management der Gicht wurden im Juli 2016 aktualisiert [16].
Die amerikanischen Leitlinien wurden zuletzt 2012 vom American College of Rheumatology herausgegeben [17, 18]. Weiterhin hat die Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) eine S1-Handlungsempfehlung zur akuten und zur chronischen Gicht in 2013 herausgebracht [19, 20].
Klinische Pharmakotherapie
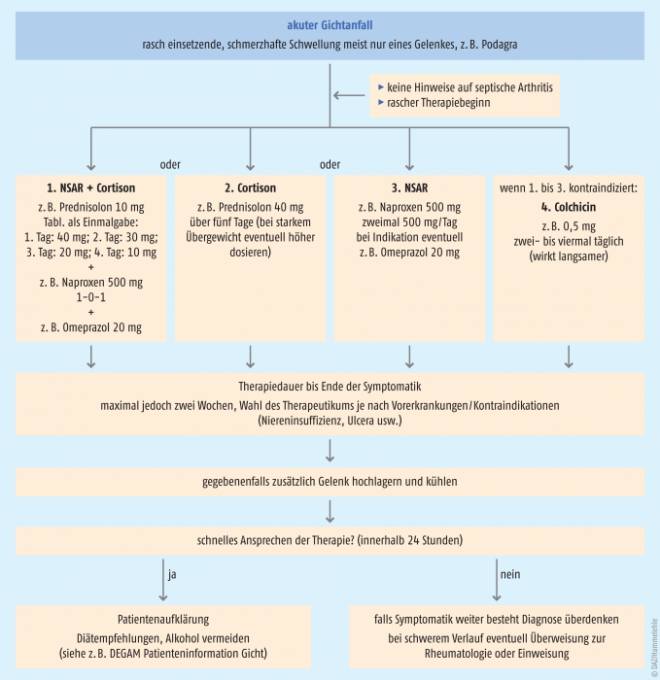
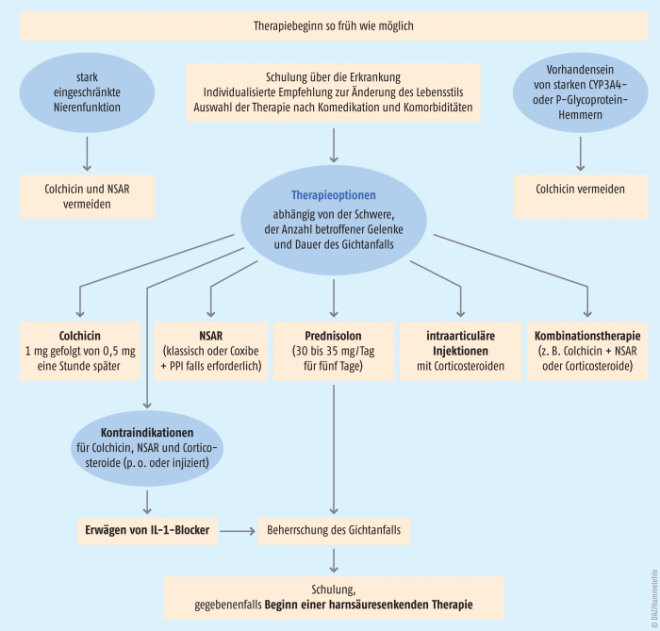
Management des akuten Gichtanfalls
Primäres Ziel bei einem akuten Gichtanfall ist die Behandlung der starken Schmerzen und der auftretenden Entzündungsreaktion. Die lokale Applikation von Kälte und die Ruhigstellung und Entlastung des Gelenkes sollte dem Patienten empfohlen werden. Die Behandlung des akuten Anfalls sollte so schnell wie möglich initiiert werden. Die Therapie muss bis einige Tage nach Abklingen der akuten Symptomatik fortgeführt werden. Zur Auswahl stehen nicht-steroidale Antirheumatika, COX-2-Hemmer, Corticosteroide und Colchicin. Laut EULAR-Empfehlungen gelten Colchicin, NSAR/Coxibe und Glucocorticoide als gleichwertige Alternativen. Welche Therapie eingesetzt wird, hängt vom Schweregrad, vorherigen Ansprechen auf die pharmakologische Therapie, sowie von den Begleiterkrankungen, Risikofaktoren und Interaktionen mit der Begleitmedikation ab. Neue pharmakologische Ansätze wie Interleukin-1β-Antikörper werden bei bestimmten Komorbiditäten oder Kontraindikationen eingesetzt. Ungeeignete Analgetika sind Metamizol und Paracetamol, da diese Arzneimittel keine antiphlogistische Wirkung besitzen, sowie Acetylsalicylsäure (ASS), da sie die Ausscheidung von Harnsäure hemmt. Weiterhin wird empfohlen, eine gegebenenfalls bestehende Therapie zur Senkung des Harnsäure-Spiegels während des akuten Gichtanfalls ohne Unterbrechung weiterzuführen.
→ Pharmakotherapeutische Ziele für Patient A.S. und B.F.
- schnelle Symptomlinderung des akuten Gichtanfalls
- weiteren Gichtanfällen vorbeugen durch Senkung des Serum-Harnsäurewerts unter 6 mg/dl. Bei kompliziertem Verlauf, unzureichendem symptomatischen Ansprechen oder chronischer Gicht sogar unter 5 mg/dl.
- Optimierung der Bluthochdrucktherapie
- für Patient B.F. zusätzlich: Behandlung des akuten Nierenversagens
Nicht-steroidale Antirheumatika
Aufgrund ihres schnellen Wirkeintritts haben nicht-steroidale Antirheumatika (NSAR) einen hohen Stellenwert in der Therapie des akuten Anfalls. Mehrere Vergleichsstudien zwischen den einzelnen NSAR belegen, dass die verschiedenen Wirkstoffe ähnlich wirksam sind [21, 22, 23]. Naproxen reduzierte im gleichen Ausmaß die Schmerzen wie Prednisolon [24]. Der Einsatz von NSAR ist bei Patienten mit gastrointestinalen Erkrankungen, Herzinsuffizienz, Niereninsuffizienz und koronarer Herzerkrankung von den jeweiligen Risiken abhängig zu machen. Anfänglich werden die NSAR (gegebenenfalls in Kombination mit einem PPI) bis zur Tageshöchstdosis eingesetzt. Diese Dosierung wird für die Dauer der Entzündungssymptomatik – in der Regel zwei bis drei Tage – beibehalten und mit einer reduzierten Erhaltungsdosis für bis zu sechs Monate fortgeführt (Tabelle 2). Der zur Behandlung des akuten Gichtanfalls zugelassene selektive COX-2-Hemmer Etoricoxib kann bei Patienten mit gastrointestinalen Kontraindikationen oder NSAR-Unverträglichkeit eingesetzt werden.
Wirkstoff |
Dosierung |
|---|---|
Indometacin |
p. o. initial zwei- bis dreimal 25 mg/Tag gegebenenfalls Dosissteigerung auf zwei- bis dreimal 50 mg/Tag, Erhaltungsdosis: 25 bis 50 mg/Tag, rektal 100 mg alle vier bis sechs Stunden |
Ibuprofen |
maximale Tagesdosis: 2400 mg |
Naproxen |
maximale Tagesdosis: 1250 mg |
Diclofenac |
maximale Tagesdosis: 150 mg, Erhaltungsdosis: 25 bis 50 mg/Tag |
Acemetacin |
maximale Tagesdosis 180 mg |
Etoricoxib |
120 mg/Tag p. o. für maximal acht Tage |
Colchicin
Colchicin ist auch in der Lage, den akuten Gichtanfall effektiv zu stoppen, wenn es in den ersten zwölf Stunden eingenommen wird. Allerdings kommt es unter Colchicin häufig zu Magen-Darm-Beschwerden mit heftigen Durchfällen, sodass die deutsche Leitlinie wie auch die EULAR den Hinweis gibt, niedrigere Dosierungen als zuvor (und in den Fachinformationen der Präparate ausgewiesen), einzusetzen (Tabelle 3). In einer multizentrischen, doppelblinden, placebokontrollierten, randomisierten Studie wurde die Applikation niedriger Colchicin-Dosierung (1,8 mg in einer Stunde) mit hohen Dosierungen (4,8 mg in sechs Stunden) und Placebo in der Behandlung des akuten Gichtanfalls verglichen [25]. Angelehnt an diese Studie gilt folgende Empfehlung:
Dosierung: Möglichst in den ersten zwölf Stunden nach Auftreten der ersten Symptome sollte 1 mg Colchicin und nach einer Stunde nochmals 0,5 mg eingenommen werden. Ist der Gichtanfall damit nicht ausreichend kontrolliert, kann bei nicht relevant eingeschränkter Nierenfunktion (eGFR > 60 ml/min) Colchicin zwei- bis dreimal 0,5 mg täglich über einige Tage weiter eingesetzt werden.
Colchicum-Dosis |
|||
|---|---|---|---|
hoch |
niedrig |
Placebo |
|
Nebenwirkungen insgesamt |
77% |
37% |
27% |
gastrointestinale Nebenwirkungen |
77% |
19% |
12% |
Diarrhö |
77% |
23% |
14% |
Übelkeit |
17% |
4% |
5% |
→ Die Beratung über die Einnahme des Colchicins bei Patient A.S. sollte entsprechend nicht nach Packungsbeilage erfolgen. Nach Absprache mit dem verordnenden Arzt sollte als loading dose 1 mg Colchicin und nach 1 Stunde weitere 0,5 mg eingenommen werden.
Eine Anwendung von Colchicin bei Niereninsuffizienz sollte nur nach sorgfältiger Nutzen-Risiko-Abwägung unter besonders engmaschiger Kontrolle der Nierenfunktion durchgeführt werden. Die EULAR-Leitlinie gibt die Empfehlung, Colchicin ab einer eGFR < 30 ml/Minute nicht mehr anzuwenden.
Bei gleichzeitiger Anwendung eines starken CYP3A4-Hemmers oder P-Glycoprotein-Hemmers wie Clarithromycin, Erythromycin, Telithromycin, Fluconazol, Ketoconazol, Itraconazol, Indinavir, Nelfinavir, Ritonavir, Saquinavir, Aprepitant oder Verapamil und bei Verzehr von Grapefruitsaft ist Colchicin kontraindiziert.
Corticosteroide
Bei Komorbiditäten oder Kontraindikationen gegen NSAR oder Colchicin können Corticosteroide intraartikulär und/oder systemisch, aber auch i.m. oder i.v. angewendet werden. Laut der EULAR-Empfehlung, die auf Daten von zwei randomisierten Studien fußt, wird die Gabe von Prednisolon 30 mg bis 35 mg täglich p.o. über fünf Tage empfohlen. Die DEGAM empfiehlt den Einsatz von Prednisolon mit 40 mg/Tag für fünf Tage oder in Kombination mit NSAR wie Naproxen, wenn keine Kontraindikationen bestehen: 1. Tag Prednisolon 40 mg, 2. Tag 30 mg, 3. Tag 20 mg, 4. Tag 10 mg plus Naproxen 500 mg 1-0-1. Ein Protonenpumpen-Inhibitor wie Omeprazol (20 mg) sollte bei der gleichzeitigen Gabe von Prednisolon und NSAR eingesetzt werden.
Relative oder absolute Kontraindikationen beim akuten Gichtanfall
- chronische Nierenerkrankungen: NSAR, COX-2-Hemmer, Colchicin
- chronische Herzinsuffizienz: NSAR, COX-2-Hemmer, Corticosteroide
- Gerinnungshemmer/Thrombozytenaggregationshemmer: NSAR
- Magen/Darmgeschwüre: NSAR, COX-2-Hemmer, Corticosteroide
- Diabetes: Corticosteroide
- Infektionen/Risiko für Infektionen: Corticosteroide, Interleukin-1β-Antikörper
- Lebererkrankungen: NSAR, COX-2-Hemmer, Colchicin
Interleukin-1β-Antikörper
Bei Patienten mit häufigen Gichtanfällen (mit mindestens drei Anfällen in den vorangegangenen zwölf Monaten) bei denen NSAR und Colchicin kontraindiziert sind, nicht vertragen werden oder keine ausreichende Wirkung zeigen und für die wiederholte Behandlungszyklen mit Corticosteroiden nicht infrage kommen, kann der noch extrem teure Einsatz von Interleukin-1β-Antikörper wie Canakinumab oder Anakinra (off label bei Gicht) infrage kommen. Die empfohlene Dosis von Canakinumab ist 150 mg und wird während eines Anfalls als Einzeldosis subkutan verabreicht. Eine gleichzeitig bestehende, auch latente Infektion muss vor der Gabe von Canakinumab ausgeschlossen werden. Rilonacept ist als weiterer IL-1-Antagonist bei Patienten mit Gicht in mehreren Studien erfolgreich getestet worden, hat aber in Deutschland keine Zulassung erhalten.
→ Die aktuellen Laborwerte von B.F. zeigen ein akutes Nierenversagen, daher sollte sowohl Colchicin als auch NSAR zur Therapie des akuten Gichtanfalls vermieden werden. Therapie der ersten Wahl bei B.F. ist ein systemisches oder intraartikuläres Corticosteroid. Eine mögliche systemische Corticosteroid-Therapie ist Prednisolon 40 mg/Tag für fünf Tage. Eine intraartikuläre Injektion mit Triamcinolonacetonid 10 mg könnte alternativ in Betracht gezogen werden.
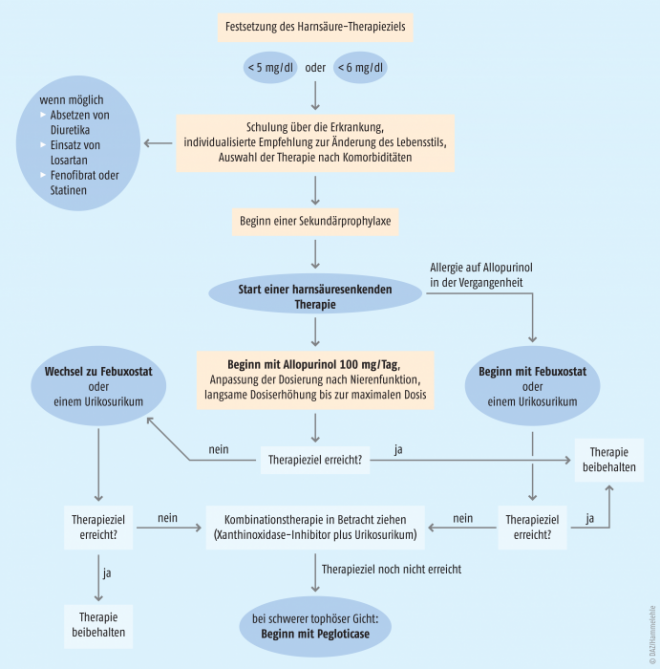
Sekundärprophylaxe durch Senkung des Harnsäure-Spiegels
Wann sollte man mit der harnsäuresenkenden Therapie beginnen?
Die deutsche Leitlinie empfiehlt eine Einleitung einer harnsäuresenkenden Therapie, wenn mindestens ein bis zwei Gichtanfälle in der Vergangenheit aufgetreten sind oder bereits eine chronische Arthritis vorliegt. Da ein erster Gichtanfall aber bereits Folge einer chronischen Ablagerung von Harnsäure-Kristallen ist, wird nach den aktuellen EULAR-Empfehlungen eine harnsäuresenkende Therapie bereits nach dem ersten sicheren Gichtanfall empfohlen. Weiterhin wird empfohlen eine harnsäuresenkende Therapie auch bei einer Hyperurikämie bei eingeschränkter Nierenfunktion (eGFR < 90 ml/Minute) mit Gichtanfällen in der Vorgeschichte zu beginnen.
Bisher wurde empfohlen, die harnsäuresenkende Therapie erst nach Abklingen des akuten Anfalls zu beginnen. Eine kontrollierte Studie zeigte, dass der Therapiebeginn mit Allopurinol auch während eines Gichtanfalls unter antiinflammatorischer Medikation unverzüglich eingeleitet werden kann [27]. Das birgt den Vorteil der Adhärenzsteigerung, da die prophylaktische Therapie direkt begonnen werden kann und somit nicht in Vergessenheit gerät.
→ Patient A.S. kann daher direkt mit der Einnahme von Allopurinol 100 mg einmal täglich beginnen und sollte damit nicht warten, bis der Gichtanfall vorüber ist. Wahlweise kann eine Anfallsprophylaxe mit niedrigdosiertem Naproxen (plus PPI) oder Colchicin bis zu sechs Monate fortgeführt werden.
Xanthinoxidase-Inhibitoren
Laut Leitlinie der Deutschen Gesellschaft für Rheumatologie sind die Urikostatika Allopurinol oder Febuxostat die Medikamente der ersten Wahl zur Senkung der Harnsäure.
→ Patient A.S. sollte ausführlich über mögliche Nebenwirkungen von Allopurinol (Hautausschläge, gastrointestinale Nebenwirkungen) informiert werden.
Allopurinol
hemmt die Harnsäure-Synthese und ist die am häufigsten verschriebene harnsäuresenkende Therapie in einer Dosierung von 100 bis 300 mg täglich. Zugelassen ist eine Tageshöchstdosis von bis zu 800 mg. Die Behandlung sollte mit einer niedrigen Dosierung (100 mg/Tag) begonnen werden und nach zwei bis vier Wochen um 100 mg erhöht werden bis das Ziel der Harnsäure-Senkung erreicht ist. Die Dosis muss bei Patienten mit renaler Insuffizienz angepasst werden (Tab. 4 und 5). In seltenen Fällen können schwere Hautreaktionen wie Überempfindlichkeitssyndrom (DRESS), Stevens-Johnson-Syndrom (SJS) und toxisch epidermale Nekrolyse (TEN) unter der Therapie mit Allopurinol auftreten. Das Risiko des Auftretens steigt erheblich bei einer begleitenden Niereninsuffizienz. Bei ersten Anzeichen soll die Behandlung mit Allopurinol beendet werden und darf nicht erneut begonnen werden.
Creatinin-Clearance [ml / Minute] |
Dosis Allopurinol |
|---|---|
0 |
100 mg alle drei Tage |
10 |
100 mg alle zwei Tage |
20 |
100 mg/Tag |
40 |
150 mg/Tag |
60 |
200 mg/Tag |
80 |
250 mg/Tag |
100 |
300 mg/Tag |
120 |
350 mg/Tag |
Creatinin-Clearance [ml / Minute] |
Tagesdosis Allopurinol |
|---|---|
über 20 |
Standarddosis |
10 bis 20 |
100 bis 200 mg |
unter 10 |
100 mg oder größere Intervalle |
Febuxostat
ist eine Substanz, die selektiv die Xanthinoxidase hemmt. In der FACT-Studie [28] senkte Febuxostat die Harnsäure bei Gichtpatienten stärker als Allopurinol. Es hat verglichen mit Allopurinol ein etwas günstigeres Wirkungs-Nebenwirkungs-Profil. Anders als bei Allopurinol ist eine Dosisanpassung bei milder bis moderater Nierenfunktionseinschränkung mit einer Creatinin-Clearance von 30 bis 80 ml/Minute nicht erforderlich. Weiterhin sind unter Febuxostat deutlich weniger Arzneimittel-Interaktionen zu erwarten. Die empfohlene Dosis beträgt 80 mg oder 120 mg einmal täglich. Febuxostat ist eine gute Option, wenn Allopurinol nicht vertragen wird, wenn der Harnsäure-Zielwert unter Allopurinol nicht erreicht wird oder wenn die Nierenfunktion eingeschränkt ist (Tab. 4 und 5).
→ Bei Patient B.F. sollte nach Besserung des akuten Nierenversagens eine Therapie mit Febuxostat begonnen werden.
Um die Gefahr einer schweren Myelosuppression zu vermeiden dürfen sowohl Allopurinol als auch Febuxostat nicht mit Azathioprin und Mercaptopurin eingenommen werden, da durch die Hemmung der Xanthinoxidase dessen Abbau verhindert wird. Nur wenn Urikostatika nicht eingesetzt werden können oder den Harnsäure-Spiegel nicht ausreichend senken, sollten Urikosurika eingesetzt werden.
Urikosurika
Die Therapie mit Benzbromaron ist nur zweite Wahl, wenn eine Behandlung mit Allopurinol bei Kontraindikationen, Unverträglichkeit, Überempfindlichkeit oder fehlender Wirksamkeit nicht möglich ist. Während eines akuten Gichtanfalls darf die Therapie mit Benzbromaron nicht begonnen werden. Besonders bei hohen Harnsäure-Werten muss die Substanz einschleichend dosiert werden, um eine akute Urat-Nephropathie zu vermeiden.
Benzbromaron darf nicht angewendet werden bei eingeschränkter Nierenfunktion, Patienten mit Lebererkrankungen, Urat-Nephropathie, Nephrolithiasis, primärer Hyperurikämie mit Harnsäure-Überproduktion und bei sekundärer Hyperurikämie als Folge hämatologischer Erkrankungen.
Vor Beginn der Therapie und auch währenddessen müssen die Leberenzyme regelmäßig kontrolliert werden. Die Patienten sollen über die Bedeutung einer ausreichenden Trinkmenge (> 2 l/Tag) aufgeklärt werden.
Probenecid wird bei Unverträglichkeiten von Benzbromaron und/oder Allopurinol eingesetzt. Kontraindikationen bestehen bei Nephrolithiasis und Niereninsuffizienz, sowie bei einem akuten Gichtanfall. Die Dosierung beträgt in der ersten Woche zweimal 250 mg/Tag, danach zweimal 500 mg/Tag p.o.
Neue Ansätze
Urikolytika
Das Enzym Uricase (Vorkommen in Nichtprimaten) ist in der Lage, durch Umwandlung der Harnsäure in das besser wasserlösliche Allantoin den Harnsäure-Spiegel zu senken. Pegloticase (pegylierte rekombinante Uricase) und Rasburicase (rekombinante Uratoxidase) sind Urikolytika, die zur Anwendung kommen können. Pegloticase (Krystexxa®) steht als Reservemedikament für Patienten mit schwer verlaufender chronischer Gicht mit Bildung von Gichtknoten zur Verfügung, die auf Höchstdosen der Xanthinoxidase-Inhibitoren nicht ausreichend ansprechen oder bei denen diese Arzneimittel kontraindiziert sind. In den Zulassungsstudien zeigte sich allerdings, dass es gehäuft zu anaphylaktischen Infusionsreaktionen kam sowie neutralisierende Antikörper gebildet wurden, was zum Wirkverlust der Substanz führte [29]. In Deutschland wird dieses Medikament derzeit nicht vertrieben, kann aber importiert werden.
→ Bei Patient B.F. muss die Behandlung des Bluthochdrucks an die aktuelle Situation und somit an die akute Niereninsuffizienz angepasst werden. Sobald sich die Nierenfunktion wieder normalisiert hat, wäre Losartan ein ideales Antihypertonikum, da es neben der Blutdruckkontrolle auch Serum-Harnsäurewerte reduzieren kann.
Rasburicase (Fasturtec®) ist zugelassen zur Behandlung und Prophylaxe einer akuten Hyperurikämie, um ein akutes Nierenversagen nach einer Chemotherapie zu verhindern.
Lesinurad (Zurampic®) ist ein neuer Wirkstoff, der Anfang 2016 zugelassen wurde und die Wiederaufnahme von Harnsäure aus dem Primärharn hemmt. Lesinurad wird zusammen mit Allopurinol oder Febuxostat gegeben, wenn deren Wirkung allein nicht ausreicht. Zur Zeit ist es allerdings noch nicht auf dem deutschen Markt erhältlich. Laut der Firma Grünenthal soll es 2017 auf den Markt gebracht werden.
Arhalofenat hemmt einen renalen Harnsäure-Transporter namens URAT1 SUA durch die Blockierung der Reabsorption von Harnsäure in den proximalen Tubuli der Niere. Es befindet sich noch in der klinischen Entwicklung und wirkt harnsäuresenkend und antientzündlich. In Studien senkte es signifikant den Harnsäure-Wert und die Anfallshäufigkeit [30].
Pharmakotherapeutische Highlights auf einen Blick
- Eine gute Aufklärung über die Gicht, ihre Therapieoptionen und regelmäßige Kontrollen – auch der Harnsäure-Werte – fördern die Therapieadhärenz.
- Akute Gichtanfälle sollten so früh wie möglich therapiert werden. Bei der Auswahl der Medikation sollten Kontraindikationen und Komorbiditäten berücksichtigt werden.
- In der Erst-Linien-Therapie wird Colchicin mit einer Startdosis von 1 mg, gefolgt von 0,5 mg nach einer Stunde und/oder ein NSAR (gegebenenfalls plus PPI) eingesetzt. Orale Corticosteroide (30 mg bis 40 mg Prednisolon-Äquivalent) für drei bis fünf Tage oder als intraartikuläre Injektion sind eine Alternative.
- Colchicin und NSAR sollten nicht bei Patienten mit stark eingeschränkter Nierenfunktion eingesetzt werden.
- Bei Kontraindikationen gegen die genannten Therapien und weiterhin ungenügender Symptomkontrolle ist die einmalige subkutane Gabe von 150 mg Canakinumab eine Therapieoption.
- Eine harnsäuresenkende Therapie ist laut deutscher Leitlinie indiziert, wenn mindestens ein bis zwei Gichtanfälle aufgetreten sind oder bereits eine chronische Arthritis vorliegt. Tophi sowie Nierensteine in der Anamnese sind ebenfalls Indikationen. Darüber hinaus wird eine solche Behandlung auch dann empfohlen, wenn anamnestisch Gichtanfälle auftraten und eine Hyperurikämie bei eingeschränkter Nierenfunktion vorliegt. Die aktuell überarbeitete EULAR-Leitlinie rät zu einer harnsäuresenkenden Therapie bereits nach dem ersten Gichtanfall.
- Bei Beginn einer harnsäuresenkenden Therapie kann eine Anfallsprophylaxe mit niedrig dosiertem Colchicin (0,5 bis 1 mg/Tag) oder begleitend ein NSAR für bis zu sechs Monate erwogen werden (EULAR-Empfehlung). Cave: Niere und Interaktionspotenzial.
- Therapieziel einer harnsäuresenkenden Therapie ist ein Harnsäure-Wert < 6 mg/dl. Bei kompliziertem Verlauf, unzureichendem symptomatischen Ansprechen oder chronischer Gicht kann auch eine Senkung unter 5 mg/dl sinnvoll sein.
- Bei der harnsäuresenkenden Therapie handelt es sich um eine Dauertherapie, die bei Patienten ohne Tophi über wenigstens fünf Jahre, bei Patienten mit Tophi bis zum Auflösen aller Tophi und dann weitere fünf Jahre erfolgen sollte. Bei Beschwerdefreiheit und normalen Harnsäure-Werten kann die Therapie auch ausgesetzt werden.
- Bei Patienten mit Gicht und einem Schleifendiuretikum oder Thiazid im Medikationsregime sollte – wenn möglich – das Diuretikum abgesetzt werden. Zur Therapie der Hypertonie sollte Losartan oder ein Calcium-Kanal-Blocker gewählt werden.
Erweitertes Medikationsmanagement und AMTS
Tipps zum Umsetzen auf Station und in der Offizin
Viele Patienten brechen die Einnahme der Tabletten nach einiger Zeit wieder ab, daher hat die Gicht-spezifische Aufklärung und engmaschige pharmazeutische Betreuung bei einer harnsäuresenkenden Therapie einen hohen Stellenwert. Adhärenzprobleme können den Harnsäure-Zielwert nach Erreichen wieder ansteigen lassen, wenn das Verständnis für die Einnahme der Medikation fehlt.
Therapie-Tipps aus der MTM-Praxis
Schließen Sie sich mit den verordnenden Ärzten aus Ihrem Netzwerk kurz und erfragen Sie, welche Dosisempfehlungen bei der Verordnung von Colchicin oder NSAR gegeben werden sollten. Weiterhin wissenswert wäre es, ob es in Ihrem Netzwerk üblich ist, bei einer Erstverordnung von Allopurinol neben dem Titrieren der Harnsäure-Senkung eine prophylaktische Komedikation von Colchicin oder eine niedrige Dosis eines NSAR über mehrere Wochen zu geben, um einen erneuten Gichtanfall durch Schwankung der Harnsäure-Homöostase zu verhindern. |
Literatur
[1] Mikuls TR, Farrar JT, Bilker WB et al. Gout epidemiology: results from the UK General Practice Research Database, 1990–1999. Ann Rheum Dis 2005;64:267–272
[2] Annemans L, Spaepen E, Gaskin M. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005. Ann Rheum Dis 2008;67(7):960–966
[3] Roddy E, Doherty M. Epidemiology of gout. Arthritis Res Ther 2010;12(6):223
[4] Kuo CF et al. Global epidemiology of gout: prevalence, incidence and risk factors. NatRev Rheumatol 2015;11(11):649-662
[5] Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Gout-associated uric acid crystals activate theNALP3 inflammasome. Nature 2006;440(7081):237–241
[6] Gresser U. Gicht. In: Zeidler H, Zacher J, Hiepe F (Hrsg). Interdisziplinäre Klinische Rheumatologie. Springer, Heidelberg 2001:698–710
[7] Bhole V, Choi JW, Kim SW et al. Serum uric acid and the risk of type 2 diabetes: a prospective study. Am J Med 2010;123:957–961
[8] Levy GD, Rashid N, Niu F et al. Effect of urate lowering therapies on renal progression in patients with hyperuricemia. J Rheumatol 2014;41:955–962
[9] Noman A, Ang DS, Ogston S et al. Effect of high-dose allopurinol on exercise in patients with chronic stable angina: a randomised, placebocontrolled crossover trial. Lancet 2010;375:2161–2167
[10] Sezai A, Soma M,Nakata K et al. Comparison of febuxostat and allopurinol for hyperuricemia in cardiac surgery patients (NU-FLASH Trail). Circ J 2013;77:2043–2049
[11] Wei L, Mackenzie IS, Chen Y et al. Impact of allopurinol use on urate concentration and cardiovascular outcome. Br J Clin Pharmacol 2011;71:600–607
[13] Janssens HJ et al. A diagnostic rule for acute gouty arthritis in primary care without joint fluid analysis. Arch Intern Med 2010:170(13):1120-1126
[14] Choi HK, Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospektive cohort study. Br Med J 2008;336:309-312
[15] Kiltz U, Alten R, Fleck M et al. Langfassung zur S2e-Leitlinie Gichtarthritis (fachärztlich): Evidenzbasierte Leitlinie der Deutschen Gesellschaft für Rheumatologie (DGRh). Zeitschr Rheumatol 2016;75(S2):11–60
[16] Richette P, Doherty M, Pascual E. updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 25. Juli 2016,. pii: annrheumdis-2016-20970
[17] Khanna D, Fitzgerald JD, Khanna PP et al. American College of Rheumatology guidelines for management of gout. Part 1: Systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia. Arthritis Care & Research 2012;64(10):1431–1446
[18] Khanna D, Fitzgerald JD, Khanna PP et al. American College of Rheumatology guidelines for management of gout. Part 2: Therapy and Antiinflammatory Prophylaxis of Acute Gouty Arthritis. Arthritis Care & Research 2012;64(10):1447–1461
[19] Engel B, Prautzsch H. Akute Gicht in der hausärztlichen Versorgung. S1 Leitlinie. 09/2013 einsehbar unter: www.degam-leitlinien.de, Zugriff 6. Dezember 2016
[20] Engel B, Prautzsch H. Gicht: Häufige Gichtanfälle und Chronische Gicht in der hausärztlichen Versorgung. S1-Leitlinie, 09/2013 einsehbar unter: www.degam-leitlinien.de, abgerufen 6. Dezember 2016
[21] Altman RD et al. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study. J Rheumatol 1988;15(9):1422-1426
[22] Maccagno A, Di Giorgio E, Romanowicz A. Effectiveness of etodolac (‚Lodine‘) compared with naproxen in patients with acute gout. Curr Med Res Opin 1991;12(7):423-429
[23] Rubin BR et al. Efficacy and safety profile of treatment with etoricoxib 120 mg once daily compared with indomethacin 50 mg three times daily in acute gout: a randomized controlled trial. Arthritis Rheum 2004;50(2):598-606
[24] Janssens HJ et al. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial. Lancet 2008;371(9627):1854-1860
[25] Terkeltaub RA et al. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study. Arthritis Rheum2010;62(4):1060-1068
[26] Wechalekar MD, Vinik O, Moi JH et al. The efficacy and safety of treatments for acute gout: Results from a series of systematic literature reviews including Cochrane reviews on intraarticular glucocorticoids, colchicine, nonsteroidal antiinflammatory drugs, and interleukin-1-inhibitors. J Rheumatol Suppl 2014;92:15–25
[27] Shoji A, Yamanaka H, Kamatani N. A retrospective study of the relationship between serum urate level and recurrent attacks of gouty arthritis: evidence for reduction of recurrent gouty arthritis with antihyperuricemic therapy. Arthritis Rheum 2004;51(3):321-325
[28] Becker MA et al. Febuxostat versus Allopurinol Controlled Trial (FACT). N Engl J Med 2005;353:2450-2461
[29] Sundy JS, Baraf HS, Yood RA et al. Efficacy and tolerability of pegloticase for the treatment of chronic gout in psatients refractory to conventional treatment: two randomized controlled trials. JAMA 2011;306(7):711–720
[30] Steinberg ACH, Choi YJ, Martin R et al. Study to evaluate the efficacy and safety of arhalofenate for preventing flares and reducing serum uric acid in gout patients. Arthritis Rheum 2015;67(suppl10)
[31] Neogi T, Jansen A, Dalbeth N et al. Gout Classification Criteria 2015: An American College of Rheumatology/European League Against Rheumatism Collaborative Initiative. Ann Rheum Dis 2015;74(10):1789-1798
























4 Kommentare
Gicht
von Thomas Christmann am 07.01.2017 um 12:29 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Gicht
von Ina Richling am 09.01.2017 um 9:27 Uhr
Allopurinol Einnahme während akutem Gichtanfall literturstelle 27
von Thomas Christmann am 06.01.2017 um 16:58 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Allopurinol Einnahme während akutem
von Ina Richling am 07.01.2017 um 10:07 Uhr
Das Kommentieren ist aktuell nicht möglich.