
- DAZ.online
- DAZ / AZ
- DAZ 8/2016
- Vorsorge kann Leben ...
Medizin
Vorsorge kann Leben retten
Gutartige Vorstufen früh erkennen und entfernen – der beste Schutz vor Darmkrebs
Unter dem übergeordneten Begriff der kolorektalen Karzinome werden die Malignome des gesamten Kolons und des Rektums zusammengefasst. Laut Union internationale contre le cancer (UICC) gilt als Rektumkarzinom ein maligner Tumor, dessen Unterrand höchstens 16 cm von der Anokutanlinie (Ende des Analkanals) entfernt ist. Was jenseits davon bis hin zur Ileozökalklappe (Übergang vom Dünndarm zum Blinddarm) lokalisiert ist, gilt als Kolonkarzinom.
Im internationalen Vergleich der Neuerkrankungsraten für Darmkrebs liegt Deutschland mit an der Spitze, im Gegensatz etwa zu Griechenland mit deutlich niedrigeren Zahlen. Allerdings geht hierzulande seit 2008 nicht nur die Zahl der Neuerkrankungen leicht zurück, sondern auch die Mortalität. Im Jahr 2016 werden laut Schätzung der deutschen epidemiologischen Krebsregister und des Zentrums für Krebsregisterdaten im Robert Koch-Institut 33.400 Männer und 27.600 Frauen an einem kolorektalen Karzinom erkranken.
Vorläuferläsionen
Meist entwickelt sich das kolorektale Karzinom aus Adenomen, die man als gutartige Vorstufen oder (nach neueren Erkenntnissen) eher als Vorläuferläsionen bewerten kann. Der Begriff Adenom bezeichnet benigne epitheliale Neoplasien, die drüsenähnlich wachsen, sowie Neoplasien, die von Drüsengewebe abstammen, wie etwa das Schilddrüsen- oder Hypophysenadenom. Im Magen-Darm-Trakt treten sie meistens in Form von Polypen auf. Darmpolypen sind Schleimhautvorwölbungen in das Lumen des Kolons, deren Pathologie und Prognose von ihrer Histologie abhängig sind:
- entzündliche Polypen: in der Regel gutartige Gebilde bei chronisch entzündlichen Darmerkrankungen oder auch postoperativ;
- hyperplastische Polypen: meist harmlose Gewebsvermehrung aufgrund einer lokalen Proliferation normal großer Zellen (Durchmesser in der Regel < 5 mm);
- Hamartome: in der Regel angeborener, sehr selten entartender, tumorartiger Bereich aus ungeordneten, fehlerhaft differenzierten Zellen innerhalb eines normalen Organgewebes;
- Adenome: Vorläuferläsionen, aus denen sich nach unterschiedlichen Zeitabständen – mehrere Monate bis Jahre – infiltrierende und potenziell metastasierende Karzinome entwickeln können. Um das Karzinomrisiko zu betonen, wird heute statt der Bezeichnungen „atypisch“ oder „dysplastisch“ der Begriff „intraepitheliale Neoplasie“ (IEN) bevorzugt.
Adenom-Karzinom-Sequenz
Nahezu drei Viertel aller Dickdarmadenome sind distal im Rektum und Sigma (Rektosigmoid) lokalisiert, in Richtung Ileozökalklappe nimmt ihre Häufigkeit ab. Je nach Architektur lassen sich tubuläre (schlauchförmige), villöse (breitbasig-zottenreiche) oder tubulo-villöse Adenome unterscheiden. Hierbei zeigen die villösen Adenome mit zehn bis 20 Prozent zwar die geringste Häufigkeit, dafür jedoch die höchste Entartungsfrequenz.
Wird ein Adenom nicht entfernt, proliferieren seine Zellen weiter; im Schnitt vergrößern Adenome ihr Volumen innerhalb von zwei Jahren um etwas mehr als die Hälfte. Für den progredienten Entartungsvorgang wurde aufgrund nachgewiesener molekularbiologischer Veränderungen im Jahr 1975 die sogenannte Adenom-Karzinom-Sequenz postuliert:
- Hierbei betrifft die initiale Mutation das Gen APC (von „adenomatöse Polyposis coli“), das ein Tumor-Suppressorprotein kodiert. Folge ist die unkontrollierte Proliferation von Enterozyten in der Darmschleimhaut.
- Darauf kommt es zu Mutationen des Tumor-Suppressorgens TP53 und des Onkogens KRAS. Das Protein K-ras (von „Kirsten rat sarcoma“) ist als zentrales Element in einer Reihe von Signaltransduktionswegen für die Proliferation maligner Tumoren entscheidend.
Serratierte Karzinogenese
Etwa 60 Prozent der kolorektalen Karzinome entwickeln sich gemäß der Adenom-Karzinom-Sequenz. Aufgrund weiterer morphologischer sowie molekularbiologischer Befunde stellte sich in den letzten Jahren heraus, dass hier noch weitere Ätiogenesen bestehen wie die serratierte („sägezahnartige“) Karzinogenese. Dabei wurden zwei neue Entitäten definiert:
- Beim sessilen serratierten Adenom (SSA) handelt es sich um einen flachen („sessilen“), kaum über das Schleimhautniveau erhabenen Tumor, der endoskopisch meist schwer zu erkennen ist. Er tritt meist im rechtsseitigen (aufsteigenden) Kolon auf. Molekularbiologisch dominiert die BRAF-Mutation. Diese führt zu einer überschießenden Signaltransduktion durch das Protein B-raf (von „rapidly accelerated fibrosarcoma“), was – wie etwa beim malignen Melanom – zur karzinomatösen Entartung führen kann.
- Dagegen sind traditionell serratierte Adenome (TSA), die polypenartig in das Darmlumen hineinragen, überwiegend im linksseitigen Kolon (absteigendes Kolon und Sigma) und im Rektum lokalisiert. Molekulargenetisch zeigt sich eine hohe Frequenz an KRAS-Mutationen.
Darüber hinaus besteht noch ein Mischtyp, der die Charakteristika beider Ätiogenesen vereint, nachdem als Vorläuferläsion entweder das TSA oder das weiter oben genannte villöse Adenom vorausgegangen war. Neben der vorherrschenden KRAS-Mutation liegen auch APC- und TP53-Mutationen vor. Zudem gibt es hyperplastische Polypen (Ø > 1 cm), die zu einem hohen Prozentsatz KRAS- oder BRAF-Mutationen aufweisen und sich in etwa 20 Prozent der Fälle zu einem Karzinom entwickeln können.
Genetische Ursachen
Darmkrebs entsteht in der überwiegenden Mehrzahl der Fälle sporadisch, d. h. durch erworbene Genmutationen in den Zellen der Darmschleimhaut. Für fünf bis zehn Prozent lässt sich jedoch eine hereditäre Genese nachweisen. So erhöhen kolorektale Karzinome in der Familienanamnese das Erkrankungsrisiko: bei Verwandten ersten Grades um zehn Prozent (Alter des betroffenen Angehörigen über 60 Jahre) bzw. um 30 Prozent (Alter unter 60 Jahre). Auch an die Möglichkeit hereditärer Polyposis-Syndrome sollte gedacht werden:
- Bei der familiären adenomatösen Polyposis coli (FAP) können in Kolon und Rektum über 100 Adenome wachsen, sie gilt daher als Präkanzerose mit hohem Entartungsrisiko. Ursache ist eine erblich bedingte Mutation im APC-Gen.
- Demgegenüber beruht das Lynch-Syndrom (hereditäres nicht-polypöses Kolonkarzinom-Syndrom = HNPCC) nicht auf einer Adenom-Karzinom-Sequenz. Die Ursache liegt in Mutationen verschiedener DNA-Reparaturgene. Das Risiko für andere Karzinome ist ebenfalls erhöht, vor allem für Endometrium-, Ovarial-, Blasen- und Magenkarzinome.
Risikofaktoren
Darüber hinaus gibt es sowohl endogene als auch exogene Risikofaktoren, die die Entstehung eines kolorektalen Karzinoms fördern können.
- So erhöhen chronisch entzündliche Darmerkrankungen das Darmkrebsrisiko, vor allem Colitis ulcerosa, seltener Morbus Crohn.
- Auch Übergewicht (Body-Mass-Index > 25 kg/m2, vergrößerter Bauchumfang) geht mit einem bis zu zweifach erhöhten Darmkrebsrisiko einher. Männer sind stärker betroffen als Frauen. Welcher Faktor hierbei ausschlaggebend ist, wird noch diskutiert: veränderte Hormonspiegel, die erhöhte Kalorienaufnahme oder die mangelnde körperliche Aktivität.
- Zwischen einem hohen Alkoholkonsum und der Entwicklung eines kolorektalen Karzinoms besteht ebenfalls eine positive Korrelation, insbesondere bei Personen mit geringer Folsäure- und/oder Methioninaufnahme. Eine Metaanalyse zeigte, dass bereits 100 g Alkohol pro Woche (entspricht ca. 1 l Wein oder 2,5 – 3 l Bier) das Risiko um rund 15 Prozent erhöhen.
- Auch eine ballaststoffarme Ernährung mit einem hohen Anteil von rotem Fleisch (Rind, Kalb, Schwein und Lamm) gilt als Risikofaktor (vermehrte Bildung von Nitrosoverbindungen und Gallensäuren). Vor allem verarbeitetes Fleisch (Wurst, Schinken, Leberkäse u. a.) und gegrilltes Fleisch korrelierten in Studien immer wieder mit einem signifikant erhöhten Risiko. Allerdings gibt es auch Untersuchungen, in denen keine Korrelation zwischen Ernährungsfaktoren und Darmkrebs nachgewiesen werden konnte.
- Rauchen geht nachgewiesenermaßen mit einem zweifach erhöhten Risiko für Kolonadenome und somit auch mit einem erhöhten Risiko für kolorektale Karzinome einher.
Metastasen vor allem in der Leber
Darmkrebs kann grundsätzlich jeden Abschnitt des Dickdarms und des Enddarms betreffen. In rund 60 Prozent der Fälle allerdings wächst der Tumor in den unteren 40 cm des Kolons und im Rektum. Für eine (im Idealfall kurative) Operation benötigt der Chirurg exakte Angaben zur Lokalisation (v. a. Lagebeziehung zum Schließmuskel) und zum Stadium (Tumor-Staging gemäß TNM: Tumorgröße, Lymphknotenstatus („nodes“) und Fernmetastasen). Nachfolgend eine vereinfachte Stadieneinteilung:
- Stadium I und II: Primärtumor, kein Lymphknotenbefall, keine Fernmetastasen;
- Stadium III: Primärtumor und Lymphknotenbefall, keine Fernmetastasen;
- Stadium IV: Primärtumor, Lymphknotenbefall und Fernmetastasen.
Hämatogen metastasiert das kolorektale Karzinom bevorzugt in die Leber und die Lunge. Die meisten Patienten entwickeln Lebermetastasen, bei etwa jedem Vierten bestehen diese bereits zum Zeitpunkt der Darmkrebsdiagnose. Die lymphogene Ausbreitung vor allem des Rektumkarzinoms folgt drei „Metastasenstraßen“:
1. in Richtung paraaortale Lymphknoten,
2. zusätzlich in Richtung Beckenwand und
3. zusätzlich in Richtung Leistenlymphknoten.
Alarmzeichen: veränderte Stuhlgewohnheiten
Charakteristische Frühsymptome fehlen! Blut im Stuhl zeigt sich am häufigsten beim Rektumkarzinom, jedoch nur bei etwa einem Sechstel der rechtsseitigen Kolonkarzinome. Alarmzeichen sind plötzliche Änderungen der Stuhlgewohnheiten, zumal bei Personen über 40 Jahre, konstant „üble“ Windgerüche und das Symptom des „falschen Freundes“ (Flatus mit ungewolltem Stuhlabgang). Neben Allgemeinsymptomen wie Leistungsknick, Gewichtsabnahme und Anämie stützt vor allem eine Ileuskomplikation den Verdacht auf ein fortgeschrittenes Karzinom.
Symptome aufgrund von Metastasen sind Ikterus und Leberinsuffizienz bei fortgeschrittenem Leberbefall sowie Husten und Dyspnoe bei pulmonalem und/oder pleuralem Befall; seltener sind Skelettmetastasen (Knochenschmerzen) und zerebrale Metastasen (neurologische Symptome).
Stuhlbluttest – Test auf okkultes Blut
Gemäß den derzeitigen, bis Ende 2016 gültigen deutschen Leitlinien sollten Personen mit durchschnittlichem Risiko (keine Familienanamnese für kolorektales Adenom oder Karzinom) ab dem 50. Lebensjahr die Angebote zur Früherkennung von Darmkrebs wahrnehmen. Personen, die jegliche endoskopische Untersuchungen ablehnen, sollten jährlich einen Test auf fäkales okkultes Blut (FOBT) durchführen lassen. Allerdings erfordert ein positives Ergebnis dann in jedem Fall eine sofortige Koloskopie.
Herkömmliche Stuhlbluttests verwenden mit Guajakharz imprägniertes Filterpapier, das sich in Anwesenheit von im Stuhl enthaltenem Hämoglobin (Hb) nach Zugabe von Wasserstoffperoxid blau färbt. Immunologische Stuhlbluttests (iFOBT) detektieren Hb sowie den Hämoglobin-Haptoglobin-Komplex (Hb-Hp) in einer gelösten Stuhlprobe mithilfe mono- bzw. polyklonaler Antikörper. Da ihre Qualität recht unterschiedlich ist, wird ein genereller Einsatz von iFOBT nicht empfohlen. Laut Leitlinie sollen lediglich iFOBT mit nachgewiesen hoher Spezifität (> 90%) und Sensitivität alternativ zum Guajaktest eingesetzt werden.
Auch genetische Tests sind noch umstritten. Einerseits zeigte eine Methode, die neben okkultem Blut auch darmkrebsspezifische DNA-Veränderungen (z. B. KRAS-Mutationen) nachweist, eine höhere Sensitivität als ein kommerziell erhältlicher iFOBT. Andererseits sprechen hohe Kosten und eine komplizierte Durchführung gegen eine breite Anwendung genetischer Tests.
Koloskopie ist überlegenes Screeningverfahren
Von allen Maßnahmen zur Früherkennung kolorektaler Karzinome und Adenome besitzt die komplette Koloskopie („große Darmspiegelung“, s. Kasten) die höchste Sensitivität und Spezifität. Sie wird aber erst ab dem 55. Lebensjahr von der GKV erstattet. Dies sind ihre entscheidenden Vorteile:
Mit ihr lassen sich auch nicht blutende Adenome und Karzinome nachweisen (im Gegensatz zum FOBT).
Bei der Koloskopie kann der Arzt therapeutisch eingreifen: Durch die Abtragung eines oder mehrerer Adenome in derselben Sitzung kann er die Entstehung eines Karzinoms verhindern.
Komplette Koloskopie – meist mit Narkose
Vor der Koloskopie sind eine 12- bis 24-stündige Nahrungskarenz und „gründliches Abführen“, meist mit einem Macrogol- und Natriumsulfat-haltigen Präparat, obligat. Inzwischen werden in Deutschland bis zu 85 Prozent der Endoskopiepatienten sediert, meist mit dem kurz und rasch wirksamen Injektionsanästhetikum Propofol. Nicht selten wird die Koloskopie hierbei mit einer Ösophagogastroskopie kombiniert.
Nach einer ebenfalls obligaten digitalen Untersuchung des Rektums wird das flexible (Video-)Endoskop unter Sicht vorgeschoben, bis es das Zäkum oder sogar das terminale Ileum erreicht hat. Beim Rückzug des Instruments wird der Darm mittels Luftinsufflation zur Entfaltung gebracht und die gesamte Darmwandstruktur inspiziert und nach krankhaften Veränderungen abgesucht.
Im Schnitt dauert die Koloskopie 25 bis 30 Minuten. Da die Wirkdauer des Propofols infolge rascher Metabolisierung und Ausscheidung mit 4 – 6 Minuten relativ kurz ist, muss die Wirkung durch wiederholte Bolusapplikationen aufrechterhalten werden. Problematisch hierbei ist die geringe therapeutische Breite des Propofols. Wenn es überdosiert oder zu schnell injiziert wird, droht ein Atemstillstand (und Blutdruckabfall). Richtwerte für die Titration zur Narkoseeinleitung bei ansonsten Gesunden sind 20 – 40 mg Propofol alle 10 Sekunden.
Von Vorteil (vor allem im ambulanten Einsatz) ist die gute Verträglichkeit. So zeigte etwa eine Studie am Fahrsimulator, dass Patienten nach alleiniger Propofol-Sedierung deutlich „wacher“ waren als Patienten, die eine Kombination von Pethidin und Midazolam erhalten hatten. Zu beachten ist, dass Propofol keine analgetische Wirkung hat.
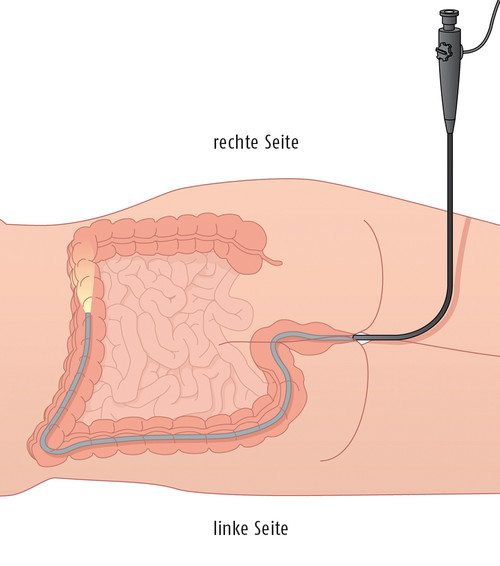
Die Sigmoidoskopie („kleine Darmspiegelung“; Abb. 1) ist ebenfalls effektiv. Da sie sich auf die unteren Darmabschnitte, die am häufigsten betroffenen sind, beschränkt, ist hier ein flankierender FOBT obligat.
Gemäß den Leitlinien sollte eine komplette Koloskopie mit unauffälligem Befund nach zehn Jahren wiederholt werden.
Abb. 1: Befunde einer Sigmoidoskopie („kleine Darmspiegelung“), von links: glatte gesunde Darmschleimhaut, gestielter Darmpolyp (wird bei der Koloskopie entfernt), Karzinom. Quelle: Felix-Burda-Stiftung
Positive Bilanz in Deutschland
Daten des Deutschen Krebsforschungszentrums (DKFZ) zeigen den Nutzen der Vorsorge-Koloskopie. So wurden im ersten Jahrzehnt seit ihrer Einführung im Jahr 2002
- rund 180.000 Vorläuferläsionen entdeckt und entfernt und
- mehr als 40.000 Fälle eines kolorektalen Karzinoms in einem so frühen Stadium diagnostiziert, dass noch reelle Heilungschancen bestanden.
Darüber hinaus konnte das DKFZ anhand einer Studie mit rund 5000 Darmkrebspatienten und fast 5000 Kontrollpersonen zeigen, dass das Risiko, innerhalb von zehn Jahren nach einer kompletten Koloskopie an einem kolorektalen Karzinom zu erkranken, um rund 90 Prozent niedriger ist als bei Personen, die keine Vorsorge-Koloskopie in Anspruch genommen hatten.
Mindestalter für Darmkrebs-Screening senken
Dass dennoch ein Restrisiko verbleibt, zeigte beispielsweise eine 2014 veröffentlichte amerikanische Studie: Von 2659 Karzinomen wurden 159 (knapp 6%) erst fünf Jahre nach der Vorsorge-Koloskopie entdeckt, wobei allerdings offenbleiben muss, ob sie sich in diesem kurzen Zeitraum gebildet hatten oder ob ihre Vorstufen bei der vorherigen Koloskopie übersehen worden waren.
Seit Anfang der 1990er-Jahre scheint die Zahl der Darmkrebserkrankungen bei Personen unter 50 Jahre jährlich um 1,5 Prozent zuzunehmen, auch wenn der Altersgipfel weiterhin bei etwa 69 Jahren liegt. Unter Bezug auf Krebsregisterdaten aus Frankreich und Amerika empfiehlt der Bundesverband Niedergelassener Gastroenterologen Deutschlands daher, mit dem Darmkrebs-Screening schon „in einem deutlich früheren Lebensalter“ zu beginnen.
Prävention mit ASS?
Im Hinblick auf eine mögliche Prävention des kolorektalen Karzinoms durch Arzneimittel ist die Datenlage nach wie vor kontrovers. In teils randomisierten Studien konnte mit Acetylsalicylsäure in Tagesdosen bis zu 300 mg sowie mit COX-2-Inhibitoren wie Celecoxib und Rofecoxib das (Rezidiv-)Risiko eines kolorektalen Karzinoms gesenkt werden. Allerdings erhöhte sich gleichzeitig das Risiko für gastrointestinale Blutungen unter ASS und für kardiovaskuläre Ereignisse unter COX-2-Hemmern. Daher empfehlen die deutschen Leitlinien keine Primärprophylaxe mit ASS oder COX‑2-Hemmern, auch nicht mit Statinen. Allerdings machte im September 2015 die U.S. Preventive Services Task Force einen neuen Vorstoß, in dem sie für Personen zwischen 50 und 59 Jahren ohne erhöhtes Blutungsrisiko eine Prävention mit Low-dose-ASS anregt.
Viel Bewegung, Obst und Gemüse
Abgesehen vom Darmkrebs-Screening nennen die Leitlinien mehrere Faktoren, die – zumindest statistisch – das Risiko eines kolorektalen Karzinoms verringern helfen. Eine zentrale Rolle spielt hierbei der Lebensstil. Die Empfehlungen lauten, nicht zu rauchen, sich regelmäßig (täglich 30 – 60 min) körperlich zu bewegen sowie ein Übergewicht abzubauen. In prospektiven Kohortenstudien zeigten Personen mit höherem körperlichem Aktivitätsgrad ein um bis zu 30 Prozent geringeres Karzinomrisiko.
Trotz widersprüchlicher Resultate in großen Beobachtungsstudien wird für die Empfehlungen zur Ernährung zumindest ein „Konsens“ formuliert. Eine spezifische Diätempfehlung zur Risikoreduktion wird derzeit nicht gegeben. Einigkeit besteht jedoch darin, dass rotes oder verarbeitetes Fleisch nur in geringen Mengen bzw. nicht täglich konsumiert werden sollte. Da eine inverse Korrelation zwischen Ballaststoffaufnahme und Karzinomrisiko nachgewiesen werden konnte, wird zu einer ballaststoffreichen Ernährung von mindestens 30 g/Tag geraten.
Überraschenderweise war ein erhöhter Verzehr von Obst und Gemüse nur mit einem um sechs bis neun Prozent geringeren Karzinomrisiko verbunden. Unklar ist auch, welche Pflanzenbestandteile hier einen nachweisbar protektiven Effekt haben könnten. Dennoch empfehlen Experten eine obst- und gemüsereiche Ernährung, da hierdurch – nicht zuletzt im Hinblick auf das metabolische Syndrom – das allgemeine Erkrankungsrisiko wahrscheinlich gesenkt wird. |
Literatur
[1] S3-Leitlinie Kolorektales Karzinom. Version 1.1 – August 2014. AWMF-Registernummer: 021/007OL
[2] Polypen des Kolons. In: Herold G und Mitarbeiter. Innere Medizin, 2014:486-488
[3] Kolorektales Karzinom. In: Herold G und Mitarbeiter. Innere Medizin, 2014:488-493
[4] Tannapfel A, Neid M, Aust D, Baretton G. Entstehung kolorektaler Karzinome. Unterschiedliche Wege und Vorstufen – differenzierte Nomenklatur. Dtsch Arztebl Int 2010;107(43):760-766
[5] Vieth M, Langner C. (K)Eine Verwirrung um serratierte Kolonpolypen. J Gastroenterol Hepatol Erkr 2010;8(4):7-12
[6] Imperiale TF, et al. Multitarget Stool DNA Testing for Colorectal-Cancer Screening. N Engl J Med 2014;370:1287-1297
[7] Wirksam und sicher – Bewertung der ersten zehn Jahre Darmspiegelung in der Krebsvorsorge. www.dkfz.de/de/presse, 5.11.2014
[8] Samadder NJ, et al. Characteristics of Missed or Interval Colorectal Cancer and Patient Survival: A Population-Based Study. Gastroenterology 2014;146:950-960
[9] Gastroenterologen empfehlen Darmkrebs-Screening auch bei Jüngeren. www. aerzteblatt.de/nachrichten, 1.2.2016
[10] Propofol: Ein Narkotikum in der Diskussion. www.thieme.de/viamedici, 1.8.2011
[11] Riemann JF. Gegen das Kolonkarzinom – Methoden der Früherkennung und Aktionen zur Vorsorge. Dtsch Apoth Ztg 2013;153:1196-1199























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.