
- DAZ.online
- DAZ / AZ
- DAZ 7/2016
- Eingriff mit Todesfolge
Neurotransmitter
Eingriff mit Todesfolge
BIA 10-2474 und das Endocannabinoid-System
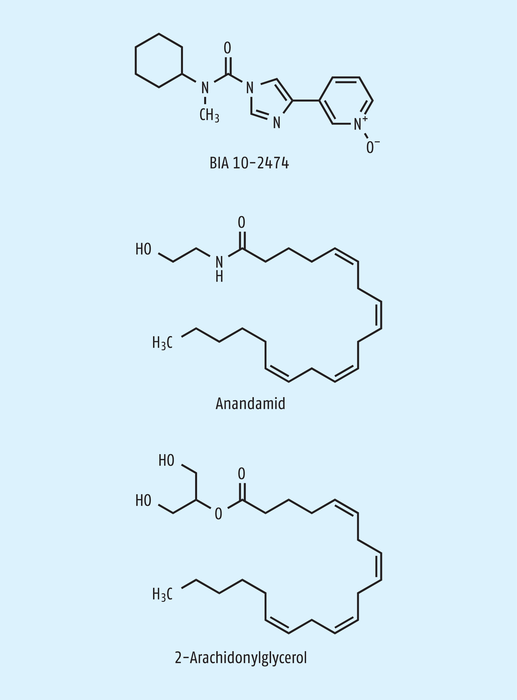
BIA 10-2474 (Abb. 1) hätte eine Art Tausendsassa werden können: ein Arzneistoff, der gegen Schmerz, Angstzustände, Krebs, Parkinson, Multiple Sklerose, Alkoholismus und Übelkeit gleichermaßen wirksam sein sollte.
Abb. 1: Strukturformeln der beiden wichtigsten Endocannabinoide und des synthetischen FAAH-Inhibitors BIA 10-2474.
Konzipiert war die Substanz als lang wirksamer, reversibler Inhibitor der Fettsäureamid-Hydrolase (fatty acid amide hydrolase, FAAH). Die FAAH ist ein Protein mit 597 Aminosäuren, das als Homodimer organisiert ist. Sie gehört zur großen Amidase-Familie und ist transmembranär im intrazellulären Membransystem der Zelle lokalisiert, wo sie einen Teil des zytoskelettalen Netzwerks bildet. Sie hydrolysiert („schneidet“) Fettsäureamide, wie der Name bereits andeutet. Fettsäureamide sind bioaktive Lipide, die in unterschiedliche Gruppen eingeteilt werden können, z. B.
- N-Acylethanolamine, zu denen Anandamid gehört,
- primäre Fettsäureamide wie Oleamid und
- N-Acylaminosäuren wie N-Acyltaurine.
Von Anandamid (Abb. 1) weiß man, dass es als endogener Agonist des Cannabinoid-Rezeptors 1 (CB1) agiert und u. a. Schmerz, Nahrungsaufnahme und Gedächtnis beeinflusst. Demgegenüber bindet Oleamid an verschiedene Rezeptoren, wie Serotonin-, GABA- und Cannabinoid-Rezeptoren, und fungiert als „Schlaf-Vermittler“. N-Acyltaurine sind daran beteiligt, die Schmerzempfindung zu modulieren. Ein Enzym, das alle diese Fettsäureamide spaltet und dadurch die Signalweiterleitung stört, kann also vielfältige Effekte ausüben.
Im Menschen und anderen Primaten existieren zwei Isoformen der Fettsäureamid-Hydrolase, die als FAAH-1 und FAAH-2 bezeichnet werden. Demgegenüber verfügen Mäuse und Ratten nur über eine Variante dieses Enzyms. Während die humane FAAH-1 im Gehirn, in den Nieren, in der Leber, in der Lunge, im Dünndarm, in der Prostata und im Hoden exprimiert wird, findet sich FAAH-2 in den Nieren, in der Leber, in der Lunge und in der Prostata sowie außerdem im Herzen, in den Eierstöcken sowie in den Skelettmuskeln.
Was macht die Fettsäureamid-Hydrolase überhaupt so interessant? Man erhofft sich, durch ihre Hemmung in das Endocannabinoid-System einzugreifen und darüber die gewünschten Effekte zu erzielen.
Das Endocannabinoid-System
Der Name des Endocannabinoid-Signal- und Steuerungssystems erinnert nicht von ungefähr an den lateinischen Namen der Hanfpflanze mit ihren psychotropen Effekten. Erst einige Zeit nachdem die wirksamen Inhaltsstoffe aus Cannabis sativa isoliert und charakterisiert worden waren, wurde auch der relevante Rezeptor im menschlichen Gehirn gefunden und als Cannabinoid-Rezeptor Typ 1 (CB1) bezeichnet. Durch Sequenzhomologie konnte später noch ein Rezeptor Typ 2 (CB2) nachgewiesen werden, der im Gegensatz zu CB1 nicht im Gehirn, sondern vielmehr auf Immunzellen vorkommt. Für die bekannte psychotrope Wirkung der Cannabis-Extrakte ist die Aktivierung von CB1 -Rezeptoren verantwortlich, die in ungewöhnlich hohen Konzentrationen im Gehirn vorhanden sind, aber auch in vielen anderen Organen vorkommen wie Milz, Nebennieren, Lunge, Herz, Pankreas.
Die Natur sieht natürlich keinen Rezeptor im Menschen speziell nur für sekundäre Pflanzeninhaltsstoffe vor. Vielmehr müssen auch endogene Liganden mit einer speziellen Funktion vorhanden sein. Die wichtigsten dieser sogenannten Endocannabinoide sind zwei Derivate der Arachidonsäure: Anandamid (Arachidonylethanolamid) und 2-Arachidonylglycerol (2-AG) (Abb. 1).
Interessanterweise konnte man auch einen natürlichen Inhibitor/reversen Agonisten des CB1-Rezeptors identifizieren. Hierbei handelt es sich um Hemopressin, ein Nonapeptid, von dem gezeigt werden konnte, dass es hypertensive Effekte induziert.
Ein retrograder Signalweg
Im Gegensatz zu den anderen bekannten Neurotransmittern wie Glutamat, Acetylcholin oder Serotonin werden die Endocannabinoide nicht in Vesikeln in der präsynaptischen Nervenzelle gespeichert und bei Bedarf freigesetzt. Vielmehr werden Anandamid und 2-AG erst nach einem entsprechenden Signal in der postsynaptischen Zelle aus einem Phospholipid bzw. aus Diacylglycerol in der Plasmamembran gebildet und dann in den synaptischen Spalt abgegeben (Abb. 2). Die Endocannabinoide schlagen also den entgegengesetzten (retrograden) Weg zu den anderen Neurotransmittern ein, indem sie von der postsynaptischen zur präsynaptischen Zelle wandern. Dort sitzt der CB1 -Rezeptor und wartet auf sie sowie auf weitere Liganden.
Abb. 2: Signalwege der Endocannabinoide Anandamid und 2-Arachidonylglycerol.
Nach dem Einstrom von Calciumionen (Ca2+ ) in die postsynaptische Zelle (unten links) werden Anandamid (Arachidonylethanolamin, AEA) und 2-Arachidonylglycerol (2-AG) aus N-Arachidonylphosphatidylethanolamin (NAPE) bzw. Diacylglycerol (DAG) gebildet und in den synaptischen Spalt sezerniert. Anschließend binden sie an den CB1 -Rezeptor der präsynaptischen Zelle und verhindern über mehrere Zwischenschritte die Freisetzung eines Neurotransmitters (hier als Beispiel Glutamat, Glu) in den synaptischen Spalt. Abgebaut werden die beiden Endocannabinoide über die Fettsäureamid-Hydrolase (FAAH) bzw. die Monoacylglycerol-Lipase (MAGL). BIA 10-2474 hemmt die FAAH. Zahlreiche andere Substanzen, die in den komplexen Prozess eingreifen (rote Schrift, rote Pfeile), sind in der Entwicklung.
Weitere Abkürzungen: iGluR, mGluR: ionotroper / metabotroper Glutamat-Rezeptor; PIP2: Phosphatidylinositolbisphosphat; IP3: Inositoltrisphosphat; PLC, PLD: Phospholipase C / D; DAGL: Diacylgylcerol-Lipase; Gi : inhibitorisches G-Protein; AC: Adenylatcyclase; MAPK: mitogen-activated protein kinase; TRPV1: transient receptor potential vanilloid 1.
Während andere Neurotransmitter mehrere unterschiedliche Rezeptoren ansteuern und darüber die verschiedenen Reaktionen auslösen, können CB1 -Rezeptoren von recht unterschiedlichen Liganden aktiviert werden. Nach ihrer Aktivierung wird über Gi/o -Proteine die Adenylatcyclase inhibiert. Zudem werden auch bestimmte Calciumkanäle gehemmt. Die Ausschüttung verschiedener Neurotransmitter wird verringert, was je nach Art der präsynaptischen Zelle zu inhibitorischen oder exzitatorischen Signalen führt.
Neben diesem retrograden Signalweg können Endocannabinoide im synaptischen Spalt auch an die CB1 -Rezeptoren der postsynaptischen Zelle binden und über autokrine Signale ihre eigene Synthese und Freisetzung abschalten. Das Ganze wird noch dadurch kompliziert, dass Anandamid den Transient Receptor Potential Vanilloid 1 (TRPV1) der präsynaptischen Zelle aktivieren und darüber pronozizeptive Signale vermitteln kann – wobei es die entgegengesetzte Wirkung hat, die es über den CB1 -Rezeptor erzielt.
Viele Effekte, viel pharmakologisches Potenzial
So vielfältig die Signalwege, so vielfältig sind die Effekte. Cannabisextrakte werden eingesetzt, um Schmerzen zu reduzieren, den Appetit anzuregen, Spasmen zu verhindern, in chronische Entzündungsgeschehen einzugreifen, bei Krebs zu helfen und etliches mehr. Außerdem wird dem Endocannabinoid-System zugesprochen, das Zentralnervensystem vor Schädigungen zu schützen, Lernprozesse zu modulieren und Emotionen zu steuern. Also könnte es ganz interessant sein, Wirkstoffe zu entwickeln, die in dieses System eingreifen. Neben Agonisten für die CB1 -Rezeptoren, die jedoch eventuell mit psychotropen Nebenwirkungen belastet sind, sind Wirkstoffe interessant, die diejenigen Enzyme ansteuern, die für die Synthese, den Transport oder den Abbau der Endocannabinoide sorgen.
Diese Hypothese wird gestützt durch Versuche an FAAH–/–-Knockout-Mäusen, die keine FAAH synthetisieren, sodass der Abbau von Fettsäureamiden (z. B. des Endocannabinoids Anandamid) gestört ist. Die entsprechend höhere Anandamid-Konzentration korreliert mit analgetischen, anxiolytischen und antiinflammatorischen Effekten. Interessanterweise zeigen diese Mäuse auch nicht die unerwünschten Effekte, die man beobachtet, wenn CB1 -Rezeptoren durch Agonisten stimuliert werden. Dazu zählen Hypomotilität, Hypothermie und eine psychomotorische Verlangsamung (Katalepsie).
Anandamid wird nach einem Anstieg der intrazellulären Calciumkonzentration durch verschiedene Enzyme aus N‑Arachidonyl-phosphatidylethanolamin (NAPE) synthetisiert und kann relativ leicht durch die Plasmamembran diffundieren (Abb. 2). Inwieweit ein Endocannabinoid-Membrantransporter diese Diffusion unterstützt, wird diskutiert. Einige Wirkstoffe gegen diesen vermeintlichen Endocannabinoid-Transporter wurden entwickelt, allerdings sind diese Substanzen gleichzeitig Inhibitoren der FAAH.
Für die Synthese von 2-Arachidonylglycerol (2-AG) sind die Phospholipase C sowie die Diacylglycerol-Lipase verantwortlich. Ein Inhibitor der Diacylglycerol-Lipase ist mit Orlistat verfügbar – allerdings soll damit weniger in das Endocannabinoid-System eingegriffen werden als vielmehr in die Resorption von Fett aus der Nahrung. Abgebaut wird 2-AG vor allem über die intrazelluläre Monoacylglycerol-Lipase.
Neben der FAAH und der Monoacylglycerol-Lipase können auch die Cyclooxygenase (COX), Lipoxygenase, αβ-Hydrolase und Cytochrom-P450-Enzyme die Endocannabinoide abbauen bzw. in neue Signalmoleküle umbauen, sodass mittlerweile auch über duale Inhibitoren der FAAH und der COX‑2 nachgedacht wird, um wirkungsvoll die Schmerzempfindung zu inhibieren.
Ein schwierig zu adressierendes System
Das Endocannabinoid-System scheint nicht ganz einfach zu steuern zu sein. Rimonabant, ein Inhibitor des CB1 -Rezeptors, war ursprünglich als Wirkstoff für die Raucherentwöhnung entwickelt worden, wurde dann als Appetitzügler zur Behandlung des Übergewichts zugelassen und schließlich 2008 wegen unerwünschter psychischer Wirkungen vom Markt genommen. Ein von der Firma Pfizer entwickelter Inhibitor der FAAH scheiterte wegen mangelnder Wirksamkeit in der klinischen Studie. Und jetzt also das Desaster während einer klinischen Studie mit der Substanz BIA 10-2474, worauf andere Studien mit ähnlich wirkenden Substanzen zunächst einmal eingestellt wurden. Aber es sind immer noch zahlreiche Substanzen in der Entwicklung, die das Endocannabinoid-System an der einen oder anderen Stelle adressieren sollen.
Das Endocannabinoid-System in unserem Körper ist sehr komplex und an vielen Signalwegen beteiligt, weshalb es offensichtlich schwierig ist, hier wirklich gezielt einzugreifen, ohne zu starke unerwünschte Effekte hervorzurufen. Präklinische Tierexperimente sind nur bedingt aussagekräftig, vor allem unter dem Aspekt, dass Nagetiere keine zweite Fettsäureamid-Hydrolase besitzen. Beim Menschen kommen wahrscheinlich noch individuelle Unterschiede in der Enzymausstattung hinzu, die die Wirkung der Endocannabinoide beeinflussen und für unerwünschte Wirkungen sorgen können.
Es bedarf wahrscheinlich noch einiger Grundlagenforschung, um das Endocannabinoid-System im vollen Ausmaß zu verstehen und danach wirklich sichere Wirkstoffe entwickeln und mit ihnen erfolgreiche klinische Studien durchführen zu können. |
Literatur
Burston JJ, Woodhams SG. Endocannabinoid system and pain: an introduction. Proc Nutr Soc 2014;73:106-117
Grotenhermen F, Müller-Vahl K. The therapeutic potential of cannabis and cannabinoids. Dtsch Arztebl Int 2012;109:495-501
Heimann AS, et al. Hemopressin is an inverse agonist of CB1 cannabinoid receptors. Proc Natl Acad Sci USA 2007;104:20588-20593
Lambert DM, Fowler CJ. The endocannabinoid system: drug targets, lead compounds, and potential therapeutic applications. J Med Chem 2005;48:5059-5087
Piomelli D. The molecular logic of endocannabinoid signalling. Nature Rev Neurosci 2003;4:873-884
Szabo B. Pharmacology of Cannabinoid Receptors. BIOTREND Reviews 2 (2008)
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.