
- DAZ.online
- DAZ / AZ
- DAZ 6/2016
- Die Sache mit dem „T
Hintergrund
Die Sache mit dem „T“
Verschreibungen auf T-Rezepten – zwischen Tragik und Therapiehoffnung
Der Einsatz von Lenalidomid, Pomalidomid und Thalidomid gilt als risikoreich und überwachungsbedürftig, weshalb in Deutschland eine für diesen Zweck eingerichtete Behörde, das sogenannte „T-Register“, existiert. Für die Verschreibung und Abgabe dieser „Arzneimittel für seltene Leiden“ (Orphan-Drugs) ist für die behandelnden Ärzte und mitwirkenden Apotheken ein besonderes T-Rezept und ein gewisser Dokumentationsaufwand vorgesehen. Die Verordnungszahlen aller drei Wirkstoffe in Summe zeigen, dass seit 2010 jährlich rund 30.000 Packungen zulasten der gesetzlichen Krankenkassen in deutschen Apotheken abgegeben wurden [1]. Eine bemerkenswerte Tatsache, wenn man bedenkt mit welcher Tragödie die erste Markteinführung dieser Arzneimittelgruppe vor rund 60 Jahren in Verbindung steht. Doch die konstante Verschreibungshäufigkeit in den letzten Jahren weist auf die wachsende Bedeutung und Notwendigkeit dieser Wirkstoffe in der stationären und ambulanten Behandlung von bestimmten Patientengruppen hin.
Wie alles begann
Mitte des 20. Jahrhunderts galt die junge Bundesrepublik Deutschland als „Apotheke der Welt“. Unter dem Eindruck des Wirtschaftswunders florierte die pharmazeutische Industrie und brachte im gefühlten Sekundentakt unzählige innovative Arzneimittel auf den Weltmarkt. Wie sich später auf tragische Weise herausstellte, waren daran nicht nur der rasante wirtschaftliche Aufschwung und die Genialität der Wissenschaftler beteiligt, sondern auch die fehlenden Kontrollinstanzen und Sicherheitsauflagen im damaligen Arzneimittelrecht. Für den Vertrieb von Medikamenten mussten die Hersteller lediglich Experimente durchführen, die im Tiermodell Verträglichkeit und Ungiftigkeit bewiesen – ein Zulassungsverfahren im heutigen Sinn existierte somit nicht.
1954 wurde in den Laboratorien des Stolberger Unternehmens „Chemie Grünenthal“ Phthalimidoglutarimid synthetisiert, ein chirales Piperidindion-Derivat, das eine strukturelle Abwandlung der Barbiturate darstellt (Abb. 1). In ersten Versuchsreihen erschien es weder toxisch noch pharmakologisch aktiv. Diese Tatsache weckte das Interesse der Mitarbeiter, da es damals nicht ungewöhnlich war, erst nach der Entwicklung eines vermeintlich harmlosen Wirkstoffes die passende Indikation für diesen zu finden. In den verwendeten Tiermodellen zeigten sich keine akut pathogenen oder fruchtschädigenden Effekte. Bei klinischen Tests berichteten die Patienten von einer angenehmen Schlafförderung und Entspannung. Außerdem wirkte es gegen Übelkeit und Erbrechen. Damit wurde erkannt, welches Marktpotenzial Thalidomid haben würde: ein nebenwirkungsfreies Schlafmittel, das gerade bei Schwangeren mit Morgenübelkeit ohne Bedenken eingesetzt werden konnte. Nach dreijähriger Entwicklungszeit kam es 1957 unter dem Namen „Contergan“ (25 mg) und „Contergan forte“ (100 mg) für fast vier Jahre rezeptfrei auf den Markt und bescherte der Firma in über 40 Ländern Rekordumsätze.
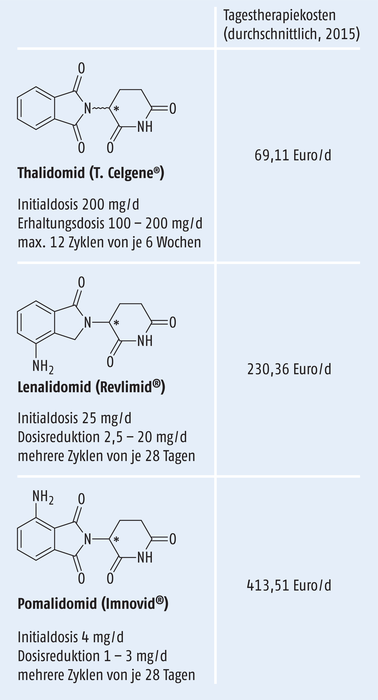
Abb. 1: Die Wirkstoffklasse der „IMiDs“ – Dosierungen laut Fachinformationen, Tagestherapiekosten nach [1]
Die Katastrophe und ihre Folgen
Weltweit wurden zwischen 5.000 und 10.000 teils schwerbehinderte Kinder geboren, deren Mütter in der Frühschwangerschaft nachweislich Contergan eingenommen hatten. Die Zahl der Totgeburten konnte nie zuverlässig ermittelt werden. Für die Contergan-Schädigung charakteristisch: Fehlbildungen (Dysmelien) oder völliges Fehlen (Aplasien) von Gliedmaßen, wie Arme und Beine, und anderen Organen. Ältere Patienten berichteten über irreversible Nervenreizungen in Extremitäten. Eine Vielzahl der Opfer hätte verhindert werden können, wenn es Behörden und Kommissionen gegeben hätte, die Meldungen und Berichte über Arzneimittelnebenwirkungen und das Auftreten von Geburtsfehlern gesammelt und ausgewertet hätten.
Die Erfahrungen aus dem „Contergan-Skandal“ führten in vielen europäischen und amerikanischen Ländern zu einer grundlegenden Modernisierung und Verschärfung des Arzneimittelrechts. Seitdem werden von pharmazeutischen Herstellern umfangreiche Studien zur Qualität, Wirksamkeit und Unbedenklichkeit gefordert. Außerdem wurden Regelungen zur Haftung und Entschädigung bei unerwünschten Arzneimittelwirkungen eingeführt.
Ein Comeback kündigt sich an
Kurz nachdem die Arzneimittelkatastrophe weltweit Beachtung fand und Contergan vom Markt genommen wurde, kam es 1964 zu einer folgenreichen Zufallsentdeckung: Ein israelischer Hautarzt verabreichte einer Lepra-Patientin mit Schlafstörungen Thalidomid aus Restbeständen. Kurze Zeit später stellten sie fest, dass sich die krankheitstypischen Hautentzündungen (Erythema nodosum leprosum, ENL) bei der Frau gänzlich zurückgebildet hatten [2].
Diesen Behandlungserfolg konnte der Mediziner bei sechs weiteren Lepra-Kranken, denen er Thalidomid gab, beobachten und veröffentlichte seine Ergebnisse in der Fachpresse. Nachdem aus anderen Ländern ähnliche Erfolge gemeldet wurden, intensivierte man die Forschung mithilfe placebokontrollierter Studien vor allem im südamerikanischen Raum. Die Studienergebnisse waren durchweg vielversprechend: Bei über 90 Prozent der mit Thalidomid behandelten Patienten wurde die Lepra-Symptomatik vollständig unterdrückt oder verbessert, während sich der Krankheitsverlauf bei Placebo-Gabe fast immer verschlechterte [3]. Auch im Vergleich zur damaligen Standardtherapie mit Acetylsalicylsäure konnten durch Thalidomid vielversprechende Erfolge bei Lepra erzielt werden [4].
Frühe Untersuchungen zur Wirkung
Für Aufsehen sorgten Mitte der 1960er-Jahre drei britische Transplantationsforscher, die im Mausmodell die immunsuppressive Eigenschaft von Thalidomid nachwiesen [5]. Ihre Hypothese ist aus heutiger Sicht ethisch fragwürdig und wissenschaftlich längst widerlegt. Sie schlussfolgerten, dass Thalidomid selbst nicht für die Fehlbildungen der Embryonen verantwortlich sei, sondern eine mütterliche Immunreaktion unterdrückt und deshalb „mißgebildete Kinder ausgetragen werden, die anderenfalls schon im embryonalen Zustand ausgestoßen worden wären.“ [6]
Eine weitere Frage war zu klären, ob nun das R- oder S-Enantiomer von Thalidomid für die Teratogenität verantwortlich sei. Nach einer anfänglichen Euphorie, man hätte mit der reinen R-Form eine pharmakologisch aktive, jedoch nebenwirkungsarme Alternative zum Racemat gefunden, stellte man schließlich fest: Der „Contergan-Skandal“ wäre durch den Einsatz eines „harmlosen“ Enantiomers nicht verhindert worden, da es im Blutplasma innerhalb weniger Minuten immer zu einer Racemisierung kommt [7].
Bei den Untersuchungen mit Thalidomid in verschiedenen Tiermodellen kamen immer mehr Forschergruppen zu der Erkenntnis, dass es speziestypische Metabolisierungen gibt. Die Ursache, weshalb die Grünenthal-Forscher in den Entwicklungsjahren keine teratogenen Effekte feststellten, war, dass die hepatischen Biotransformationen der verwendeten Tierarten keine fruchtschädigenden Metabolite hervorbrachten oder die jeweiligen Zielstrukturen fehlten [8].
Thalidomid bei unheilbaren Erkrankungen
Bis in die 1990er-Jahre wurden mit Thalidomid immer wieder Heilversuche und Studien für zum damaligen Zeitpunkt unheilbare und seltene Erkrankungen aus dem dermatologischen, onkologischen und autoimmunologischen Bereich durchgeführt.
Auch AIDS-Patienten, die sich mit ihren zahlreichen Begleiterkrankungen damals in einer höchst ausweglosen Situation befanden, konnten plötzlich lebensverlängernd behandelt werden. Thalidomid wirkte in den Untersuchungen auf orale Aphthen und andere Ulzerationen in der Mund- und Rachenschleimhaut ein und unterdrückte die Bildung verschiedener Zytokine. Dies führte dazu, dass sich die Betroffenen wieder ausreichend ernähren konnten und somit dem Wasting-Syndrom entgingen [9]. Doch die Entwicklung und Einführung antiretroviraler Therapiekonzepte mit besseren Wirkprofilen waren den Therapieversuchen mit Thalidomid überlegen.
Dem Wirkmechanismus auf der Spur
Vor etwa 25 Jahren kamen erste Publikationen auf, die die molekularen Wirkmechanismen von Thalidomid beleuchteten. So wurde die Expressionshemmung wichtiger Signalmoleküle (TNF-α) und Funktionsproteine (Integrine) des Immunsystems nachgewiesen [10]. Darüber hinaus konnten für Thalidomid expressionsfördernde Wirkungen auf bestimmte Zytokine und Immunzellen nachgewiesen werden [11]. Diese immunmodulierende Eigenschaft wird ergänzt durch die Apoptoseinduktion bei Tumorzellen des blutbildenden Systems [12].
Bemerkenswerterweise steht Thalidomid in Zusammenhang mit einer der bedeutsamsten Entdeckungen in der Tumorforschung: Dr. Judah Folkman, amerikanischer Zellbiologe und Mediziner, formulierte 1971 seine damals sehr umstrittene Hypothese, dass für das Tumorwachstum die Neubildung von Blutgefäßen essenziell sei und deren Hemmung eine effektive Therapieoption darstellen müsse. Durch Experimente in einem Tiermodell mit Kaninchen konnte die Arbeitsgruppe mehr als 20 Jahre später nachweisen, dass Thalidomid unabhängig von seiner immunologischen Wirkung direkt die Angiogenese hemmt und dass dieser Effekt ursächlich für die Wachstumshemmung von Tumoren ist [13]. Man geht mittlerweile davon aus, dass die Hemmung der Wachstumsfaktoren VGEF und bFGF in diesem Zusammenhang eine Hauptursache für die Missbildungen bei Ungeborenen darstellt [14].
Lenalidomid und Pomalidomid stellen eine strukturähnliche Weiterentwicklung von Thalidomid dar (Abb. 1). Die TNF-α- und tumorhemmenden Effekte sind 50.000 bzw. 500.000fach stärker ausgeprägt, während die unerwünschten Wirkungen wie Polyneuropathien, Thromboembolien und Sedierung schwächer und seltener auftreten. Ein teratogenes Potenzial ist jedoch nach wie vor gegeben [15]. Vor Kurzem konnte für Lenalidomid ein weiterer tumorhemmender Effekt aufgeklärt werden, der gleichzeitig auch ursächlich für die embryonalen Missbildungen sein könnte: Durch direkte Bindung an das Signalprotein Cereblon werden bestimmte Transkriptionsfaktoren dem Proteasom zugeführt und dort abgebaut. Die Myelomzelle wird hierdurch zerstört und in der Embryonalentwicklung hemmt diese gezielte Regulation das Wachsen von Gliedmaßen [16].
Therapiestandard bei Multiplem Myelom
Die unzähligen Therapieversuche und Studien mit Thalidomid und Analoga der letzten Jahrzehnte zeigten vielversprechende Erfolge bei einer Reihe von schwerwiegenden dermatologischen Erkrankungen (ENL, Hautsarkoidose, Lupus erythematodes). Ende der 1990er-Jahre führten aber dann die Ergebnisse von Studien bei Multiplem Myelom zur Zulassung von Lenalidomid in der EU [17].
Die therapeutischen Optionen beim Multiplen Myelom haben sich in den letzten Jahren grundlegend erweitert. Es handelt sich aber weiterhin um eine unheilbare Erkrankung mit chronischem Verlauf.
Die Diagnostik umfasst den Nachweis klonaler Plasmazellen im Knochenmark (> 10%), den Nachweis eines monoklonalen Proteins im Serum und/oder Urin sowie den Nachweis von Endorganschäden (CRAB-Kriterien: Hyperkalzämie [hyper calcemia] und/oder Niereninsuffizienz [„renal insufficiency“] und/oder Anämie [normochrom, normozytär] [„anemia“] und/oder osteolytische oder diffuse Knochendestruktion [bone lesions]). Eine Behandlungsindikation ergibt sich, wenn mindestens eines der CRAB-Kriterien erfüllt ist.
Die zugelassenen therapeutischen Optionen umfassen neben den bekannten Zytostatika (z. B. Melphalan, Bendamustin, Cyclophosphamid) mittlerweile auch Proteasomeninhibitoren (Bortezomib, Carfilzomib, Ixazomib) und Immunmodulatoren (Lenalidomid, Pomalidomid, Thalidomid). Die Zulassung der ersten monoklonalen Antikörper wird für 2016 erwartet (Anti-SLAMF7: Elotuzumab, Anti-CD38: Daratumumab). Auch Checkpoint-Inhibitoren wie Pembrolizumab zeigen in laufenden Studien bereits vielversprechende Daten in Kombination mit Immunmodulatoren.
Die Immunmodulatoren sind aus der Myelomtherapie nicht wegzudenken. Die anzustrebende Standardtherapie in der Erstlinie bei hochdosisfähigen Patienten ist – wie die aktuell laufende GMMG-HD-6-Studie andeutet – eine Induktionstherapie mit Bortezomib/Lenalidomid/Dexamethason gefolgt von einer Hochdosistherapie mit autologer Stammzelltransplantation, einer Konsolidierungstherapie und Erhaltungstherapie. Außerhalb von klinischen Studien wird eine Induktionstherapie mit Bortezomib/Cyclophosphamid/Dexamethason, gefolgt von der Hochdosistherapie durchgeführt. Bei einer autologen Stammzelltransplantation werden die im Vorfeld nach entsprechender Mobilisierung gesammelten eigenen Stammzellen des Patienten im Anschluss an eine Hochdosistherapie re-transfundiert. Derzeit sind noch keine Medikamente für eine Erhaltungstherapie nach Hochdosistherapie zugelassen
Lenalidomid. Bei nicht hochdosisfähigen Patienten ist Lenalidomid bereits zugelassene Erstlinientherapie (basierend auf Studienergebnissen der MM0020- und MM015-Studie). In der MM0020-Studie konnte gezeigt werden, dass Lenalidomid/Dexamethason im Vergleich zu einer Therapie mit Melphalan/Dexamethason/Thalidomid (MPT) sowohl das Gesamtüberleben als auch das progressionsfreie Überleben signifikant verlängert, ohne gehäuftes Auftreten von Zweitmalignomen. Die Daten zeigen ein Gesamtüberleben nach drei Jahren von ca. 70%. Das progressionsfreie Überleben lag unter Lenalidomid/Dexamethason bei 25,5 Monaten gegenüber 21,2 Monaten unter MPT [18].
Weitere zugelassene Therapien für die erste Therapielinie von Patienten, die sich nicht für eine Hochdosistherapie eignen, sind Bortezomib/Melphalan/Prednison (VMP), Melphalan/Prednison/Thalidomid (MPT) und Bendamustin/Prednison (BP).
Im ersten bis dritten Rezidiv ist die Kombinationstherapie aus Carfilzomib/Lenalidomid/Dexamethason (KRD) die aktuell effektivste Kombinationstherapie. Bei Patienten mit nur einer Vortherapie konnte das mediane progressionsfreie Überleben mit KRD um ein Jahr (29,6 Monate gegenüber 17,6 Monate unter Lenalidomid/Dexamethason) gesteigert werden. Bei Patienten mit zwei oder mehr Vortherapien liegt der Vorteil im progressionsfreien Überleben immer noch bei neun Monaten.
Pomalidomid ist im Rezidiv bzw. in der refraktären Situation zugelassen, wenn mindestens zwei Vortherapien (inklusive Lenalidomid und Bortezomib) erfolgt sind. Die Zulassung erfolgte auf Basis der MM003-Studie (Pomalidomid/Dexamethason gegenüber hochdosiertes Dexamethason). Auch bei Lenalidomid- und Bortezomib-refraktären Patienten konnte mit Pomalidomid ein signifikant längeres medianes Gesamtüberleben (13,1 gegenüber 8,1 Monate) und progressionsfreies Überleben (4 gegenüber 1,9 Monate) im Vergleich zu hochdosiertem Dexamethason erreicht werden [19]. Pomalidomid kann auch bei Patienten mit eingeschränkter Nierenfunktion eingesetzt werden.
Thalidomid ist zugelassen im Rahmen einer Induktion mit Bortezomib/Dexamethason/Thalidomid (VDT) sowie in der Erhaltungstherapie. In der klinischen Praxis hat Thalidomid jedoch eher in Refraktärsituationen einen Stellenwert.
Umgang mit T-Rezepten
Mit den Zulassungsentscheidungen für Lenalidomid (2007), Thalidomid (2008) und Pomalidomid (2013) hat die Europäische Kommission alle EU-Mitgliedstaaten zu besonderen Sicherheitsmaßnahmen verpflichtet. In Deutschland überwacht das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) mit der Abteilung „T-Register“ den Gesamtverbrauch und berichtet halbjährlich der Europäischen Arzneimittelagentur (EMA).
Neues T-Rezept ab 1. Februar
Anpassung an aktuelles Arzneiverordnungsblatt
Abb. 2: T-Rezept (Deckblatt, Teil I) in der aktuellsten Version vom 01.02.2016. Die Durchschrift (Teil II) dient der Auswertung durch das BfArM und ist im Patientenfeld geschwärzt.
Es gibt ein neues T-Rezept-Muster. Ab dem 1. Februar 2016 wird vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) ein neues T-Rezept-Muster herausgegeben. Die derzeit gültigen Muster behalten jedoch weiterhin ihre Gültigkeit.
Eine ärztliche Verschreibung von Arzneimitteln, die die Wirkstoffe Lenalidomid, Pomalidomid oder Thalidomid enthalten, hat auf einem nummerierten zweiteiligen amtlichen Vordruck (T-Rezept, Original und Durchschrift) zu erfolgen. Das erste Blatt (Teil I) dient der Apotheke zur Verrechnung. Das zweite Blatt (Teil II) dient der Auswertung durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Die beiden Blätter sind linksseitig geleimt. Das erste Blatt ist durchschreibend, wobei die nicht für das BfArM bestimmten Angaben nicht auf Blatt II abgebildet werden.
Das neue T-Rezept wurde dem aktuellen Arzneiverordnungsblatt Muster 16 angepasst. Darüber hinaus sieht das Verordnungsblatt nur noch eine Datumsangabe vor. Die jeweiligen Rückseiten bleiben unverändert. Am 21. Januar wurde das neue Muster des amtlichen Vordrucks für das T-Rezept im Bundesanzeiger bekannt gemacht und ist somit nun gültig.
Die drei Wirkstoffe dürfen ausschließlich auf dem T-Rezept (Abb. 2) verschrieben werden, das folgende Eigenschaften hat:
- Das Rezept ist an den verschreibenden Arzt gebunden und darf innerhalb einer Praxis oder Klinik nicht ausgetauscht werden, Vertretungsärzte müssen ebenfalls im T-Register registriert sein.
- Es besteht aus Deckblatt (Teil I) und Durchschrift (Teil II).
- Es ist bestimmt für die Verordnung eines Lenalidomid-, Pomalidomid- und Thalidomid-haltigen Arzneimittels (seit September 2011, ältere Rezepte behalten ihre Gültigkeit), die Verschreibung mehrerer Packungen des Arzneimittels ist möglich.
- Keine Verordnung von anderen Arznei- oder Hilfsmitteln.
- Das T-Rezept verfügt über eine fortlaufende T-Rezeptnummer zur eindeutigen Zuweisung.
- Es gelten auch hier die Vorgaben der Arzneimittelverschreibungsverordnung (§ 2).
In § 3a der Arzneimittelverschreibungsverordnung ist aufgeführt, welche Voraussetzungen und Auflagen im ambulanten (Praxen und Apotheken) und stationären Bereich (Kliniken und Krankenhausapotheken) für die Verschreibung erfüllt sein müssen (Tab. 1).
Ärzte |
Apotheke |
|---|---|
|
(Erst-)Anforderung von 20, 50 oder 100 T-Rezepten über das BfArM per Formular
Bedingungen:
|
|
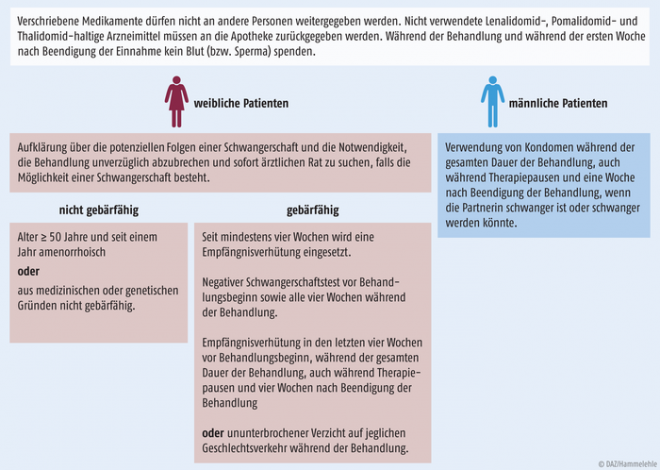
Die Sicherheitsmaßnahmen umfassen vor allem den Schutz von Schwangeren und ungeborenem Leben. Hierfür sind bestimmte Anforderungen an den Lebensstil und die Compliance der Patienten definiert worden (Abb. 3).
Abb. 3: Anforderungen an Lebensstil und Compliance der Patienten, modifiziert nach den Checklisten des BfArM
Fazit
Thalidomid und seine Strukturverwandten stehen für eine sehr außergewöhnliche Arzneistoffgruppe, wenn man sich bewusst macht, welche Bedeutung sie für unser ethisches, wissenschaftliches und therapeutisches Weltbild in der Pharmazie haben.
Zunächst führte der „Contergan-Skandal“ Anfang der 1960er-Jahre zu einem dringend notwendigen – wenn auch tragisch verspäteten – Wachrütteln aller Verantwortlichen und zwang sie, grundlegende Veränderungen im Arzneimittelrecht zu vollziehen. Das Fundament für unsere heutige Art der Entwicklung, Zulassung und Herstellerverantwortung wurde infolge dessen etabliert.
In den Jahrzehnten danach konnte durch die intensive und zum Teil auch äußerst waghalsige Arbeit vieler Wissenschaftler ein besseres Verständnis über Wirkungen und Nebenwirkungen von Thalidomid geschaffen werden. Das furchtbare Image wich der Erkenntnis, dass unter strengen Auflagen und aufmerksamer Beobachtung Versuche mit Thalidomid an Schwerkranken anschlugen und sogar die einzige Möglichkeit waren, diese Menschen symptomlindernd und lebensverlängernd zu therapieren.
Schließlich muss man feststellen, dass Lenalidomid, Pomalidomid und Thalidomid bei Erkrankungen wie dem Multiplen Myelom erfolgversprechende Mittel der ersten oder zweiten Wahl und alternativlos sind. Bemerkenswerterweise sind diese Substanzen aber weit davon entfernt, dem modernen Anspruch einer personalisierten und spezialisierten Pharmakotherapie auch nur annähernd zu genügen. |
Literatur
[1] GKV-Arzneimittelindex im Wissenschaftlichen Institut der AOK (WIdO)
[2] Silverman WA. The schizophrenic career of a „monster drug“. Pediatrics. 2002 Aug;110(2 Pt 1):404-6.
[3] http://www.spiegel.de/spiegel/print/d-45935494.html
[4] Greenstone G. Special feature: The revival of thalidomide: From tragedy to therapy. BCMJ, Vol. 53, No. 5, June 2011, page(s) 230-233 News&Notes
[5] Hellmann K et al. Prolongation of skin homograft survival by thalidomide. Br Med J. 1965 Sep 18;2(5463):687-9.
[6] http://www.zeit.de/1965/41/zeit-berichte-aus-der-foschung
[7] Roth K. Kurios, spannend, alltäglich: Eine unendliche chemische Geschichte. Chem. Unserer Zeit, 2005, 39, 212 – 217.
[8] Gordon GB et al. Thalidomide teratogenesis: evidence for a toxic arene oxide metabolite. Proc Natl Acad Sci U S A. 1981 Apr;78(4):2545-8.
[9] Jacobson JM et al. Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. National Institute of Allergy and Infectious Diseases AIDS Clinical Trials Group. N Engl J Med. 1997 May 22;336(21):1487-93.
[10] Sampaio EP et al. Thalidomide selectively inhibits tumor necrosis factor alpha production by stimulated human monocytes. J Exp Med. 1991 Mar 1;173(3):699-703.
[11] McHugh SM et al. The immunosuppressive drug thalidomide induces T helper cell type 2 (Th2) and concomitantly inhibits Th1 cytokine production in mitogen- and antigen-stimulated human peripheral blood mononuclear cell cultures. Clin Exp Immunol. 1995 Feb;99(2):160-7.
[12] Mitsiades N et al. Apoptotic signaling induced by immunomodulatory thalidomide analogs in human multiple myeloma cells: therapeutic implications. Blood. 2002 Jun 15;99(12):4525-30.
[13] D’Amato RJ et al. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci U S A. 1994 Apr 26;91(9):4082-5.
[14] Therapontos C et al. Thalidomide induces limb defects by preventing angiogenic outgrowth during early limb formation. Proc Natl Acad Sci U S A. 2009 May 26;106(21):8573-8.
[15] Schwabe U et al. Arzneiverordnungs-Report 2014: Aktuelle Daten, Kosten, Trends und Kommentare. Springer; Auflage: 2014; 105.
[16] Krönke J et al. Lenalidomide causes selective degradation of IKZF1 and IKZF3 in multiple myeloma cells. Science. 2014 Jan 17;343(6168):301-5.
[17] Singhal S et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med. 1999 Nov 18;341(21):1565-71.
[18] Benboubker L et al. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med. 2014 Sep 4;371(10):906-17.
[19] Dimopoulos MA et al. Cytogenetics and long-term survival of patients with refractory or relapsed and refractory multiple myeloma treated with pomalidomide and low-dose dexamethasone. Haematologica. 2015 Oct;100(10):1327-33.
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.