
- DAZ.online
- DAZ / AZ
- DAZ 51/2016
- Markieren, attackieren, ...
Pharmakologie
Markieren, attackieren, eliminieren
Mit Antikörpern Abwehrreaktionen mobilisieren
Die pathophysiologische Bedeutung von Lymphozyten
Lymphozyten stellen das Rückgrat der erworbenen Immunabwehr dar, da das Zusammenspiel von B-Zellen mit der Fähigkeit zur Bildung hochspezifischer Antikörper und T-Lymphozyten mit ihrer Funktion für die spezifische zelluläre Immunabwehr eine effektive Abwehrstrategie pathogener Stimuli gewährleistet. Lymphozyten können aber auch selbst eine pathologische Situation manifestieren oder eine solche vermitteln. Einerseits können Lymphozyten durch verschiedene Mutationen eine Malignität erhalten, die sich dann als leukämische Erkrankungen in verschiedenen Varianten von Lymphomen darstellen. Eine sehr einfache Einteilung leukämischer Erkrankungen ist im Folgenden (siehe Kasten „Lymphome“) vorgenommen.
Lymphome
Maligne Lymphome fasst eine heterogene Gruppe hämatologischer Erkrankungen zusammen, die durch eine von Mutationen verursachte, unkontrollierte Vermehrung der Zellen des lymphatischen Systems gekennzeichnet ist. Nach Klassifikation der WHO werden mehr als 50 Arten von Lymphomen unterschieden. Eine etablierte Form der Einteilung bezieht sich auf das Vorkommen von fusionierten sogenannten Sternberg-Reed-Zellen in Hodgkin-Lymphomen bzw. bei deren Nicht-Nachweisbarkeit in Non-Hodgkin-Lymphomen.
- Non-Hodgkin-Lymphome (NHL) umfasst eine heterogene Gruppe von mindestens 40 verschiedenen B-Zell- (ca. 80%) sowie T-Zell-Lymphomen (ca. 20%) unterschiedlicher Pathologie und Malignität. Die Inzidenz der Non-Hodgkin-Lymphome liegt mit leicht steigender Tendenz bei ca. 10/100.000 Einwohner.
- Chronisch lymphatische Leukämie (CLL) ist ein niedrigmalignes B-Zell-Lymphom, das den Non-Hodgkin-Lymphomen zugeordnet wird. Die chronisch lymphatische Leukämie ist die häufigste leukämische Erkrankung (Inzidenz ca. 4 bis 5/100.000 Einwohner), die insbesondere mit dem Alter in Zusammenhang gebracht wird. CLL ist durch eine klonale Proliferation von funktionslosen B-Zellen sowie einen langsamen Erkrankungsfortschritt gekennzeichnet.
Auf der anderen Seite können Lymphozyten in ihrer immunologischen Abwehrfunktion fehlgeleitet sein, und somit bei autoimmunen Erkrankungen eine überschießende Entzündungsreaktion induzieren, die sich dann pathologisch gegen das eigentlich gesunde Gewebe richtet. Diese autoimmunen Entzündungen weisen zwar eine breite symptomatische Varianz auf, wenn man beispielsweise die rheumatoide Arthritis, multiple Sklerose und Psoriasis vulgaris miteinander vergleicht, doch liegen bei all dieses Erkrankungen die pathologischen Grundlagen in einer verstärkten Gewebeinvadierung von Lymphozyten und einem Gewebeabbau durch die Abwehrzellen begründet.
Vor diesem Hintergrund wird deutlich, dass für beide pathologischen Formenkreise, Lymphome und autoimmune Entzündungen, eine partielle Eliminierung lymphozytärer Fraktionen oder eine funktionelle Abschwächung der Lymphozytenaktivitäten als analoge therapeutische Ziele existieren. Obwohl dies auf den ersten Blick etwas paradox erscheint, kann diese Eliminierung der Immunzellen durch das Immunsystem selbst realisiert werden. Voraussetzung dafür ist aber, dass die zu attackierenden Zellen durch eine Antikörpermarkierung für das Immunsystem als Zielstrukturen erkennbar gemacht werden.
Markierung von Zellen durch Antikörperpräparate
Zelluläre Oberflächen sind durch die Exprimierung vielfältiger Proteinstrukturen gekennzeichnet. Diese Oberflächenepitope werden nach biochemischen oder funktionellen Kriterien in einem speziellen Nomenklatursystem (CD, cluster of differentiation) klassifiziert und zahlenmäßig katalogisiert. Die Angabe einer CD-Determinante bei einer Zellpopulation gibt also Hinweis auf das Vorhandensein eines zumeist transmembranären Glykoproteins, lässt dabei aber keinen direkten Rückschluss auf dessen Funktion zu.
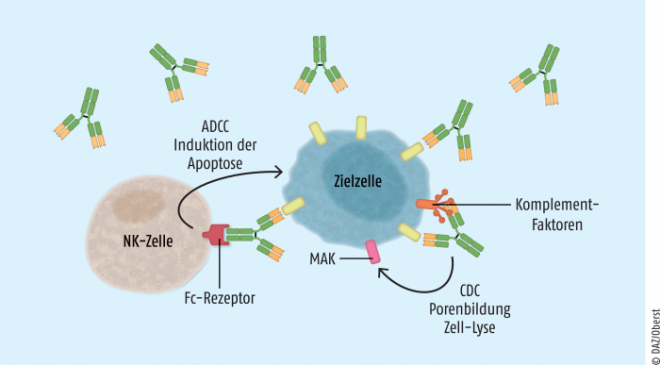
Werden einzelne CD-Determinanten spezifisch von bestimmten Zellpopulationen exprimiert, können diese für eine Markierung durch Antikörper therapeutisch ausgenutzt werden. Im Ergebnis einer Antikörperbindung an die CD-Determinante wird das Immunsystem in unterschiedlicher Funktionalität auf die markierten Zellen gerichtet. Von entscheidender Bedeutung für die Aktivierung der Immunabwehr ist dabei die nach außen gerichtete konstante Region (Fc-Teil) des gebundenen Antikörpers an den markierten Zellen. Einerseits ist dies ein Stimulus für das lösliche Komplementsystem, welches letztlich in einer Lyse und damit Zerstörung der markierten Zelle mündet. Auf der anderen Seite werden die Mechanismen der Antikörper vermittelten zellulären Zytotoxizität (antibody-dependent cellular cytotoxicity, ADCC) aktiviert. Hierbei spielen insbesondere Makrophagen oder natürliche Killerzellen eine wichtige Rolle (siehe Abbildung 1).
Der Erfolg und damit die grundsätzliche Anwendbarkeit einer solchen Markierungsstrategie zur Zelleliminierung sind aber an bestimmte Voraussetzungen der Exprimierung der CD-Determinante gebunden. Das durch die Antikörper markierte zelluläre Epitop muss möglichst spezifisch und stabil von der therapeutisch adressierten Zellpopulation exprimiert werden und auch nicht in löslicher Form existieren. Ebenfalls sollte keine zelluläre Internalisierung der Determinante nach Antikörperbindung erfolgen.
CD20 als Target für Antikörpermarkierungen
CD20 ist ein von B-Zellen und deren späten Vorstufen spezifisch exprimiertes Glykoprotein (B-lymphocyte antigen). Die Funktion dieses mit vier transmembranären Bereichen strukturierten Proteins ist bisher unbekannt; eine mögliche Aktivität als Calcium-Kanal wurde diskutiert. Da CD20 auch von malignen B-Zellen (B-Zell-Lymphome, Non-Hodgkin-Lymphome, chronisch lymphatische Leukämie) exprimiert wird, eignet es sich als Zielstruktur, um eine immunologische Eliminierung der neoplastischen Zellen unter einem generellen Angriff auf das B-Zell-System zu erreichen. Gleichfalls kann die Markierung von CD20 auch genutzt werden, um bei pathologischen Entzündungserkrankungen mit starker B-Zell-Involvierung, wie z. B. der rheumatoiden Arthritis oder multiplen Sklerose, einen antientzündlichen Effekt zu erreichen. Da CD20 nicht auf den frühen Vorläuferzellen der B-Zell-Population sowie Stammzellen exprimiert wird, werden diese Zellen nicht erfasst und können nach erfolgter therapeutischer Intervention für eine Regenerierung der B-Zellen sorgen. CD20 war das erste Oberflächenepitop, das im Rahmen einer Immuntherapie erfolgreich das Ziel therapeutischer Antikörper wurde.
Rituximab
Rituximab (MabThera®, Roche) ist ein in CHO-Zellen hergestellter monoklonaler, murin/human-chimärer CD20-Antikörper. Er erhielt bereits 1998 die Zulassung zur Therapie des follikulären Non-Hodgkin-Lymphoms als Monotherapie oder in Kombination mit Chemotherapie zur Erst- oder Rückfallbehandlung sowie zur Erhaltungstherapie. Die Chemotherapie basiert dabei auf Cyclophosphamid, Doxorubicin, Vincristin und Prednisolon (CHOP-Schema). Rituximab kann auch zur Behandlung der chronisch lymphatischen Leukämie in Kombination mit Chemotherapie für die Erstbehandlung von Patienten sowie von Patienten mit rezidivierender chronisch lymphatischer Leukämie eingesetzt werden.
Seit Juli 2006 ist Rituximab auch zur Therapie der rheumatoiden Arthritis (RA) in Kombination mit Methotrexat (MTX) zugelassen, wenn die Patienten nicht ausreichend auf eine Basistherapie mit DMARD sowie den Einsatz von TNF-α-Blockern ansprechen oder diese nicht vertragen.
Therapie mit Rituximab. MabThera® wird in einer Packungsgröße von 100 mg angeboten, der Antikörper wird in einer Konzentration von 10 mg/ml i.v. angewendet. Dabei sind folgende Dosierungen vorgeschrieben:
- NHL: 375 mg/m2 Körperoberfläche pro CHOP-Zyklus, bzw. alle acht Wochen bei der Erhaltungstherapie, sowie alle drei Monate bei rezidivierenden NHL.
- CLL: 375 mg/m2 Körperoberfläche pro Chemotherapiezyklus, ab dem zweiten Zyklus 500 mg/m2 Körperoberfläche für maximal sechs Zyklen.
Für die Therapie der rheumatoiden Arthritis werden zweimal je 1000 mg Rituximab im Abstand von zwei Wochen appliziert, nach Ansprechen der Therapie wird unter Umständen nach 24 Wochen eine weitere Injektion vorgenommen.
Unerwünschte Arzneimittelwirkungen. Rituximab wird generell gut vertragen; beschriebene Nebenwirkungen beziehen sich hauptsächlich auf infusionsbedingte Reaktionen. Zur Kontrolle von infusionsbedingten Nebenwirkungen, insbesondere dem sogenannten Zytokin-Freisetzungs-Syndrom, sind die Patienten engmaschig zu überwachen. Es ist auf eine langsame Infusionsrate (anfangs 50 mg/Stunde) zu achten; eine Prämedikation (Analgetikum/Antihistaminikum) ist anzuwenden. Durch eine Zulassungserweiterung kann Rituximab für die Behandlung des follikulären NHL (wie auch des diffus-großzelligen B-Zell Lymphoms) seit April 2014 subkutan (Fixdosis 1400 mg Rituximab; plus Hyaluronidase) appliziert werden. Neben einer deutlich schnelleren Applikation treten geringere lokale Nebenwirkungen auf.
Kontraindikationen. Die mit der Therapie einhergehende Immunsuppression erfordert bestimmte Vorsichtsmaßnahmen. Basierend auf der Immunsuppression sind bestehende aktive schwere Infektionen oder bereits immunsupprimierte Patienten klare Gegenanzeigen einer Therapie. Vor einer Therapie mit Rituximab muss zum Ausschluss einer Reaktivierung von Hepatitis B ein Virusscreening (Rote-Hand-Brief November 2013 [6]) durchgeführt werden. Zudem ist zum Ausschluss einer sich entwickelnden progressiven multifokalen Leukenzephalopathie (PML) eine engmaschige Überwachung der Patienten auf JC-Virustiter notwendig.
Eine Anzahl von Biosimilars zu Rituximab befindet sich in fortgeschrittenen Phasen der klinischen Entwicklung. Die EMA hat im Sommer 2016 den Antrag der Firma Sandoz auf Zulassung ihres Biosimilars GP2013 zu MabThera® akzeptiert, es befindet sich gegenwärtig noch in Prüfung.
Progressiv multifokale Leukenzephalopathie
Progressiv multifokale Leukenzephalopathie (PML) ist eine von Polyomaviren (JC-Virus) induzierte progrediente entzündliche Erkrankung des ZNS. Die resultierende Entmarkung von Neuronen führt zu schwerwiegenden neurologischen und motorischen Defekten und ist unbehandelt oftmals tödlich. Obwohl ca. 50% der Bevölkerung persistierend das Virus tragen, tritt eine progressiv multifokale Leukenzephalopathie nicht im gesunden Organismus auf, sondern als Folge einer eingeschränkten Lymphozyten-Funktion bei Krankheiten wie AIDS oder durch immunsuppressive Wirkstoffe. PML wurde insbesondere im Zusammenhang mit der Anwendung von Natalizumab bei der MS-Therapie von der medizinischen Öffentlichkeit wahrgenommen, wurde aber als Auswirkung einer Immunsuppression auch nach Behandlung mit dem TNF-α-Antagonisten Infliximab oder eben Rituximab beschrieben.
Ofatumumab
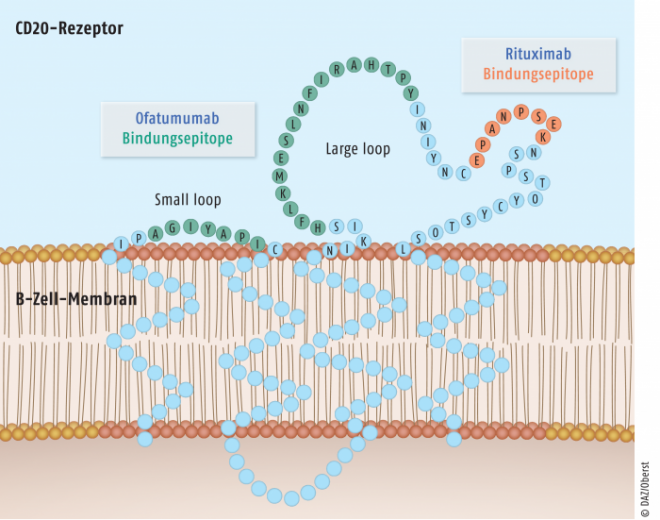
Mit Ofatumumab (Arzerra®, GlaxoSmithKline) ist seit 2010 ein weiterer CD20-Antikörper zur Therapie der chronisch lymphatischen Leukämie verfügbar. Ofatumumab ist ein humaner IgG1-Antikörper, der im Gegensatz zu Rituximab zwei Bindungsepitope auf beiden extrazellulären Loops des CD20-Moleküls erfasst (siehe Abbildung 2).
Dadurch weist Ofatumumab eine höhere Erkennungsfähigkeit der Zellen sowie eine stärkere Aktivierung der Immunabwehr als Rituximab auf. Ofatumumab ist für refraktäre CLL-Patienten anzuwenden, die nicht ausreichend auf Fludarabin (und Alemtuzumab) ansprechen. Außerdem ist Ofatumumab seit 2014 in Kombination mit Chlorambucil oder Bendamustin zur Erst-Linien-Therapie von CLL-Patienten zugelassen. Ofatumumab wirkt auch bei Patienten, die eine Resistenz gegen Rituximab aufweisen. Der Antikörper befindet sich in der klinischen Phase-III-Testung zur Anwendung beim Non-Hodgkin-Lymphom.
Therapie mit Ofatumumab. Ofatumumab wird mit einer anfänglichen Dosis von 300 mg, gefolgt von acht weiteren Applikationen mit jeweils 1000 mg im wöchentlichen Abstand bei nicht vorbehandelten Patienten, bzw. von 2000 mg bei refraktären CLL-Patienten i.v. angewendet.
Unerwünschte Arzneimittelwirkungen. Als unerwünschte Arzneimittelwirkungen wird ein ähnliches Nebenwirkungsprofil wie bei Rituximab beschrieben, das insbesondere infusionsbedingte Reaktionen beinhaltet. Die generelle Immunsuppression der Patienten bedarf hinsichtlich Hepatitis B und der Gefahr einer progressiv multifokalen Leukenzephalopathie wiederum eines engen Screenings der Patienten.
Die weitere Entwicklung zur Anwendung von Ofatumumab unterstreicht die oben genannten Parallelitäten zur Behandlung von Lymphomen und Autoimmunerkrankungen. Im August 2015 hat Novartis die Rechte an Ofatumumab zur Anwendung bei autoimmunen Entzündungserkrankungen erworben, eine Phase-III-Studie zur Anwendung bei multipler Sklerose ist in Vorbereitung.
Obinutuzumab
Obinutuzumab (Gazyvaro®, Roche) ist ein humanisierter IgG1-CD20-Antikörper, der durch eine chemoenzymatische Glykosylierung (Glykoengineering) als neuartiger „Typ II“-Antikörper eine verstärkte Wirksamkeit zur Aktivierung der Immunabwehr und zur Induktion der Zellapoptose gegenüber den anderen CD20-Antikörpern aufweist. Obinutuzumab besitzt einen Orphan-drug-Status und ist für solche CLL-Patienten anzuwenden, die aufgrund unterschiedlicher Begleiterkrankungen für eine Therapie mit Fludarabin nicht geeignet sind. Obinutuzumab wurde 2014 in Kombination mit Chlorambucil zur Therapie nicht vorbehandelter Patienten mit chronisch lymphatischer Leukämie in Europa zugelassen. Die FDA erteilte eine Zulassung nach beschleunigtem Verfahren im November 2013 [1]. Die Wirkungsüberlegenheit gegenüber Rituximab wurde in einer großen Vergleichsstudie bewiesen. Obinutuzumab befindet sich in verschiedenen Phase-III-Studien zur Behandlung des NHL.
Therapie mit Obinutuzumab. Die Therapie mit diesem Antikörper erfolgt in Form von sechs Behandlungszyklen. Dabei werden jeweils 1000 mg Obinutuzumab i.v. an den Tagen 1, 8 und 15 (Zyklus 1) und an Tag 1 (Zyklus 2 bis 6) appliziert und diese mit 0,5 mg Chlorambucil/kg Körpergewicht oral an den Tagen 1 und 15 von jedem Zyklus ergänzt. Für den ersten Zyklus wird eine geteilte Applikation des Antikörpers (100 mg/900 mg) vorgeschrieben, um die Verträglichkeit zu überprüfen und infusionsbedingte Nebenwirkungen zu reduzieren.
Unerwünschte Arzneimittelwirkungen. Hinsichtlich der Art der unerwünschten Arzneimittelwirkungen entspricht Obinutuzumab den beiden vorab beschriebenen CD20-Antikörpern.
CD20-Antikörper in der Pipeline
Eine Reihe von CD20-Antikörpern befindet sich gegenwärtig in unterschiedlichen Phasen der klinischen Entwicklung als potenzielle Wirkstoffe zur Behandlung leukämischer Neoplasien sowie autoimmuner Entzündungserkrankungen.
Ocrelizumab (Ocrevus®). Als humanisierter CD20-Antikörper ist Ocrelizumab in der klinischen Entwicklung zur Anwendung bei multipler Sklerose weit fortgeschritten (Roche/Biogen). Die abgeschlossenen Phase-III-Studien bewiesen unter anderem eine überlegene Wirksamkeit gegenüber Interferon beta 1a. Ocrelizumab ist ebenfalls signifikant wirksam bei der Behandlung der primär progredienten Form der MS-Erkrankung und wäre somit die erste therapeutische Option zur Behandlung dieser Krankheitsausprägung. Die FDA hat im Frühjahr 2016 Ocrelizumab den Breakthrough-Status und damit eine beschleunigte Zulassung zuerkannt, in den USA wird zeitnah eine Entscheidung erwartet, die in Europa auch im Jahr 2017 fallen wird [2].
Veltuzumab. Der humanisierte CD20-Antikörper (Immunomedics Inc.) befindet sich in der klinischen Phase II zur Behandlung von Non-Hodgkin-Lymphomen sowie chronisch lymphatischer Leukämie. Veltuzumab erhielt im November 2014 von der FDA den Orphan-drug-Status zur Behandlung (s.c.) der sehr seltenen autoimmunen Hauterkrankung Pemphigus vulgaris sowie der immunologischen Thrombozytopenie.
Ocaratuzumab. Der humanisierte, strukturell modifizierte CD20-Antikörper (Fc-engeneered), der durch diese Modifizierung eine gegenüber Rituximab deutlich stärkere Wirkung zur Aktivierung des Immunsystems induzieren soll, ist gegenwärtig in unterschiedlichen klinischen Entwicklungsphasen (Mentrik Biotech): Phase-II-Studie beim Non-Hodgkin-Lymphom ist abgeschlossen, auch zur s.c.-Anwendung; Phase-I-Studie bei rheumatoider Arthritis läuft.
CD38 als Target für die Therapie des multiplen Myeloms
CD38 ist ein Glykoprotein, das auf verschiedenen lymphoiden Zellen exprimiert wird und dem verschiedene Funktionen bei Zelladhäsion und Signaltransduktion zugeschrieben werden. CD38 gilt als Marker einer Zellaktivierung und wird daher bei Lymphomen und Myelomen in der Intensität seiner Expression mit der Progression der malignen Erkrankung und damit einer schlechten Prognose assoziiert. Da es nur sehr wenig auf hämatopoetischen Stammzellen exprimiert wird, gilt CD38 als aussichtsreiches Target für therapeutische Antikörper, insbesondere für die Therapie des multiplen Myeloms.
Daratumumab
Daratumumab (Darzalex®) ist ein humaner Antikörper gegen CD38, der im Juli 2016 (Janssen Cilag; unter besonderen Auflagen in einem beschleunigten Zulassungsverfahren nach erfolgreichen Phase-II-Studien) zur Therapie Erwachsener Patienten mit multiplem Myelom zugelassen wurde, bei denen die Erkrankung auch unter der Anwendung von Proteasom-Inhibitoren oder einer Immuntherapie fortschreitet. Daratumumab wird in Monotherapie angewendet [3]. In den Zulassungsstudien zeigten über 80% der mit Daratumumab behandelten Patienten ein Nichtfortschreiten der Erkrankung.
Therapie mit Daratumumab. Der Antikörper wird in einer Dosierung von 16 mg/kg Körpergewicht i.v. für acht Wochen wöchentlich appliziert, gefolgt von einer Anwendung im 14-tägigen Abstand bis zur Behandlungswoche 25. Ab diesem Zeitpunkt kann man mit monatlichen Applikationen fortfahren, solange sich bei den Patienten ein Nutzen der Therapie zeigt.
Als unerwünschte Arzneimittelwirkungen werden insbesondere infusionsbedingte Nebenwirkungen beschrieben, die sich in einer Reizung des Hals- und Rachenraums, Übelkeit, Dyspnoe sowie Husten manifestieren. Zu deren Umgehung wird eine Prämedikation mit Antihistaminika oder Antipyretika empfohlen. Die Anwendung von Daratumumab ist bei Schwangerschaft kontraindiziert.
Cave: Durch schwache CD38-Expression auf Erythrozyten können bestimmte Bluttests beeinflusst werden, z. B. der sogenannte Coombs-Test auf inkomplette Antikörper gegen Erythrozyten.
CD38-Antikörper in der Pipeline
Einige CD38-Antikörper befinden sich in klinischer Entwicklung, von denen insbesondere zwei Produkte für die Therapie des multiplen Myeloms fortgeschritten sind.
SAR650984 (Sanofi) und MOR202 (Morphosys) sind gegenwärtig in Phase II der klinischen Entwicklung (Kombination mit Lenalidomid und Dexamethason) für die Therapie des multiplen Myeloms.
SLAMF7 als Target für Antikörpermarkierungen
Das Glykoprotein namens signaling lymphocyte activation molecule family 7 (SLAMF7), das auf Myelomzellen und natürlichen Killerzellen (NK-Zellen) exprimiert wird, hat sich auch als aussichtsreiches Target für eine therapeutische Beeinflussung durch Antikörper herauskristallisiert. SLAMF7 wird nicht von hämatopoetischen Stammzellen oder anderen physiologischen Geweben exprimiert, so dass ein immunologischer Angriff nach Antikörper-Markierung eine hohe therapeutische Spezifität aufweist.
Elotuzumab
Elotuzumab (Emplicity®, Bristol-Myers Squibb) ist ein humanisierter Antikörper gegen SLAMF7, der im Juli 2016 die Zulassung für die Therapie (Kombinationstherapie mit Lenalidomid und Dexamethason) erwachsener Patienten mit multiplem Myelom nach einer erfolglosen Primärtherapie erhielt. Das therapeutische Prinzip beruht auf einer Aktivierung der NK-Zellen durch Elotuzumab sowie einer Markierung der Myelomzellen für einen verstärkten immunologischen Angriff [4].
Therapie mit Elotuzumab. Elotuzumab wird in einer Dosierung von 10 mg/kg Körpergewicht i.v. initial viermal im wöchentlichen Abstand gefolgt von Applikationen im zweiwöchentlichen Intervall angewendet. Die Therapie kann fortgesetzt werden, solange die Patienten den Wirkstoff vertragen und dieser eine Wirkung zeigt.
Als unerwünschte Arzneimittelwirkungen werden insbesondere infusionsbedingte Nebenwirkungen sowie Husten, Pneumonie, Infektionen der oberen Atemwege, Lymphopenie sowie Herpes beschrieben, denen partiell durch eine Prämedikation mit Antihistaminika oder Paracetamol begegnet werden kann. Die Anwendung von Elotuzumab bei Schwangerschaften ist kontraindiziert.
CD52 als Target für leukämische und autoimmune Erkrankungen
CD52 ist ein auf B- und T-Lymphozyten exprimiertes Glykoprotein, das über einen Phospholipid-Anker in der Zellmembran assoziiert ist. Das eigentliche Peptidepitop des CD52 besteht aus nur zwölf Aminosäuren. Da CD52 nicht von Stammzellen (auch nicht von Thrombozyten, Erythrozyten sowie Granulozyten) gebildet wird, aber auf den leukämischen Lymphozyten nachweisbar ist, eignet es sich ähnlich wie CD20 für eine selektive Einflussnahme auf leukämische Neoplasien sowie zur Reduktion autoimmuner Entzündungsaktivitäten nach Markierung durch spezifische Antikörper.
Alemtuzumab
Der ursprünglich als Wirkstoff zur Therapie der CLL vom B-Zell-Typ entwickelte und im Jahr 2001 dafür zugelassene humanisierte CD52-Antikörper Alemtuzumab (MabCampath®) wurde von der Firma Genentech im Jahr 2012 aus dieser Indikation wieder zurückgezogen und im September 2013 zur Therapie der multiplen Sklerose in Europa erneut als Lemtrada® zugelassen (FDA November 2014). Dieser Indikationswechsel war mit den damit verbundenen preislichen Konsequenzen in der Öffentlichkeit höchst umstritten, unterstreicht aber im Kontext der pharmakologischen Betrachtungsweise die oben genannten Parallelitäten in der Behandlung leukämischer und autoimmuner Erkrankungen eindringlich.
Alemtuzumab induziert durch Aktivierung der Immunabwehr eine Depletion der für die multiple Sklerose pathologisch überaktivierten T- wie auch B-Lymphozyten. In Vergleichsstudien zeigte sich Alemtuzumab dem Interferon beta-1a hinsichtlich Senkung der Schubrate und Verlangsamung der Behinderungsprogression signifikant überlegen [5].
Therapie mit Alemtuzumab. Alemtuzumab wird als jährliche Stoßtherapie angewendet, die aus fünf i.v.-Applikationen von jeweils 12 mg an fünf aufeinander folgenden Tagen besteht. Im Folgejahr wird eine dreimalige Applikation dieser Dosierung vorgenommen. Je nach Ansprechen kann nach weiteren 24 Monaten eine dreifache Applikation wiederholt werden. Der Eingriff in das Immunsystem der Patienten durch partielle Depletion der Lymphozytenfraktionen bringt verschiedene Nebenwirkungen mit sich. Neben einer generellen, durch die Immunsuppression induzierten Infektanfälligkeit wird Alemtuzumab insbesondere mit Autoimmunstörungen, wie z. B. Schilddrüsenerkrankungen in Zusammenhang gebracht. Die behandelten Patienten werden durch ein Risk-Management-Programm auch in einem über den Applikationszeitraum hinausgehenden Zeitrahmen durch den Hersteller intensiv betreut.
Wertung und therapeutischer Stellenwert
Die Markierung von Zellen durch therapeutische Antikörper und die daraus resultierende Depletion dieser Zellen eröffnet ein weites Feld der immunologischen Therapien, das sowohl in der Behandlung leukämischer Erkrankungen als auch autoimmuner Entzündungen in den letzten Jahren eine breitere Anwendung gefunden hat. Dies wird absehbar durch neue Targetstrukturen und weitere Antikörperpräparate einen noch größeren Stellenwert erhalten. Der sensible Eingriff in das Immunsystem ist immer auch ein Balanceakt aus größtmöglicher therapeutischer Effektivität und Aufrechterhaltung der Immunabwehr, so dass diese Antikörper in ihrer Anwendung einem engen Monitoring unterliegen und mit spezifischen Nebenwirkungen assoziiert sind. Die hier vorgestellten Antikörper repräsentieren beispielhaft, welch enorme Bedeutung rekombinante Proteinarzneistoffe im Arzneischatz, insbesondere für die Schwerpunktthemen Onkologie und Autoimmunerkrankungen mittlerweile besitzen. |
Literatur
[1] Lee HZ et al. U.S. Food and drug administration approval: obinutuzumab in combination with chlorambucil for the treatment of previously untreated chronic lymphocytic leukemia. Clin Cancer Res 2014;20:3902-3907
[2] Ocrelizumab, Status der Entwicklung. 17. September 2016, www.arznei-news.de/ocrelizumab
[3] Lonial S et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet 2016,387:1551-1560
[4] Richardson PG et al. Elotuzumab in combination with lenalidomide and dexamethasone in patients with relapsed multiple myeloma: final phase 2 results from the randomised, open-label, phase 1b-2 dose-escalation study. Lancet Haematol 2015;12:e516-527
[5] Cohen JA et al. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012;380:1819-1828
[6] MabThera® (Rituximab): Hepatitis-B-Virus-(HBV)-Screening vor Behandlungsbeginn. Rote-Hand-Brief der Roche Pharma AG, November 2013
Biologicals – die Zukunft
Biologicals sprießen wie Pilze aus dem Boden, sie sind teuer, und sie versprechen ungeahnte Möglichkeiten – gleichzeitig verwirren sie mit komplexen Wirkstoffbezeichnungen, mit ihrer Empfindlichkeit und unerwarteten Indikationsüberschneidungen.
Machen Sie sich vertraut mit diesen innovativen Arzneistoffen, indem Sie Grundkenntnisse zu Struktur und Herstellung aufpolieren, beispielhafte Indikationen und Targets kennenlernen und die Konsequenzen für das Handling in der Apotheke verstehen.
Biopharmazeutika liegen im Trend – daten Sie sich up!
Gerd Bendas, Martina Düfer
Update BiologicalsRekombinante Proteine und ihr therapeutischer Einsatz. Update Pharmazie. XII, 85 S., 42 farb. Abb., 2 farb. Tab., Kartoniert, ISBN 978-3-7692-6628-3 Deutscher Apotheker Verlag 2016
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart, Tel. 0711 – 25 82 341, Fax: 0711 – 25 82 290,
E-Mail: service@deutscher-apotheker-verlag.de,
oder unter www.deutscher-apotheker-verlag.de
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.