
- DAZ.online
- DAZ / AZ
- DAZ 44/2016
- Immer schön trocken ...
Technologie
Immer schön trocken bleiben
Gefriertrocknung zur Stabilisierung von empfindlichen Proteinen
Schon die sibirisch-mongolischen Völker wussten die Grundprinzipien der Gefriertrocknung für die Konservierung von Fleisch zu nutzen [1]. Sie schnitten im Winter das Fleisch von Tieren in Streifen und hängten sie bei Temperaturen von -20°C an die Luft. Das Fleisch fror ein, und der Wind transportierte aufgrund seines niedrigen Feuchtegehaltes den über dem gefrorenen Fleisch herrschenden Wasserdampf kontinuierlich ab, was zu einer schonenden Trocknung führte.
Lebensmittel, Arzneimittel, Bücher
Als Grundlage der heutigen Gefriertrocknungstechnologie gilt die Erfindung der mechanischen Vakuumpumpe 1649 durch von Otto von Guericke. Es dauerte über 200 Jahre bis zur Beschreibung der Gefriertrocknung, wie wir sie heute kennen und wie sie vom Anatom Richard Altmann 1890 an der Universität Leipzig zur Trocknung und Konservierung histologischer Präparate eingesetzt wurde. 1909 wurde dann von L. F. Shackell erstmals die Vakuumgefriertrocknung von Blutprodukten beschrieben.
Auch heute wird die Gefriertrocknung in großem Maßstab in der Lebensmittelindustrie (Trocknung und Konservierung von Kräutern, Gewürzen oder Früchten) und in der pharmazeutischen Industrie zur Trocknung und Stabilisierung von Zubereitungen mit Antikörpern, Impfstoffen, Enzymen, Hormonen, Antibiotika oder auch Vitaminen eingesetzt. Daneben gibt es weitere, etwas „exotischere“ Anwendungsgebiete, wie das Trocknen von Dokumenten nach Wasserschäden, die Konservierung von Museumsartefakten oder die Taxidermie (Kunst der Haltbarmachung von Tierkörpern für Studien- und Dekorationszwecke).
Das Prinzip der Vakuumgefriertrocknung
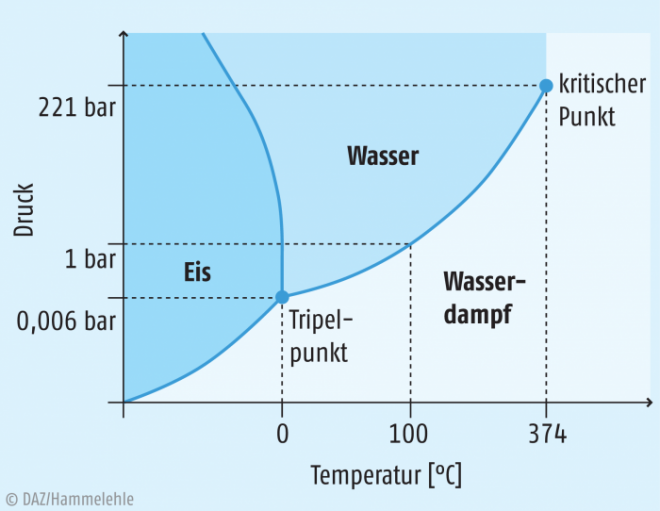
Die physikalische Grundlage der Gefriertrocknung ist die Sublimation, das heißt, der direkte Phasenübergang eines Stoffes vom festen in den gasförmigen Zustand, ohne dabei den flüssigen Zustand zu durchlaufen. Physikalisch beruht dies auf der Tatsache, dass Wasser im gefrorenen Zustand noch einen gewissen Dampfdruck besitzt, der auf den Austausch von Wassermolekülen zwischen der festen Eisphase und der umgebenden Gasphase zurückzuführen ist. Werden die dampfförmigen Wassermoleküle nun ständig durch die Kondensation an Kühlflächen oder durch Adsorptions- bzw. Trocknungsmittel entfernt, so nimmt die Eismenge kontinuierlich ab. Das Phasendiagramm des Wassers zeigt den Zusammenhang zwischen Druck und Temperatur sowie den sich ergebenden Aggregatzustand von Wasser (siehe Abbildung 1). Am Tripelpunkt bei 0,0099°C und 0,61 kPa (entspricht 0,0061 bar) stehen alle drei Phasen des Systems miteinander im Gleichgewicht. Aus dem Phasendiagramm geht hervor, dass die Sublimation von Eis in Wasserdampf erst bei Bedingungen unterhalb des Tripelpunktes möglich ist.
Aufbau moderner Gefriertrocknungsanlagen
Ein moderner Vakuumgefriertrockner besteht aus einer Trocknungskammer, in der sich temperierbare Stellflächen befinden, die zum Abkühlen und Einfrieren der zu Beginn flüssigen Formulierung wie auch zum Energieeintrag während der Trocknung dienen. Ein typischer Temperaturbereich für Stellflächen in einem Gefriertrockner umfasst -55°C bis +60°C. Die Trocknungskammer ist in der Regel über ein verschließbares Verbindungsrohr mit einer Kondensatorkammer verbunden. Diese enthält den Eiskondensator für die Kondensation der sublimierten Lösungsmittelmoleküle sowie einen Absaugstutzen für die Vakuumpumpe. Die Kondensatoren können auf niedrige Temperaturen gekühlt werden, bei vielen aktuellen Systemen auf bis zu -85°C [5].
Ein Gefriertrocknungsprozess kann in drei Phasen unterteilt werden:
- die Einfrierphase,
- die Primärtrocknung und
- die Sekundärtrocknung.
Jede dieser Phasen stellt einen wichtigen und bisweilen kritischen Prozessschritt dar, der das Trocknungsergebnis hinsichtlich der Qualität und Restfeuchte des Endproduktes signifikant beeinflussen kann.
Einfrierphase
Ziel des Einfrierens ist es, die anfänglich flüssige Ausgangsformulierung in ein komplett festes System zu überführen. Dabei soll das flüssige Wasser in festes Eis und die gelösten Substanzen in kristalline oder amorphe Feststoffe überführt werden. Wird eine Lösung unter ihren Gefrierpunkt abgekühlt, so bildet sich zuerst eine unterkühlte Lösung ohne Eiskristalle. In Abhängigkeit von der Einfriergeschwindigkeit und den Eigenschaften der Formulierungsbestandteile kann diese Unterkühlung 10 bis 15°C betragen. Wird die sogenannte Nukleationstemperatur (Tn) erreicht oder die Nukleation (Keimbildung als der erste Teilprozess eines Phasenübergangs) durch Einwirkung von außen gestartet, kommt es spontan zur Eiskristallbildung im Produkt. Da es sich hierbei um einen exothermen Prozess handelt, bei dem Kristallisationswärme frei wird, steigt die Produkttemperatur (Tp) sprunghaft auf die Kristallisationstemperatur des Eises an (Gleichgewichtsgefriertemperatur [Tf)]. Wird das Produkt nun weiter gekühlt, so wird immer mehr Wasser in festes Eis überführt. Die gelösten Bestandteile konzentrieren sich hierbei immer weiter auf, da die fortschreitende Bildung von Eiskristallen effektiv ein Entfernen von Wassermolekülen aus der Lösung bedeutet. Man spricht auch vom Vorgang der Gefrierkonzentrierung. Diese schreitet so lange fort, bis die konzentrierten Bestandteile entweder selbst kristallisieren oder die Viskosität des gefrierkonzentrierten Systems so hoch ist, dass es in ein festes amorphes Glas übergeht. Welches Verhalten vorkommt, hängt vor allem von den gelösten Formulierungsbestandteilen sowie deren Eigenschaften und Interaktionen beim Einfrieren ab. Natriumchlorid, Glycin oder auch Mannitol zeigen beim Einfrieren ein kristallines Verhalten: Sie bilden streng regelmäßige Strukturen. Saccharose, Trehalose oder auch Proteine hingegen verhalten sich beim Einfrieren amorph: Sie bilden regellose Strukturen.
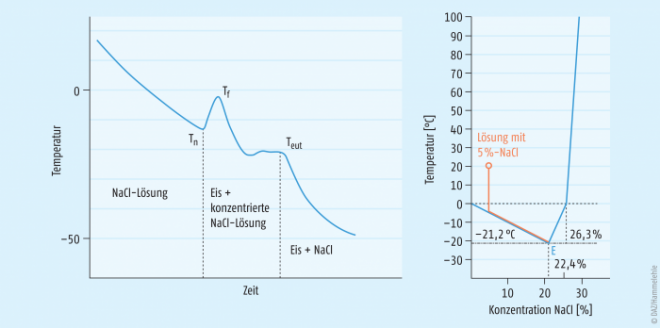
Kristalline Substanzen gefrieren
Für das Beispiel Natriumchlorid (NaCl), das aus einer gefrierkonzentrierten Lösung beim Einfrieren auskristallisiert, zeigt Abbildung 2 das Temperatur-Zeit- sowie das Temperatur-Konzentrations-Diagramm. Die wichtigste Kenngröße einer Lösung mit einer beim Einfrieren auskristallisierenden Substanz ist die eutektische Temperatur (Teut). Nur unterhalb der eutektischen Temperatur liegt ein komplett festes System vor. Oberhalb handelt es sich, je nach Ausgangskonzentration der NaCl-Lösung, um ein System bestehend aus entweder festem Eis und einer konzentrierten NaCl-Lösung oder aus festem NaCl und einer konzentrierten NaCl-Lösung. Im Falle einer NaCl-Lösung ist die Teut = -21,2°C. Das bedeutet, dass in der Einfrierphase der Gefriertrocknung unter die eutektische Temperatur abgekühlt werden muss, um zu gewährleisten, dass ein vollständig festes System vorliegt.
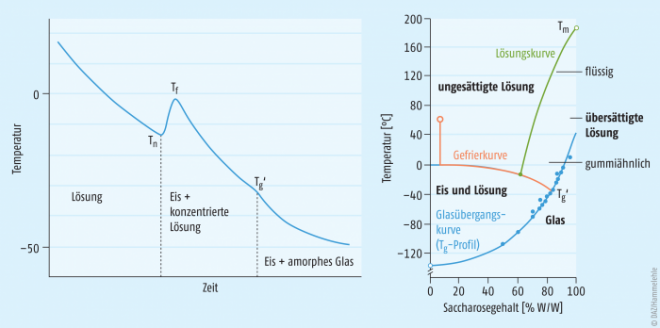
Amorphe Substanzen werden glasartig
Was die eutektische Temperatur bei kristallinen Systemen ist, ist bei amorphen Substanzen die Glasübergangstemperatur der maximal gefrierkonzentrierten Lösung (Tg’). Abbildung 3 zeigt exemplarisch den Temperatur-Zeit- sowie den Temperatur-Konzentrations-Verlauf für eine Saccharose-Lösung. Auch hier kommt es initial beim Abkühlen zu einer unterkühlten Lösung und nach dem Einsetzen der Eiskristallisation zu einer zunehmenden Konzentrierung der noch in Lösung verbleibenden Saccharose. Im Gegensatz zum vorher beschriebenen Verhalten von NaCl kristallisiert Saccharose aber nicht aus. Stattdessen kommt es durch die fortschreitende Entfernung von Wassermolekülen aus der Lösung durch Eiskristallbildung zu einer starken Viskositätszunahme. Hierbei wird irgendwann ein Punkt erreicht, an dem die extrem viskose und hochkonzentrierte Lösung in einen glasartigen, amorphen Feststoff übergeht. Bei diesem Übergang handelt es sich um einen Temperaturbereich, wenngleich meist ein einziger Temperaturwert angegeben wird: die Glasübergangstemperatur der maximal gefrierkonzentrierten Lösung (Tg’), die substanz- bzw. formulierungsspezifisch ist. Auch bei amorphen Systemen ist es also essenziell, unter Tg’ abzukühlen, um ein vollständig festes System zu erhalten.
Primärtrocknung
In der Primärtrocknungsphase sublimiert das gefrorene Lösungsmittel, aus Eis wird Wasserdampf. Wie bereits angesprochen herrscht über gefrorenem Wasser noch ein ausreichend hoher Dampfdruck, der die Sublimation von Wassermolekülen ermöglicht. Der Dampfdruck ist dabei direkt von der Temperatur abhängig. Damit es zur kontinuierlichen Sublimation von Wassermolekülen während der Primärtrocknung kommen kann, muss ein Dampfdruckgradient zwischen dem Eis und der umgebenden Atmosphäre hergestellt werden. Hierzu wird der Druck in der Trocknungskammer des Gefriertrockners mit einer Vakuumpumpe unter den Dampfdruck des Eises gesenkt. Dabei ist zu beachten, dass eine Sublimation ein endothermer Prozess ist. Daher muss Energie zugeführt werden. Dazu werden die Stellflächen in der Gefriertrocknungskammer, auf denen sich das Trocknungsgut befindet, beheizt. Ohne die Zufuhr von Wärme würde dem Produkt nach und nach Energie entzogen, was zu einer weiteren Abkühlung führen würde. Mit Sinken der Produkttemperatur würde sich auch der Dampfdruck des Eises immer weiter erniedrigen und im Extremfall dem Umgebungsdruck angleichen. Die Sublimation – und damit auch die Trocknung – würde zum Erliegen kommen.
Um bei fortschreitender Sublimation der Lösungsmittelmoleküle den Dampfdruckgradienten zwischen Eis und Umgebung aufrechtzuerhalten, müssen die Wassermoleküle aus der umgebenden Atmosphäre entfernt werden. Hierzu wird ein Eiskondensator eingesetzt, der den kältesten Punkt des Gefriertrocknungssystems darstellt. Die bereits aus dem Produkt durch Sublimation entfernten Wassermoleküle, die sich in der Trocknungskammer befinden, resublimieren am Kondensator und werden dort als Eis abgeschieden. Für eine kontinuierliche Sublimation in der Primärtrocknung sind unabdingbar
- eine Senkung des Drucks bzw. Vakuum,
- die Zufuhr von Energie durch die Stellflächen und
- das Abkühlen des Kondensators zur Resublimation der Lösungsmittelmoleküle.
Die Primärtrocknung gilt als beendet, wenn das gesamte Eis aus dem Produkt durch Sublimation entfernt wurde. Findet keine Sublimation mehr statt, wird auch keine Energie mehr für den Sublimationsvorgang benötigt: Die Temperatur im Produkt steigt auf die programmierte Temperatur der Stellfläche. Dieser Temperaturanstieg wird auch technisch als Indikator für das Ende der Primärtrocknung verwendet.
Sekundärtrocknung
Die Sekundärtrocknungsphase schließt sich in der Regel direkt an die Primärtrocknung an. Durch sie wird „unfrozen water“, also nicht gefrorenes Wasser entfernt. Das sind Wassermoleküle, die durch so starke Wechselwirkungen an die Feststoffbestandteile des Produktes gebunden sind, dass sie beim Einfrieren nicht auskristallisieren. Bei kristallinen Produkten sind diese Wassermoleküle häufig an Kristalloberflächen adsorbiert, bei amorphen Produkten sind sie dagegen in das hochviskose Glas eingebettet. Dieses in die Glasmatrix eingebettete Wasser muss in der Sekundärtrocknung aus dem Produkt entfernt werden, um nach der Trocknung einen niedrigen Wassergehalt im Endprodukt und somit eine gute Stabilität zu erzielen.
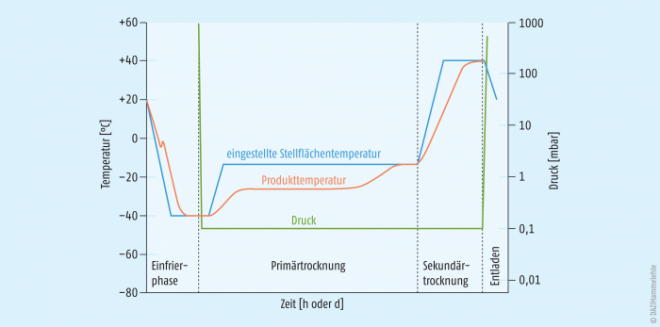
Der Verlauf eines kompletten Gefriertrocknungszyklus ist in Abbildung 4 dargestellt. Als Resultat erhält man in der Regel ein poröses trockenes Produkt, häufig in Form eines kleinen zylinderförmigen Kuchens mit niedriger Restfeuchte. Durch Zugabe der entsprechenden Menge Wasser kann das Ausgangsprodukt wieder hergestellt (= rekonstituiert) werden und steht dann wie bei gefriergetrockneten Impfstoffformulierungen z. B. zur Injektion bereit.
Gefriertrocknung von Proteinen
Proteine haben in den letzten 20 Jahren in der Medizin und Pharmazie überaus stark an Bedeutung gewonnen. Strukturell sind Proteine mit den klassischen kleinen Arzneistoffmolekülen nicht zu vergleichen. Es sind Makromoleküle mit einem hohen Molekulargewicht, die aus niedermolekularen Untereinheiten – den Aminosäuren – zusammengesetzt sind. Dabei ist die Primärstruktur, die Abfolge der kovalent verknüpften Aminosäuren, wichtig für die Funktion und Eigenschaften des Proteins. Aus der Primärstruktur resultiert die Ausbildung übergeordneter dreidimensionaler Strukturen – der Sekundär-, Tertiär- und manchmal auch der Quartärstruktur –, die durch schwache, nicht-kovalente Bindungen stabilisiert werden. Dabei handelt es sich vor allem um Van der Waals-Kräfte, Wasserstoffbrückenbindungen, Ionenbindungen und hydrophobe Wechselwirkungen in wässrigen Systemen. Die korrekte dreidimensionale Struktur (nativer Zustand) ist wichtig für die Funktion des Proteins. Eine drastische Änderung der Konformation (Denaturierung) geht gewöhnlich mit dem Verlust der biologischen Aktivität und spezifischer Eigenschaften einher (denaturierter Zustand). Durch den komplexen Aufbau der Proteine besteht vor allem in wässriger Umgebung unter ungünstigen Bedingungen das Risiko einer Reihe von Instabilitätsreaktionen.
Chemische und physikalische Instabilität
Chemische Instabilitäten, wie Deamidierung, Oxidation, Hydrolyse, Racemisierung, Isomerisierung, β-Elimination oder auch der Disulfid-Austausch, hängen direkt mit der Primärstruktur, genauer gesagt den Seitenketten der Aminosäuren, zusammen. Sie gehen mit chemischen Veränderungen einher. Physikalische Instabilitäten führen hingegen ohne chemische Modifikation der Aminosäuren zum teilweisen oder kompletten Verlust der dreidimensionalen Struktur mit Exposition hydrophober Seitenketten zur wässrigen Umgebung hin. Dadurch sind Interaktionen mehrerer denaturierter Proteinmoleküle untereinander möglich, die eine Aggregatbildung oder gar Präzipitation zur Folge haben können. Wichtige Einflussfaktoren für physikalische Instabilitäten sind Temperatur, Ionenstärke und pH-Wert der Formulierung. Bei der Entwicklung einer stabilen Proteinformulierung wird in der Regel aus Handhabungs- und Kostengründen meist eine wässrige Proteinformulierung bevorzugt. Ist dies nicht möglich, so wird meist mittels Gefriertrocknung eine stabile trockene Form hergestellt. Dabei ist zu beachten, dass die Struktur der Proteinmoleküle auch bei der Gefriertrocknung ohne stabilisierende Hilfsstoffe nicht zwangsläufig erhalten bleibt. Jede Phase eines Gefriertrocknungszyklus birgt potenzielle Gefahren für die Proteinstabilität.
Füllstoffe
Werden Proteine in geringen Mengen pro Behältnis dosiert, so können Füllstoffe zugesetzt werden. Diese Füllstoffe zeigen in der Regel bei der Gefriertrocknung ein kristallines Verhalten und verleihen dem späteren Gefriertrocknungskuchen mechanische Stabilität und ein ästhetisches Aussehen. Häufig werden Mannitol oder Glycin verwendet. Wichtig ist, dass diese Füllstoffe während des Einfrierprozesses vollständig auskristallisieren, da es ansonsten später bei der Lagerung zu Stabilitätsproblemen kommen kann. Die Kristallisation von Füllstoffen ist generell begünstigt, wenn diese in hoher Konzentration verwendet werden.
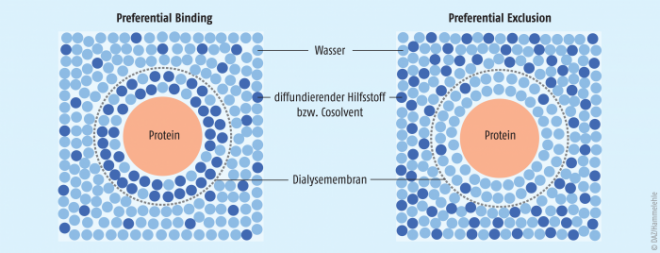
Kryoprotektoren
Wichtige Bestandteile einer Proteinformulierung sind Kryo- und Lyoprotektoren, die den Wirkstoff beim Einfrieren bzw. in der Trocknungsphase schützen. Protektive Substanzen sind meist gut wasserlöslich und zeigen in der Regel amorphes Verhalten beim Einfrieren. Sie liegen somit im gleichen physiko-chemischen Zustand und in derselben Phase wie auch die Proteine vor. Kryoprotektoren stabilisieren Proteine durch einen Mechanismus, der in der Fachliteratur als preferential exclusion bezeichnet wird [2, 3] (siehe Abbildung 5). Gemäß dieser Theorie wird ein kryoprotektiver Hilfsstoff in wässriger Lösung bevorzugt von der Oberfläche der Proteinmoleküle ausgeschlossen, was im Gegenzug die Hydratation der Proteinmoleküle verstärkt. Der bevorzugte Ausschluss eines Hilfsstoffes in einer Lösung aus Protein und Hilfsstoff ist thermodynamisch unvorteilhaft. Native, korrekt gefaltete Proteine haben in der Regel eine kompakte Form. Eine Denaturierung führt meist zu einer Zunahme der Grenzfläche zwischen Proteinmolekül und Lösungsmittel. Die größere Grenzfläche führt zu einem höheren Grad an Ausschluss eines Hilfsstoffes und somit zu einem thermodynamisch unvorteilhafteren System im Vergleich zum nativen Zustand. Ein kryoprotektiver Hilfsstoff erhöht die Energiebarriere zwischen dem nativen und denaturierten Zustand einer wässrigen Proteinlösung. Da ein System immer einen möglichst niedrigen Energieinhalt anstrebt, ist der native Zustand des Proteins begünstigt, da hier die kleinste Proteinoberfläche vorliegt.
Lyoprotektoren
Lyoprotektoren stabilisieren Proteine während der Trocknung. In wässriger Lösung sind Proteine vollständig hydratisiert, so dass ihre Oberfläche mit einer Monolayer Wasser überzogen ist. Wird nun während der Trocknung diese Hydratationsschicht entfernt, so verringert sich die Ladungsdichte, und der Dissoziationszustand in wasserarmer Umgebung ändert sich. Dies kann wiederum durch Änderung der Löslichkeit zur Aggregation von Proteinmolekülen durch hydrophobe Protein-Protein-Wechselwirkungen führen. Als Lyoprotektoren werden deshalb vor allem hydrophile Substanzen wie Saccharose und Trehalose eingesetzt, die eine große Anzahl von Hydroxylgruppen besitzen und als Wasserersatz (water replacement) dienen. Beide Disaccharide zeigen bei der Gefriertrocknung ein amorphes Verhalten und sind exzellente Proteinstabilisatoren [4].
Puffer
Viele wässrige Proteinformulierungen enthalten Puffersysteme, die den pH-Wert konstant halten und damit eine Veränderung der Ladungsdichte des Proteins verhindern sollen. Generell können Puffersysteme auch gefriergetrocknet werden, allerdings ist vor allem bei pH-empfindlichen Proteinen auf die Wahl des richtigen Puffers zu achten. Der bei flüssigen Formulierungen häufig eingesetzte Phosphatpuffer zeigt beim Einfrieren aufgrund der unterschiedlichen Löslichkeitsprodukte und eutektischer Temperaturen der Puffersalze starke pH-Wertverschiebungen. NaH2PO4 ist deutlich besser löslich in Wasser mit einer eutektischen Temperatur von -9,7°C als Na2HPO4 mit einer eutektischen Temperatur von -0,5°C. Dies hat zur Folge, dass beim Abkühlen und Gefrieren zuerst Na2HPO4 auskristallisiert und dem Puffersystem damit nicht mehr zur Verfügung steht. Im Gegenzug erhöht sich die relative Konzentration an NaH2PO4 in der gefrierkonzentrierten Lösung, wodurch der pH-Wert sinkt. Diese pH-Wertänderung ist keineswegs vernachlässigbar. Deshalb sollten in der Gefriertrocknung Puffer verwendet werden, die beim Einfrieren entweder amorph bleiben oder in Bezug auf die zu erwartende pH-Verschiebung wenige Probleme bereiten. Geeignete Puffersysteme sind zum Beispiel Citrat- oder Histidin-Puffer.
Tenside
Um in der Einfrierphase eine grenzflächeninduzierte Denaturierung von Proteinen an den gebildeten Eis-Wasser-Grenzflächen zu verhindern, können in geringer Konzentration oberflächenaktive Substanzen (Tenside) zugesetzt werden. Neben einer Verbesserung der Stabilität sind sie vorteilhaft bei der Rehydratation des getrockneten Lyophylisats. Da Proteinformulierungen meist parenteral verabreicht werden, müssen Tenside verwendet werden, die auch parenteral appliziert werden können. Häufig sind dies Polysorbat 20 oder Polysorbat 80.
Weniger ist mehr …
Es gibt noch eine Reihe anderer Substanzen, die in Proteinformulierungen zur Gefriertrocknung eingesetzt werden können [4]. Dazu gehören Aminosäuren, von denen kryoprotektive (z. B. Prolin oder Glycin) oder lyoprotektive (z. B. Phenylalanin, Arginin oder Serin) Effekte beschrieben sind. Polymere wie Dextran oder Hydroxyethylstärke werden bisweilen zugesetzt, um die kritische Temperatur des Produktes während der Trocknung zu erhöhen. Eine hohe Produkttemperatur ermöglicht eine schnellere Trocknung, was aus wirtschaftlicher Sicht vorteilhaft ist. Proteinformulierungen für die Gefriertrocknung sollten aber so einfach wie möglich gehalten werden. Das bedeutet, es sollten nur die Hilfsstoffe in der Formulierung verwendet werden, die unbedingt zur Stabilisierung des Proteins benötigt werden. Tabelle 1 zeigt exemplarisch die Zusammensetzung einiger bekannter gefriergetrockneter Proteinformulierungen. |
Wirkstoff |
Handelsname (Hersteller) |
Applikation |
Formulierung |
|
|---|---|---|---|---|
Substanz |
Menge |
|||
Alteplase |
Activase®
(Genentech/Roche)
|
intravenös |
Alteplase
L-Arginin
Polysorbat 80
Phosphorsäure
|
100 mg
3,5 g
< 11 mg
1 g
|
Etanercept |
Enbrel®
(Pfizer)
|
subkutan |
Etanercept
Mannitol
Saccharose
Tromethamin
|
25 mg
40 mg
10 mg
1,2 mg
|
Interferon beta-1a |
Avonex®
(Biogen)
|
intramuskulär |
Interferon beta-1a
Humanserumalbumin
NaCl
NaH2PO4
Na2HPO4
|
33 µg
16,5 mg
6,4 mg
1,3 mg
6,3 mg
|
Trastuzumab |
Herceptin®
(Genentech/Roche)
|
intravenös |
Trastuzumab
L-Histdin HCl
L-Histidin
Trehalose
Polysorbat 80
|
440 mg
9,9 mg
6,4 mg
400 mg
1,8 mg
|
Infliximab |
Remicade®
(Janssen/MSD)
|
intravenös |
Infliximab
Saccharose
Polysorbat 80
NaH2PO4
Na2HPO4
|
100 mg
500 mg
0,5 mg
2,2 mg
6,1 mg
|
Literatur
[1] Buerger HD. Geschichte der Gefriertrocknung bis 1910. Vakuum in Forschung und Praxis 2006;Bd.18:4
[2] Bolen DW. Protein stabilization by naturally occuring osmolytes. [Buchverf.] N J Clifton. Methods in molecular biology 2001
[3] Timasheff SN. Stabilization of Protein Structure by Solvent Additives. [Buchverf.] T J Ahern und M C Manning. Stability of protein pharmaceuticals Part B: in vivo pathways of degradation and strategies for protein stabilization. s.l.: Springer, 1992
[4] Wang W. Lyophilization and development of solid protein pharmaceuticals. International Journal of Pharmaceutics 2000;Bd.203:1-60
[5] Bauer KH, Frömming KH, Führer C. Pharmazeutische Technologie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012
[6] Schwegman JJ, Hardwick LM, Akers MJ. Practical formulation and process development of freeze-dried products. Pharm Dev Technol 2005; Bd.10:2
[7] Nail S, Gatlin L. Freeze-drying: principles and practice. in: Avis A, Liebermann A. Pharmaceutical dosage forms (Vol. 2), New York: Marcel Dekker 1993
[8] Franks F. Freeze-drying of bioproducts: putting principles into practice. European Journal of Pharmaceutics and Biopharmaceutics 1998;Bd.45






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.