
- DAZ.online
- DAZ / AZ
- DAZ 35/2016
- „Macht euch die Erde ...
Feuilleton
„Macht euch die Erde untertan“
Oder: Vom nützlichen und essenziellen zum missbrauchten Phosphor
Die endlosen Diskussionen um die Zulassung von Glyphosat als „Unkrautvernichtungsmittel“ (Herbizid) und der gelegentlich zu lesende Schreibfehler Glyphosphat veranlassen mich, einmal über den Phosphor als atomaren Bestandteil von nützlichen, essenziellen und toxischen Verbindungen nachzudenken.
Wegen seiner ausgeprägten Reaktionsfähigkeit kommt Phosphor in der Natur nicht in elementarer Form vor. Entdeckt wurde der weiße Phosphor im Jahr 1669 vom Hamburger Alchimisten Hennig Brand durch Aufarbeitung von menschlichem Harn. Dies ließ vermuten, dass der Phosphor im Stoffwechsel des Menschen eine wichtige Rolle spielt. Später prägte der niederländische Physiologe Jakob Moleschott (1822 – 1893) den Satz: „Ohne Phosphor kein Gedanke.“
Tatsächlich könnte außer den Neuronen auch keine andere Zelle ohne Phosphor existieren.
Das Herbizid Glyphosat
Obwohl es für die Umwelt besser wäre, ohne Pestizide auszukommen, kann man wegen der ständig wachsenden Weltbevölkerung doch nicht auf sie verzichten. Dabei ist das Glyphosat (Roundup®), dem sogar das Bundesinstitut für Risikobewertung bei sachgerechter Anwendung Unbedenklichkeit bescheinigt, wesentlich weniger toxisch als andere Phosphor-haltige Pestizide, die allerdings überwiegend als Insektizide eingesetzt werden und daher ganz andere Wirkmechanismen aufweisen (Tab. 1) [1]. Am ehesten ist Glyphosat mit dem Herbizid Glufosinat (Basta®) vergleichbar, für das strenge Anwendungsbeschränkungen bestehen.
Pestizid |
Hersteller, Produktion ab |
LD50 Ratte, oral |
|---|---|---|
Parathion |
American Cyanamid, 1947 |
2 mg/kg |
Parathion-methyl |
Bayer, 1949 |
6 mg/kg |
Dichlorvos |
Bayer, 1951 |
56 mg/kg |
Phosphamidon |
Ciba, 1956 |
17 mg/kg |
Fenthion |
Bayer, 1958 |
250 mg/kg |
Phosfolan |
American Cyanamid, 1963 |
9 mg/kg |
Phosmet |
Stauffer, 1966 |
230 mg/kg |
Phoxim |
Bayer, 1969 |
1845 mg/kg |
Glyphosat (Abb. 1) |
Monsanto, 1971 |
4320 mg/kg |
Die in Tabelle 1 aufgeführten Verbindungen sind Ester und/oder Amide der Phosphorsäure oder der Thiophosphorsäure – mit Ausnahme von Glyphosat, einem Derivat der Phosphonsäure. Es wird im Boden von Mikroorganismen abgebaut [2]. Sein Wirkungsmechanismus beruht auf der Blockade der 5-Enolpyruvyl-shikimat-3-phosphat-Synthase (EPSPS), die in den Pflanzen (und den meisten Mikroorganismen) an der Synthese der aromatischen Aminosäuren beteiligt ist [3]. Als Grund für die Blockade wird die strukturelle Ähnlichkeit mit Phosphoenolpyruvat angenommen, dem regulären Substrat des EPSPS [4] (Abb. 1).
Gefährlicher als Glyphosat, was die Schädigung der Bienen anbelangt, sind die Neonicotinoide wie Clothianidin (Poncho®), Imidacloprid (Gaucho®) und Thiamethoxam (Cruiser®), die keinen Phosphor enthalten.
Phosphate – Gewinnung und Nutzung
Im Sinne des im Titel zitierten göttlichen Auftrags (1. Mose 1,28) handelte der berühmte Chemiker Justus Liebig mit seiner „Agrikulturchemie“ (ab 1840), die zu einer Vervielfachung der Ernteerträge führte. Liebig entwickelte aus dem wasserunlöslichen nativen Calciumphosphat ein wasserlösliches „Superphosphat“ als künstlichen Dünger. Die heute verwendeten Mehrnährstoff- oder Voll-Dünger enthalten neben Phosphat Stickstoff und Kalium in geeigneter Form. Der schon 1927 von der BASF auf den Markt gebrachte Prototyp nennt sich Nitrophoska (nach den Elementen N, P, K).
Eine wichtige Phosphatquelle war der Guano, ein „aus Exkrementen von Seevögeln bestehender organischer Dünger“, der sich vor allem auf den küstennahen Inseln Perus und Chiles im Laufe von Jahrtausenden angehäuft hat. Der heute fast ganz abgebaute Peru-Guano enthält 20 bis 30% Calciumhydrogenphosphat und 10 bis 15% gebundenen Stickstoff in Form von Harnsäure, Ammoniumsalzen und Nitraten. Die Phosphate und ein Teil der N-haltigen Verbindungen im Guano sind aus chemischer Sicht anorganisch. Die Bezeichnung „organischer Dünger“ bezieht sich auf dessen Herkunft (Exkremente von Lebewesen).
Heute werden etwa 88% der abgebauten Phosphat-Erze (Apatit, Fluorapatit, Phosphorit, Vivianit, Wavellit) für die Herstellung von Düngemitteln verbraucht. Aus dem Rest werden verschiedene Phosphate gewonnen, die z. B. in der Färberei, Metallverarbeitung und Papierfabrikation verwendet werden und in Waschmitteln, Korrosionsschutz- und Flammschutzmitteln, Zahnpasten, Backpulvern, Brühwurst, Cola-Getränken und Speiseeis enthalten sind. Allein die Liste der E-Nummern für (Lebensmittel-)Zusatzstoffe enthält neben der Phosphorsäure (E 338) acht verschiedene Phosphate (E 339, 340, 341, 343, 450, 451, 452, 541). Ferner dienen Phosphatstärken (E 1410, 1413 und 1414) in der Nahrungsmittelproduktion als Verdickungsmittel, Stabilisatoren und Trägerstoffe. Sie sind u. a. in Backwaren, Trockensuppen, Puddingpulvern, Fertiggerichten, Dressings und Soßen enthalten.
Durch die Verwendung von Phosphaten als Waschmittelzusatz (zur Enthärtung von Wasser) gelangten früher große Mengen mit den kommunalen Abwässern in Bäche, Flüsse und Seen, wo sie eine Eutrophierung und damit ein übermäßiges Wachstum von Plankton, Algen und Wasserpflanzen verursachten. Waschmittel für den deutschen Markt dürfen seit 1986 kein Phosphat mehr enthalten, was die Abwasserbelastung stark verringert hat. Der Grenzwert für Phosphat in Teichen und Seen beträgt 0,03 mg/l.
Im Bodensee liegt der Phosphatgehalt derzeit bei nur 0,006 mg/l, was sich nachteilig auf den Fischbestand und die Fischerei ausgewirkt hat.
Phosphor und Phosphate in den Arzneibüchern
Phosphorsäure und Phosphate werden auch als Arzneistoffe und vielseitig als Grund- und Hilfsstoffe bei der Arzneimittelherstellung benutzt, wie die entsprechenden Monografien der Arzneibücher zeigen. Schauen wir in das DAB 6 (Deutsches Arzneibuch, 6. Ausgabe, 1926, mit drei Nachträgen bis 1957), das in der Bundesrepublik bis 1968 gültig war, und die Ph. Eur. 8 (Europäisches Arzneibuch, 8. Ausgabe, 2014, mit zzt. sechs Nachträgen), um die Entwicklung der phosphorhaltigen Verbindungen in unserem Arzneischatz zu veranschaulichen.
Im DAB 6 waren folgende Monografien enthalten:
- Acidum phosphoricum: H3PO4
- Phosphorus: P (weiße oder gelbliche, durchscheinende, wachsähnliche Stücke)
- Phosphorus solutus: 1 Teil Phosphor, 194 Teile flüssiges Paraffin, 5 Teile Äther
- Natrium phosphoricum: Na2HPO4.
Nach DAB 6 war der Phosphor nicht nur vorsichtig aufzubewahren, es gab in den Apotheken auch einen Phosphorschrank, vergleichbar mit dem Giftschrank, mit entsprechendem Zubehör zur Verarbeitung. Phosphor wurde vor allem zur Herstellung von Rattengift benötigt, war aber auch Bestandteil von Arzneien (v. a. gegen Rachitis). Größte Einzelgabe war 0,001 g und größte Tagesgabe 0,003 g.
Monografien der Ph. Eur. 8 sind:
- Aluminiumphosphat, wasserhaltiges: AlPO4 · x H2O
- Aluminiumphosphat-Gel: Hydratisiertes AlPO4 in Gelform
- Calciumhydrogenphosphat, wasserfreies: CaHPO4
- Calciumhydrogenphosphat-Dihydrat: CaHPO4 · 2 H2O
- Kaliumdihydrogenphosphat: KH2PO4
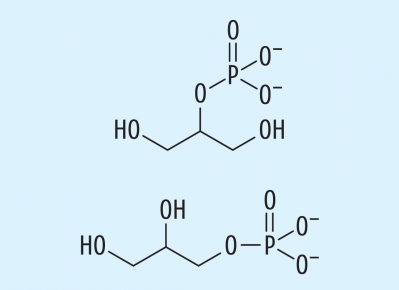
- Magnesiumglycerophosphat (Abb. 2)
- Natriumglycerophosphat, wasserhaltiges (Abb. 2)
- Natriummonohydrogenphosphat, wasserfreies: Na2HPO4
- Natriummonohydrogenphosphat-Dihydrat: Na2HPO4 · 2 H2O
- Natriummonohydrogenphosphat-Dodecahydrat: Na2HPO4 · 12 H2O
- Phosphorsäure 85%, ~ 10%: H3PO4 .
Hinzu kommen zahlreiche Phosphat-Pufferlösungen als Reagenzien.
Die Vielzahl dieser Monografien veranschaulicht die aktuelle Bedeutung der anorganischen Phosphate bei der Produktion von Arzneimitteln.
Phosphor im Organismus
Das anorganische Calciumphosphat Hydroxylapatit (Ca5[OH(PO4)3]) ist ein essenzieller Bestandteil unserer Knochen und Zähne. In den Knochen ist es zu etwa 50%, im Dentin zu etwa 70% und im Zahnschmelz zu etwa 97% enthalten. Die anderen für Lebewesen essenziellen Phosphorverbindungen sind meist organische Verbindungen:
- Phospholipide wie Phosphatidylcholine (Lecithine), Phosphatidylethanolamine und Phosphatidylserine (Kephaline), Sphingomyeline, Plasmalogene,
- Nucleotide wie die Mono-, Di- oder Triphosphate der Nucleoside Adenosin, Guanosin, Cytidin und Uridin, besonders der Energieträger Adenosintriphosphat (ATP),
- die aus Nucleotiden zusammengesetzten Nucleinsäuren DNA und RNA sowie
- das Coenzym A mit seinen Bausteinen Phosphopantothenat und Phosphopantethein.
Bei allen genannten Verbindungen handelt es sich um Phosphorsäureester (vereinfacht als Phosphate bezeichnet). Der Phosphor ist hier stets fünfwertig.
Moderne Phosphor-haltige Arzneistoffe
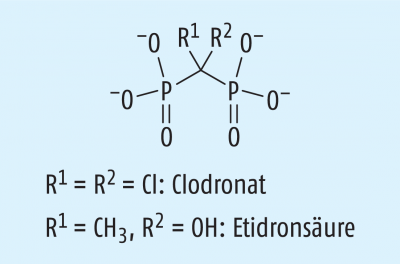
… sind ganz überwiegend organische Verbindungen (Tab. 2; eine Ausnahme bildet das Bisphosphonat Clodronat, s. Abb. 4). Derzeit ist erst etwa die Hälfte von ihnen in der Ph. Eur. 8 monografiert.
Arzneistoff (INN) |
Verbindungsart |
Bemerkungen |
|---|---|---|
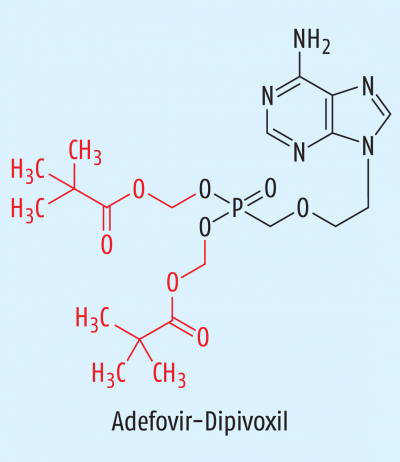
Adefovir |
Phosphonsäure-Derivat |
Virustatikum (Abb. 3) |
Bisphosphonate* |
Bisphosphonsäure-Derivate |
Osteolysehemmer (Abb. 4) |
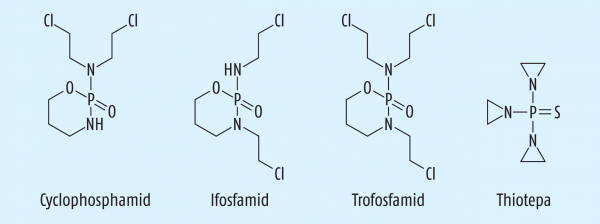
Cyclophosphamid |
Phosphorsäure-Diamid |
Zytostatikum (Abb. 5) |
Fosaprepitant |
Phosphorsäure-Amid |
Prodrug (P wird abgetrennt) |
Foscarnet |
Phosphonsäure-Derivat |
Virustatikum (Abb. 1) |
Fosfomycin |
Phosphonsäure-Derivat |
Antibiotikum (Abb. 1) |
Fosinopril |
Phosphinsäure-Derivat |
ACE-Hemmer (Abb. 6) |
Phosphestrol |
Phosphorsäure-Ester |
Prodrug (P wird abgetrennt) |
Thiotepa |
Thiophosphorsäure-Triamid |
Zytostatikum (Abb. 5) |
* Alendronat, Clodronat, Etidronat, Ibandronat, Pamidronat, Risedronat, Tiludronat, Zoledronat | ||
In den Prodrugs Fosaprepitant und Phosphestrol spielt der Phosphorsäurerest keine pharmakophore Rolle. Er optimiert lediglich die Resorption und wird danach hydrolytisch entfernt.
Zu den antiviralen Wirkstoffen gehören die Phosphoncarbonsäure Foscarnet (Abb. 1) und das Nucleotid-Analogon Adefovir-Dipivoxil (Abb. 3). Bei Letzterem werden die beiden Pivoxilgruppen (Pivaloyloxymethyl, (CH3)3C-COO-CH2) erst nach der Resorption allmählich durch Esterasen abgetrennt; dies verlängert die Halbwertszeit der Wirkform Adefovir erheblich.
(Abb. 4) verbessern die Calcium-Homöostase und die Knochendynamik. Ihre Indikationen sind postmenopausale Osteoporose, tumorinduzierte Osteolyse, Hyperkalzämie und Morbus Paget.
sind drei Phosphorsäure-Diamide mit Oxaphosphinanring – Cyclophosphamid, Ifosfamid und Trofosfamid (Abb. 5) – sowie das Thiophosphamid und Aziridin-Derivat Thiotepa (Abb. 5).
Fosfomycin (Abb. 1) ist ein Reserveantibiotikum, das als Antimetabolit von Phosphoenolpyruvat betrachtet wird.
Der ACE-Hemmer Fosinopril wird hydrolytisch zur Wirkform Fosinoprilat abgebaut, bei der die Phosphinsäuregruppe verbleibt (Abb. 6).
Der missbrauchte Phosphor
Zum einen ist der Phosphor essenziell für das menschliche Leben und kann in Form von Arzneistoffen die Lebensqualität verbessern, jedoch wird er auch in seiner elementaren Form und in der Gestalt organischer Verbindungen zur Vernichtung menschlichen Lebens missbraucht.
Schon im Ersten Weltkrieg wurde versucht, den weißen Phosphor waffentechnisch zu nutzen. Im Zweiten Weltkrieg kam er in Form von Brandbomben zum verheerenden Einsatz.
Als Nervenkampfstoffe werden verschiedene Phosphorsäure- und Phosphonsäure-Ester missbraucht, die über die Haut, über die Lunge oder Körperöffnungen in den Körper eindringen. Organophosphonate wie Tabun, Sarin, Soman wirken als irreversible Parasympathomimetika. Sie verhindern den Abbau des Acetylcholins an den Rezeptoren der Nerven durch Hemmung der Acetylcholinesterase, was zu starken Muskelkrämpfen führt und die Weiterleitung von Signalen behindert. Erinnert sei an die Sarin-Anschläge der Aum-Sekte 1994 und 1995 in Tokio [5].
Fazit: Die Verwendung von Phosphaten als Düngemittel und Lebensmittelzusatzstoffe sowie verschiedener Phosphorverbindungen als Arzneistoffe steht im Einklang mit dem Bibelzitat „Macht Euch die Erde untertan!“ Gäbe es noch ein Paradies, so müssten alle, die Phosphor und seine Verbindungen zur Vernichtung von Leben missbrauchen, daraus vertrieben werden.
Notabene: Am Phosphoreszieren der Leuchtkäfer ist kein Phosphor beteiligt!
Und sollte ein Prüfer einen Prüfling nach der Wertigkeit des Phosphors im Phosgen fragen, ist das ein hinterlistiger Scherz. |
Literatur
[1] Falbe J, Regitz M (Hrsg). Römpp Chemie Lexikon. Georg Thieme Verlag, Stuttgart 1992
[2] Giesy JP, Dobson S, Solomon KR. Ecotoxicological risk assessment for Roundup herbicide. Rev Environ Contam Toxicol 2000;167:35-120
[3] Duke SO, Powles SB. Mini-review Glyphosate: a once-in-a-century herbicide. Pest Manag Sci 2008;64:319-325
[4] Berg JM, Tymoczko JL, Stryer L. Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier, München 2007, S. 773 – 775
[5] Roth HJ. Unser täglich Gift. Hirzel Verlag, Stuttgart 2013, S. 190 – 191























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.