
- DAZ.online
- DAZ / AZ
- DAZ 34/2016
- SGLT2-Inhibitoren zur ...
Therapie
SGLT2-Inhibitoren zur Therapie des Typ-2-Diabetes
Überlegungen zum Stellenwert: Wie groß ist der Nutzen, welche Risiken gibt es?
In Deutschland sind mindestens sechs Millionen Menschen an Diabetes erkrankt, ca. 90% von ihnen an Typ‑2-Diabetes. Jährlich kommen etwa 300.000 Neuerkrankte dazu. Die Dunkelziffer der noch nicht diagnostizierten Menschen mit Typ‑2-Diabetes wird auf bis zu zwei Millionen geschätzt [1].
Ursachen des Typ‑2-Diabetes und Grundlagen der Behandlung
Der Typ‑2-Diabetes ist durch zwei wesentliche pathophysiologische Veränderungen charakterisiert: zum einen durch eine verminderte Insulinsensitivität, d. h. dass die Insulinwirkung in der Leber, dem Muskel, dem Fettgewebe und anderen Organen abgeschwächt ist (im Extremfall Insulinresistenz). Zum anderen entwickelt sich eine zunehmende Störung der Insulinsekretion der Betazellen in der Bauchspeicheldrüse. Das Hormon Insulin ist wichtig, um den Energielieferanten Glucose in die Körperzellen zu transportieren. Beide Effekte – Insulinresistenz und Insulinsekretionsstörung – werden durch Vererbung und Umwelteinflüsse (Lebensstil mit überkalorischer Ernährung und Bewegungsmangel) verstärkt; sie können individuell unterschiedlich stark ausgeprägt sein und unterschiedlich schnell fortschreiten.
Stufentherapie
Bei der Stufentherapie des Typ‑2-Diabetes, wie sie die Nationale Versorgungsleitlinie und die amerikanischen und europäischen Diabetesgesellschaften empfehlen, spielen in erster Linie die nicht-medikamentöse Maßnahmen
- Intensivierung der körperlichen Bewegung und Muskelarbeit und
- gesunde Ernährung mit Körpergewichtskontrolle
sowie die Schulung und Motivation des Patienten bezüglich dieser Maßnahmen eine sehr wichtige Rolle.
Sind die Therapieziele mit diesen Maßnahmen nicht erreichbar, kommt eine medikamentöse Therapie infrage, zunächst mit Metformin. Wenn eine Therapieeskalation notwendig ist, folgen Kombinationstherapien von Metformin mit anderen oralen Antidiabetika, injizierbaren Glucagon-like-Peptid-1-(GLP1-)Rezeptoragonisten und/oder Insulin. Pharmakologisch unterscheidet man zwischen Arzneistoffen, die
- einen günstigen Effekt auf die Insulinsensitivität haben (vor allem Metformin, auch Pioglitazon),
- die Insulinfreisetzung stimulieren (insulinotrope Substanzen) wie Sulfonylharnstoffe und Glinide sowie Dipeptidyl-Peptidase-4-(DPP4-)Inhibitoren (Gliptine) und GLP1‑Rezeptoragonisten (Inkretine) oder
- Insulin-unabhängig den Blutglucosespiegel senken: α-Glucosidase-Inhibitoren und SGLT2-Inhibitoren.
Die Therapie soll sich individuell am Patienten orientieren, d. h. dass die Glykämieparameter unter Berücksichtigung von Hypoglykämierisiko, Fähigkeiten des Patienten im Selbstmanagement der Behandlung, Lebensalter sowie Begleit- und Folgeerkrankungen individuell festgelegt werden [2 – 4].
SGLT2-Inhibitoren – eine neue Substanzklasse
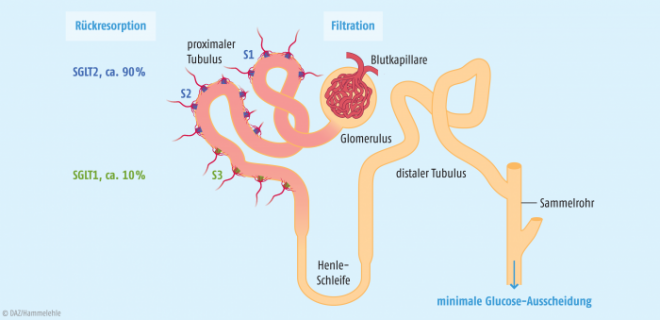
Die Natrium-Glucose-Transporter (engl. sodium glucose transporter, SGLT) sind zellmembranständige Proteine, die neben den Glucosetransportern (GLUT) die Resorption der Glucose bewerkstelligen: Es sind drei SGLT-Formen bekannt: Im Darm wird vor allem der SGLT1 exprimiert, im Tubulus der Niere der SGLT2 und in geringer Menge SGLT1. In den Glomeruli der Niere wird Glucose physiologischerweise passiv nahezu vollständig filtriert und danach im proximalen Tubulus wieder rückresorbiert. Ungefähr 90% der tubulären Glucose-Rückresorption leistet der SGLT2, den Rest der SGLT1 (Abb. 1) [5].
Bei Patienten mit Diabetes (Typ 1 und Typ 2) ist die Expression des SGLT2 hochreguliert. Die pharmakologische Hemmung des SGLT2 blockiert die Glucose-Rückresorption in den proximalen Nierentubuli. Hierdurch wird Glucose über den Urin ausgeschieden (Glucosurie), und die Glykämieparameter werden unabhängig von der Betazellfunktion oder der Insulinresistenz gesenkt.
Bereits Ende des 19. Jahrhunderts wurde die Blutzuckerspiegel-senkende Eigenschaft eines Extraktes aus der frischen Wurzelrinde des Apfelbaums beschrieben, die vorwiegend durch das darin enthaltene Glucosid Phlorizin hervorgerufen wird. Phlorizin hemmt die SGLTs allerdings unspezifisch und hat aufgrund der SGLT1-Hemmung gastrointestinale Nebenwirkungen, weshalb es nicht therapeutisch zum Einsatz kam.
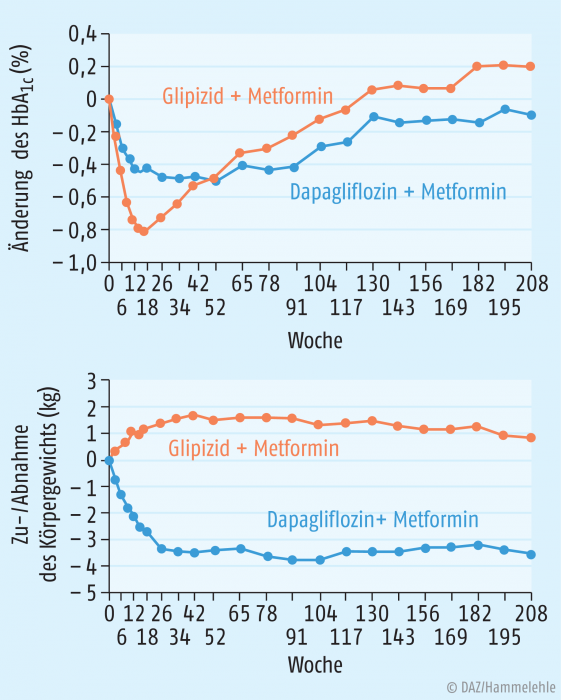
Der Wirkmechanismus der SGLT2-Inhibitoren erklärt, warum ihnen das intrinsische Hypoglykämierisiko fehlt, während sie zwei weitere wichtige Effekte haben: eine Gewichtsabnahme sowie eine Blutdrucksenkung. Durch die Behandlung werden ca. 70 bis 90 g Glucose pro Tag ausgeschieden, was einer negativen Energiebilanz von ca. 300 bis 400 kcal pro Tag entspricht. In klinischen Studien wurde daher ein Gewichtsverlust von 2 bis 3 kg beobachtet (s. Abb. 2). Die Blutdrucksenkung von 2 bis 4 mmHg systolisch wird über eine leichte Verringerung des Intravasalvolumens sowie über eine intrarenale Regulation des Blutdrucks und zusätzlich durch günstige Einflüsse auf das Renin-Angiotensin-Aldosteron-System erklärt. Die direkten glykämischen Effekte der SGLT2-Hemmer (Verminderung der chronischen Hyperglykämie und Glucosetoxizität) führen zu einer konsekutiven Verbesserung der Insulinsensitivität und der Betazellfunktion. Aufgrund ihres Insulin-unabhängigen Wirkmechanismus sind SGLT2-Inhibitoren mit allen anderen Antidiabetika und mit Insulin gut kombinierbar. In Kombination mit Insulin-abhängig wirkenden Antidiabetika zeigen sie einen annähernd additiven Effekt [6 – 8].
Als erster SGLT2-Inhibitor wurde 2012 Dapagliflozin (Forxiga®) eingeführt; ihm folgten 2013 Canagliflozin (Invokana®) und 2014 Empagliflozin (Jardiance®). Canagliflozin ist in Deutschland aufgrund gesundheitspolitisch-wirtschaftlicher Entscheidungen im Zusammenhang mit dem Arzneimittelmarktneuordnungsgesetz (AMNOG) derzeit nicht im Handel.
Bei eingeschränkter Nierenfunktion mit geringerer glomerulärer Filtrationsrate (GFR) ist auch die Wirksamkeit der SGLT2-Inhibitoren weniger stark ausgeprägt. Wenn die geschätzte GFR (eGFR) unter Berücksichtigung der Körperoberfläche (KO; 1,73 m2 entspricht einer 75 kg schweren Person) bestimmte Werte unterschreitet, wird der Einsatz von SGLT2-Inhibitoren nicht mehr empfohlen:
- eGFR < 60 ml/min × 1,73 m2/KO für Dapagliflozin,
- eGFR < 45 ml/min × 1,73 m2/KO für Canagliflozin und Empagliflozin.
Die am häufigsten auftretende unerwünschte Wirkung von SGLT2-Inhibitoren ist eine Glucosurie-bedingte Genitalinfektion, die meist zu Beginn der Behandlung auftritt. Frauen sind hierdurch stärker betroffen als Männer (in klinischen Studien ca. 6 – 8%). Die meist durch Pilze (Candida u. a.) bedingten Genitalinfektionen sind jedoch gut lokal behandelbar.
SGLT2-Inhibitoren sollten bei Patienten, die Schleifendiuretika erhalten oder einen Volumenmangel haben, nur mit Vorsicht und unter Kontrolle der Kreislaufparameter und der Nierenfunktion eingesetzt werden [8, 9].
Kardiovaskuläre Unbedenklichkeit von Empagliflozin
Die amerikanische Food and Drug Administration (FDA) hat 2008 aufgrund der kardiovaskulären Daten zu Rosiglitazon beschlossen, dass für neue Antidiabetika im Rahmen der Zulassung zeitnah die kardiovaskuläre Unbedenklichkeit nachgewiesen werden muss. Die Ergebnisse der entsprechenden Studie mit Empagliflozin (EMPA-REG OUTCOME) liegen jetzt vor. 7020 Patienten mit einem hohen kardiovaskulären Risikoprofil und länger bestehendem Typ‑2-Diabetes (> 5 Jahre bei 82% der Patienten) wurden im Mittel 3,1 Jahre lang beobachtet. Dabei war Empagliflozin der Standardtherapie (Kontrollgruppe) überlegen: Es senkte den (vorher definierten) kombinierten primären kardiovaskulären Endpunkt aus kardiovaskulärem Tod, nicht-tödlichem Herzinfarkt und nicht-tödlichem Schlaganfall signifikant um 14% (relative Risikoreduktion). Das Ergebnis wurde vor allem durch die 38%ige Senkung der kardiovaskulären Todesereignisse getrieben (s. Tab. 1). Aus den Daten errechnet sich, dass statistisch nur 39 Patienten über den Studienzeitraum von 3,1 Jahren behandelt werden mussten, um einen Todesfall zu verhindern.
Kardiovaskulärer Endpunkt |
Fälle |
in Empagliflozin-Gruppe |
in Kontrollgruppe |
HR und 95%-KI |
p-Wert |
|---|---|---|---|---|---|
kombinierter Endpunkt |
772 |
490 |
282 |
0,86 (0,74 – 0,99) |
0,0382 |
- kardiovaskulärer Tod |
309 |
172 |
137 |
0,62 (0,49 – 0,77) |
< 0,0001 |
- nicht-tödlicher Myokardinfarkt |
334 |
213 |
121 |
0,87 (0,70 – 1,09) |
0,2189 |
- nicht-tödlicher Schlaganfall |
210 |
150 |
60 |
1,24 (0,92 – 1,67) |
0,1638 |
Diese Effekte waren Glucose-unabhängig, da im Studiendesign festgelegt war, dass die Empagliflozin-behandelten Patienten und die Patienten der Kontrollgruppe eine vergleichbare Glykämiekontrolle haben sollten, um gerade den Glykämie-unabhängigen Effekt von Empagliflozin auf den kardiovaskulären Endpunkt zu prüfen. Der Unterschied zwischen beiden Behandlungsgruppen wurde schon nach wenigen Monaten sichtbar, was auf einen Glucosestoffwechsel-unabhängigen Effekt hinweist. Dies wird durch weitere Analysen der Studie unterstützt, die einen signifikant günstigen Effekt von Empagliflozin auf mikrovaskuläre Endpunkte zeigten: Die Verschlechterung der Nierenfunktion wurde um 6,1% (absolut) gesenkt (relative Risikoreduktion 39%), und die relative Risikoreduktion für ein definitives Nierenersatzverfahren betrug 55%.
Auch das Auftreten von Herzinsuffizienz wurde in der Empa-Reg-Outcome-Studie durch Empagliflozin gesenkt; dieser Befund wurde bereits in die neuen Leitlinien der Europäischen Kardiologen-Gesellschaft (ESC) aufgenommen [10 – 13]. Die zugrundeliegenden Mechanismen der kardiovaskulären und renalen Protektion von Empagliflozin sind Gegenstand umfangreicher Studien [14, 15].
Die entsprechenden Studien zur kardiovaskulären Unbedenklichkeit von Canagliflozin und Dapagliflozin sind derzeit noch nicht abgeschlossen, sodass noch unklar ist, ob es sich bei den vorteilhaften Ergebnissen der Empa-Reg-Outcome-Studie um einen isolierten Effekt von Empagliflozin oder einen Klasseneffekt der SGLT2-Inhibitoren handelt. Eine Metaanalyse von verschiedenen klinischen Studien mit SGLT2-Inhibitoren, die gepoolt betrachtet wurden, weist auf ähnliche Ergebnisse hin. Ein methodisches „Caveat“ dieser Metaanalyse ist jedoch, dass ihre Ergebnisse durch den Einschluss der relativ großen Empa-Reg-Outcome-Studie besonders beeinflusst sind [16].
Seltene unerwünschte Ereignisse: Ketoazidosen
Unter der Therapie mit SGLT2-Inhibitoren wurden sehr selten Ketoazidosen bei Patienten mit Typ‑2-Diabetes beobachtet [17], häufiger bei Menschen mit Typ‑1-Diabetes, die off-label mit einem SGLT2-Inhibitor behandelt wurden [18]. Nach der FDA hat auch die European Medicines Agency (EMA) daher eine Überprüfung von SGLT2-Inhibitoren angekündigt. Die Hersteller von SGLT2-Inhibitoren in Deutschland haben Ärzte und Apotheker im September 2015 über diesen Sachverhalt informiert.
Ein Statement der amerikanischen Endokrinologen fasst die Beobachtungen zusammen [19]: Es ist unklar, ob beim Typ‑2-Diabetes die Frequenz von Ketoazidosen unter SGLT2-Inhibitoren tatsächlich erhöht ist. Die Inzidenz ist niedrig (0,2 – 0,8 Fälle pro 1000 Patientenjahre). Bis zu 6% der Patienten mit Typ‑1-Diabetes, die im Rahmen von klinischen Studien einen SGLT2-Inhibitor erhielten, entwickelten eine Ketoazidose. Die meisten Fälle sind leider schlecht dokumentiert, und möglicherweise wurden zwar Ketonkörper gemessen, aber keine Ketoazidose dokumentiert. Zur Diagnose einer Ketoazidose bedarf es der direkten Messung von Ketonen und des arteriellen pH-Wertes. Zu beachten ist, dass Ketoazidosen auch schon bei Normoglykämie oder nur leicht ausgeprägter Hyperglykämie entstehen können. Die meisten Patienten mit nachgewiesener Ketoazidose hatten einen Insulinmangel, und fast alle Patienten befanden sich in einem katabolen Zustand (nach Operationen, Myokardinfarkt, schweren Infektionen, langem Fasten, übermäßiger körperlicher Belastung). Es wird daher empfohlen, SGLT2-Inhibitoren 24 Stunden vor einer größeren geplanten Operation sowie bei medizinischen Notfällen abzusetzen. SGLT2-Inhibitoren sollten nicht eingesetzt werden, um eine Insulintherapie abrupt zu beenden oder die Dosis des Insulins drastisch zu reduzieren. Ebenso sollten extrem kohlenhydratarme Diäten unter einer Therapie mit SGLT2-Inhibitoren vermieden werden.
Mehr Amputationen unter Therapie mit SGLT2-Inhibitoren?
Die EMA hat eine Beobachtung begonnen, um zu klären, ob die Therapie mit SGLT2-Inibitoren zu einer erhöhten Rate von Amputationen (meist Zehen) führt, nachdem in den beiden Canagliflozin-Outcome-Studien nicht-signifikant erhöhte Amputationsraten dokumentiert worden waren. Am 8. Juli 2016 hat das Pharmacovigilance Risk Assessment Committee (PRAC) der EMA die Beobachtung auf die beiden anderen SGLT2-Inhibitoren Dapagliflozin und Empagliflozin erweitert. Alle bisherigen Recherchen ergaben keine erhöhte Inzidenz von Amputationen unter SGLT2-Inhibitoren [20].
Fazit
Die SGLT2-Inhibitoren bieten durch ihren Insulin-unabhängigen Wirkmechanismus eine gute zusätzliche Therapieoption des Typ‑2-Diabetes. Dies betrifft jedes Stadium der Erkrankung und alle Therapiekombinationen. Besonders günstig sind bei einer Therapie mit SGLT2-Inhibitoren der zusätzliche blutdrucksenkende und Körpergewichts-reduzierende Effekt und das fehlende intrinsische Hypoglykämierisiko. In der Empa-Reg-Outcome-Studie konnte ein Vorteil bezüglich der kardiovaskulären Unbedenklichkeit und bezüglich mikrovaskulärer Endpunkte gezeigt werden. In einer gemeinsamen Stellungnahme haben die Deutsche Diabetes Gesellschaft (DDG), die Deutsche Gesellschaft für Innere Medizin (DGIM) und die Deutsche Gesellschaft für Kardiologie (DGK) diese Vorteile gegenüber dem Gemeinsamen Bundesausschuss im Rahmen eines Nutzenbewertungsverfahrens zur Geltung gebracht [21]. |
Literatur
[1] Tamayo T, Rathmann W. Epidemiologie des Diabetes in Deutschland. In „Deutscher Gesundheitsbericht Diabetes 2016“. Hrsg. Deutsche Diabetes Gesellschaft und DiabetesDE – Deutsche Diabetes Hilfe. Kirchheim Verlag, Mainz 2016
[2] Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Therapie des Typ-2-Diabetes – Langfassung, 1. Auflage. Version 4.2013, zuletzt geändert: November 2014
[3] Landgraf R, et al. Praxisempfehlungen DDG/DGIM. Therapie des Typ-2-Diabetes. Diabetologie 2015;10(Suppl 2):S140-S151
[4] Inzucchi SE, et al. Management of hyperglycaemia in type 2 diabetes, 2015: a patient-centred approach. Update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2015;58:429-442
[5] Wright EM. Renal Na(+)-glucose cotransporters. Am J Physiol Renal Physiol 2001;280:F10-18
[6] Wright EM, Hirayama BA, Loo DF. Active sugar transport in health and disease. J Intern Med 2007;261:32-43
[7] Scheen AJ, Paquot N. Metabolic effects of SGLT-2 inhibitors beyond increased glucosuria: A review of the clinical evidence. Diabetes Metab 2014;40(6 Suppl 1):S4-S11
[8] Nauck MA. Update on developments with SGLT2 inhibitors in the management of type 2 diabetes. Drug Des Devel Ther 2014;8:1335-1380
[9] Faillie JL. Pharmacological aspects of the safety of gliflozins. Pharmacol Res; Epub 5.7.2016
[10] Zinman B, et al; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015;373:2117-2128
[11] Fitchett D, et al; EMPA-REG OUTCOME® trial investigators. Heart failure outcomes with em-pagliflozin in patients with type 2 diabetes at high cardiovascular risk: results of the EMPA-REG OUT-COME® trial. Eur Heart J 2016;37:1526-1534
[12] Wanner C, et al; EMPA-REG OUTCOME Investigators. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375:323-334
[13] Ponikowski P, et al; The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016;37(27):2129-2200
[14] Sattar N, et al. SGLT2 Inhibition and cardiovascular events: why did EMPA-REG Outcomes surprise and what were the likely mechanisms? Diabetologia 2016;59:1333-1339
[15] Ferrannini E, Mark M, Mayoux E. CV Protection in the EMPA-REG OUTCOME Trial: A „Thrifty Substrate“ Hypothesis. Diabetes Care 2016;39:1108-1114
[16] Wu JH, et al. Effects of sodium-glucose cotransporter-2 inhibitors on cardiovascular events, death, and major safety outcomes in adults with type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2016;4:411-419
[17] Peters AL, et al. Euglycemic Diabetic Ketoacidosis: A Potential Complication of Treatment With Sodium-Glucose Cotransporter 2 Inhibition. Diabetes Care 2015;38:1687-1693
[18] Peters AL, et al. Diabetic Ketoacidosis With Canagliflozin, a Sodium-Glucose Cotransporter 2 Inhibitor, in Patients With Type 1 Diabetes. Diabetes Care 2016;39:532-538
[19] Handelsman Y, et al. American College of Clinical Endocrinologists and American College Endocrinology Position Statement on the Association of SGLT2-Inhibitors and Diabetic Acidosis. Endocr Pract 2016;22:753-762
[20] European Medicines Agency (EMA). EMA confirms recommendations to minimise ketoacidosis risk with SGLT2 inhibitors for diabetes. www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/SGLT2_inhibitors/human_referral_prac_000052.jsp&mid=WC0b01ac05805c516f
[21] Gemeinsame Stellungnahme der Deutschen Diabetes Gesellschaft (DDG), der Deutschen Gesellschaft für Innere Medizin (DGIM) und der Deutschen Gesellschaft für Kardiologie (DGK) vom 22.06.2016 zur Nutzenbewertung gemäß § 35a SGB V von Empagliflozin. www.deutsche-diabetes-gesell-schaft.de/fileadmin/Redakteur/Stellungnahmen/2016/Stellungnahme_Empagliflozin_Homepage_23.06.2016.pdf
[22] Del Prato S, et al. Long-term glycaemic response and tolerability of dapagliflozin versus a sulphonylurea as add-on therapy to metformin in patients with type 2 diabetes: 4-year data. Diabetes Obes Metab 2015;17:581-590
Interessenkonflikt
Der Autor ist in den letzten drei Jahren in Advisory Boards von AstraZeneca, Bristol-Myers Squibb, Boehringer Ingelheim, Hoffmann-La Roche, Janssen, Lilly, Novartis, Novo Nordisk und MSD tätig gewesen und hat von diesen Firmen sowie von Berlin Chemie, Sanofi und Takeda Vortragshonorare erhalten.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.