
- DAZ.online
- DAZ / AZ
- DAZ 33/2016
- Wachstumsfaktor-...
Pharmakologie
Wachstumsfaktor-Rezeptoren ausschalten
Biologicals erweitern das Arsenal im Kampf gegen Krebs
Eine Inhibition der Wachstumssignale solider Tumore ist seit über 10 Jahren in der klinischen Praxis angekommen. Die intrazelluläre Hemmung überaktivierter Signalkaskaden der Tumore durch Kinase-, zumeist Tyrosinkinase-Inhibitoren (TKI) weist eine immense therapeutische Vielfalt auf. Die Option zur extrazellulären Blockade von Wachstumsfaktor-Rezeptoren wird durch verschiedene therapeutische Antikörper sehr erfolgreich realisiert. Diese Gruppe der onkologisch eingesetzten Biologicals wurde jüngst um einen Wirkstoff erweitert.
„Hallmarks of Cancer“
Durch vielfältige Mutationen begründet können sich Tumorzellen der Homöostase der zellulären Entwicklung, also dem Gleichgewicht von Proliferation, Differenzierung und dem kontrollierten Zelltod (Apoptose) entziehen und damit die ausbalancierte Regulation eines vielzelligen Organismus durchbrechen. Dadurch unterscheiden sich maligne Tumore in verschiedenen funktionellen Aspekten von physiologischen Geweben. Diese, auch als „Hallmarks of Cancer“ bezeichneten Charakteristika [1] umfassen:
- Hemmung der Apoptose
- Metastasierungsfähigkeit
- Schutz vor Zellalterung
- Adaptierung des Energiestoffwechsels
- Resistenz gegen Wachstumshemmung
- Fähigkeit zur Gefäßneubildung (Angiogenese)
- Schutz vor immunologischer Eliminierung
- permanente Wachstumssignale
Die drei letztgenannten Aspekte wurden als neuartige Ansatzpunkte für die Tumortherapie erkannt. Neben der Angiogenesehemmung und der immunologischen Tumortherapie durch Checkpoint-Inhibitoren fokussieren die Aktivitäten auch auf das Ausschalten der Wachstumssignale. Die Hyperproliferation von Tumoren wird hauptsächlich durch Überaktivierung zellulärer Wachstumsfaktor-Rezeptoren vermittelt, die somit wichtige Zielstrukturen für eine therapeutische Intervention des Tumorwachstums darstellen.
Wachstumsfaktor-Rezeptoren
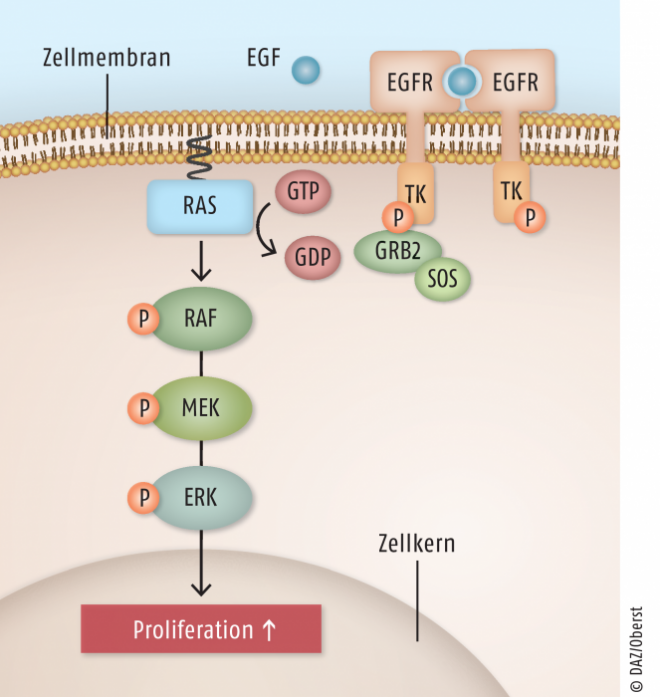
Die Proliferation von Zellen unterliegt einem hochregulativen Aktivierungsprozess transmembranärer Wachstumsfaktor-Rezeptoren und daran angeschlossenen Signalkaskaden. Binden extrazellulär vorliegende Wachstumsfaktoren (growth factors/GF) an diese Rezeptoren, wird eine intrazelluläre Signalweiterleitung durch eine Kaskade von Phosphorylierungsreaktionen (Kinasen) gestartet, in deren Ergebnis im Zellkern die Genexpression zur Vorbereitung auf Wachstum und Zellteilung anläuft. Wachstumsfaktor-Rezeptoren selbst sind Tyrosinkinasen. Für die Zellproliferation ist insbesondere der ERK-Signalweg (extracellular-signal regulated kinases) von Bedeutung, der über bestimmte Signalmoleküle (Ras, Raf-1, MEK 1/2, ERK 1/2) verläuft und die Genexpression induziert (Abb. 1).
Die für die Zellproliferation bedeutendste Rezeptorklasse stellen die epidermalen Wachstumsfaktor-Rezeptoren (epidermal growth factor receptors; EGFRs) dar. Diese sog. ErbB-Familie besteht aus vier homologen Vertretern: EGFR/HER1, HER2/c-neu, HER3 und HER4. Deren gemeinsame Liganden sind der epidermale Wachstumsfaktor/EGF sowie der transformierende Wachstumsfaktor α (TGF-α). Die Rezeptoren der ErbB-Familie sind in Tumorzellen oftmals überexprimiert oder durch autokrine, das heißt von den Tumoren selbst gebildete, Liganden überaktiviert.
Die Hemmung des EGFR 1
Der EGFR ist auf einer Vielzahl solider Tumorzellarten überaktiviert und trägt so entscheidend zur unkontrollierten Proliferation der Tumore bei. Die extrazelluläre Blockade des EGFR durch Antikörper verhindert einerseits die Ligandenbindung an den Rezeptor und dessen Dimerisierung zur Aktivierung. Andererseits induzieren die Antikörper die körpereigene Immunabwehr durch die antikörperabhängige zelluläre Zytotoxizität (ADCC) sowie durch Komplementaktivierung und tragen auch so zur Bekämpfung der Tumorzellen bei.
Cetuximab (Erbitux®). Mit Cetuximab (Merck) wurde bereits 2004 ein therapeutischer Antikörper zur Blockade des EGFR in Europa zugelassen. Cetuximab ist ein human/murin chimärer monoklonaler IgG1-Antikörper, der in murinen Myelom-Zelllinien hergestellt wird. Durch seine deutlich gegenüber den Liganden EGF sowie TGF-α erhöhte Bindungsaffinität zum EGFR vermindert er die Rezeptoraktivierung und dadurch die Zellproliferation. Gleichzeitig induziert die Antikörperbindung am Rezeptor dessen Zellinternalisierung sowie die Aktivierung der zytotoxischen Immunabwehr und des Komplementsystems. Cetuximab ist zugelassen zur Therapie erwachsener Patienten mit einem fortgeschrittenen oder metastasierten Kolorektalkarzinom in Kombination mit einer Irinotecan-basierten Chemotherapie sowie als Erst-Linien-Behandlung in Kombination mit FOLFOX (5-Fluoruracil, Folinsäure, Oxaliplatin). Cetuximab kann auch als Monotherapie bei Patienten angewendet werden, wenn die Therapie mit Oxaliplatin und Irinotecan versagt hat oder nicht vertragen wird.
Therapie mit Cetuximab
Cetuximab (Erbitux®) wird i. v. in einer Konzentration von 5 mg/ml appliziert. Die Initialdosis von 400 mg/m2 Körperoberfläche wird von wöchentlichen Applikationen von 250 mg/m2 Körperoberfläche gefolgt, kombiniert mit der entsprechenden Chemotherapie. Eine Stunde vor Verabreichung sollten die Patienten zur Verminderung infusionsbedingter Nebenwirkungen mit einem Antihistaminikum und einem Glucocorticoid vorbehandelt werden. Die wichtigste Nebenwirkung von Cetuximab ist das Auftreten von Hautreaktionen, die zum Teil sehr heftig sind und zum Unterbrechen der Therapie führen können.
Seit 2008 kann Cetuximab auch zur Behandlung von Patienten mit Plattenepithelkarzinom im Kopf- und Halsbereich in Kombination mit einer Strahlentherapie für eine lokal fortgeschrittene Erkrankung sowie in Kombination mit einer Platin-basierten Chemotherapie für eine rezidivierende oder metastasierende Erkrankung angewendet werden.
Voraussetzung der Therapie mit Cetuximab ist der immunhistochemische Nachweis der EGFR-Expression der zu behandelnden Tumore. Oftmals ist eine Überaktivierung der Signalkaskaden der Wachstumsrezeptoren mit spezifischen Mutationen einzelner Kinasen einhergehend oder durch diese bedingt. Dies spiegelt sich eindrucksvoll an der Entwicklung verschiedener TKI wider, die teilweise nur bei bestimmten mutierten Tyrosinkinasen wirken. Cetuximab aber wirkt nur bei einem nicht-mutierten Signalweg (KRAS-Wildtyp). Seit 2013 ist die Zulassung des Cetuximab explizit auf Tumore mit KRAS-Wildtyp beschränkt.
Eine Anzahl von Biosimilars des Erbitux® befindet sich in klinischer Entwicklung. So berichteten MabTech und Sorrento Therapeutics Anfang 2016 über erfolgreiche Phase-III-Studien ihres Biosimilars STI 001.
Panitumumab (Vectibix®). Panitumumab (Amgen) ist ein humaner IgG2-Antikörper gegen EGFR, der seit 2008 zur Therapie erwachsener Patienten mit metastasiertem Kolorektalkarzinom in den verschiedenen Kombinationstherapien oder als Monotherapie bei deren Versagen zugelassen ist. Panitumumab wird in Hamster-Zellen (CHO-Zellen) produziert. Wie auch bei Cetuximab sind einerseits der EGFR-Status des Tumors sowie das nicht-mutierte KRAS-Signalsystem (Rote Hand Brief 08/2013) vor Therapiestart zu bestätigen. Panitumumab weist eine höhere Affinität zur Ligandenbindungsdomäne des EGFR als Cetuximab auf. Als IgG2-Antikörper induziert es aber die körpereigene Immunabwehr deutlich schwächer.
Therapie mit Panitumumab
Die Anwendung von Panitumumab (Vectibix®) erfolgt 14-tägig als ca. einstündige i. v.-Infusion mit einer Dosierung von 6 mg/kg Körpergewicht. Wie auch bei Cetuximab sind vorrangig Hautreaktionen beschrieben, ebenfalls wurden Übelkeit, Durchfall sowie Erbrechen als häufige Nebenwirkungen berichtet.
Necitumumab (Portrazza®). Seit Februar 2016 befindet sich mit Necitumumab ein dritter EGFR-Antikörper auf dem europäischen Arzneimittelmarkt. Necitumumab ist zur Therapie des plattenepithelialen, nicht-kleinzelligen Lungenkarzinoms zugelassen und stellt somit erstmals eine zielgerichtete Therapieoption (targeted therapy) dieser mit schlechter Prognose einhergehenden Tumorerkrankung dar. Die Therapie-naiven Patienten mit einer fortgeschrittenen Erkrankung erhalten den Antikörper in Kombination mit einer Gemcitabin- oder Cisplatin-Chemotherapie. Wie die beiden vorab genannten Antikörper blockiert auch Necitumumab die Ligandenbindung am EGFR, daher muss vor Behandlungsbeginn eine Überaktivierung des EGFR im Tumor nachgewiesen werden.
Therapie mit Necitumumab
Necitumumab (Portrazza®) wird in einer Dosierung von 800 mg in einer ca. 60-minütigen i. v.-Infusion an den Tagen 1 und 8 eines dreiwöchigen Zytostatika-Zyklus appliziert. Bei Ansprechen der Therapie kann Necitumumab nach sechs Behandlungszyklen als Monotherapie weiter angewendet werden. Wie auch bei Cetuximab wird vor Infusionsbeginn eine Prämedikation mit Corticoiden, Antihistaminika und Antipyretika zur Reduzierung infusionsbedingter Reaktionen empfohlen. Als häufigste Nebenwirkungen werden Hautreaktionen, das Auftreten des Hand-Fuß-Syndroms sowie thromboembolische Ereignisse beschrieben, weshalb die Anwendung von Necitumumab bei Risikopatienten (Herzinfarkt, Schlaganfall, Embolie) abgewogen werden muss. Auch eine Erniedrigung von Elektrolytspiegeln im Serum (Magnesium, Calcium und Kalium) unter Necitumumab wurde berichtet. Necitumumab ist bei Schwangerschaft kontraindiziert.
Die therapeutische Blockade von HER2
Verschiedene Tumore epithelialen Ursprungs weisen eine Überexprimierung des EGFR2 (HER2/c-neu) auf. HER2 induziert seine proliferationsstimulierenden Signale durch eine Dimerisierung mit anderen Rezeptoren der EGFR-Familie, so dass eine verstärkte Exprimierung durch Tumore die Wahrscheinlichkeit der Dimerisierung und damit deren permanente Aktivierung fördert.
Therapeutisch bedeutsam ist die Tatsache, dass ca. 20% aller Mammakarzinome durch eine Überaktivierung dieses Rezeptors in ihrer Proliferation geprägt sind, was als Aggressivitätsfaktor und negativ prognostischer Marker gewertet wird. HER2 erweist sich also für eine ausgewählte Gruppe von Patienten als herausragendes Target. Die Blockierung von HER2 durch Antikörper wurde bereits frühzeitig in der Ära der Biologicals realisiert.
Trastuzumab (Herceptin®). Trastuzumab (Roche) ist ein humanisierter, monoklonaler IgG1-Antikörper gegen HER2, der bereits seit dem Jahr 2000 zur Behandlung von HER2-positiven Mammakarzinomen zugelassen ist. Trastuzumab wird in CHO-Zellen hergestellt. Seine Wirksamkeit beruht auf der Blockade des HER2-Signalweges sowie der Aktivierung der Antikörper-vermittelten Immunabwehr nach Bindung an der Zelloberfläche. Die Zulassung erstreckt sich auf die Behandlung von Patientinnen mit metastasiertem Mammakarzinom als Zweit-Linien-Monotherapie nach Versagen zweier Chemotherapiestrategien (Anthracyclin sowie Taxan) sowie als Erst-Linien-Therapie in Kombination mit Paclitaxel. Ebenfalls kann Trastuzumab in Kombination mit einem Aromatasehemmer zur Behandlung von postmenopausalen Patientinnen mit Hormonrezeptor-positivem Mammakarzinom angewendet werden, die noch nicht mit Trastuzumab behandelt wurden. Voraussetzung für die genannten Therapien ist der Beweis einer HER2-Aktivität der Tumore. Seit 2006 besteht auch die Zulassung für die adjuvante Behandlung der nicht-metastasierten Mammakarzinome. Im Jahr 2010 wurde Trastuzumab auch zur Behandlung des metastasierten Magenkarzinoms in Kombination mit 5-Fluoruracil sowie Cisplatin zugelassen.
Die große therapeutische Bedeutung des Trastuzumab zeichnet sich auch an den Bestrebungen zur Biosimilar-Entwicklung ab. Verschiedene Biosimilars des Herceptin® befinden sich in klinischer Entwicklung. So haben aktuell die Firmen Mylan und Biocon eine erfolgreiche Phase-III-Bioäquivalenz-Studie (HERITAGE) ihres Biosimilars MYL-14010 vorgestellt. Außerhalb Europas sind einzelne Herceptin®-Biosimilars bereits auf dem Markt.
Trastuzumab hat in zweifacher Hinsicht die Therapie des Mammakarzinoms geprägt. Die funktionelle Interferenz mit der aggressiven HER2-vermittelten Proliferation eröffnete eine neue Therapieoption und führte erstmals eine Patientenstratifizierung durch Anpassung einer sinnvollen Pharmakotherapie ein. Nichtsdestotrotz sprechen nur ca. 50% der Patientinnen ausreichend auf die Therapie an, so dass innerhalb eines Jahres eine Progression der Erkrankung zu verzeichnen ist. Bei einem Versagen von Trastuzumab zeichnen sich zwei therapeutische Alternativen ab.
Therapie mit Trastuzumab
Bei der Dosierung von Trastuzumab (Herceptin®) wird zwischen einem ein- und einem dreiwöchigen Intervall für die i. v.-Applikation aller oben genannten Therapien unterschieden:
Beim einwöchigen Regime wird eine Initialdosis von 4 mg/kg Körpergewicht gefolgt von einer wöchentlichen Erhaltungsdosis von 2 mg/kg Körpergewicht verwendet, beim dreiwöchigen Intervall wird eine Initialdosis von 8 mg/kg Körpergewicht gewählt, gefolgt von Erhaltungsdosierungen von 6 mg/kg Körpergewicht alle drei Wochen.
Seit 2013 kann Trastuzumab auch in einer 600 mg Fixdosis subkutan im dreiwöchigen Abstand appliziert werden. Das Herceptin® s.c.-Präparat enthält Hyaluronidase zur schmerzfreien Injektion in das subkutane Gewebe.
Neben infusionsbedingten lokalen Reizungen sind insbesondere kardiotoxische Effekte des Trastuzumab zu beachten. Patienten mit symptomatischer Herzinsuffizienz, Hypertonie oder Koronarer Herzkrankheit sollten einer besonderen Beobachtung unterliegen.
Trastuzumab Emtansin (Kadcyla®). Seit 2014 wird Trastuzumab auch in Form eines Antikörper-Wirkstoff-Konjugates (antibody drug conjugate, ADC) zur Therapie verwendet. Generell wird bei Antikörper-Wirkstoff-Konjugaten der Antikörper als Zielsteuerung für das Erreichen des Wirkortes genutzt, die an den Antikörper gekoppelten hochtoxischen Agenzien werden nach Aufnahme in die Zielzellen freigesetzt und tragen zur Zytotoxizität bei. Bei dem ADC Trastuzumab Emtansin (Kadcyla®) ist am HER2-Antikörper zusätzlich das hochtoxische Spindelgift Emtansin gekoppelt (durchschnittlich ca. 3,5 Moleküle pro Antikörper). Trastuzumab Emtansin ist zugelassen zur Monotherapie erwachsener Patientinnen mit einem HER2-positiven, inoperablen, lokal fortgeschrittenen oder metastasierten Mammakarzinom, die zuvor Trastuzumab oder ein Taxan erhalten hatten [2].
Trastuzumab Emtansin ergänzt also den Effekt der funktionellen Blockade des HER2 sowie die Aktivierung der Immunabwehr durch eine Beeinflussung der Zellteilung durch Interaktion des Emtansin mit dem Mitoseprozess. In einer Nutzenbewertung durch das IQWiG (04/2014) wurde dem Antikörper-Wirkstoff-Konjugat bei Behandlung von Patientinnen mit metastasiertem Mammakarzinom und nach Vorbehandlung mit Trastuzumab, Anthracyclinen sowie Taxanen ein erheblicher Zusatznutzen attestiert [3].
Die zweite therapeutische Option bei Versagen von Trastuzumab zeichnet sich durch einen anderen HER2-Antikörper ab.
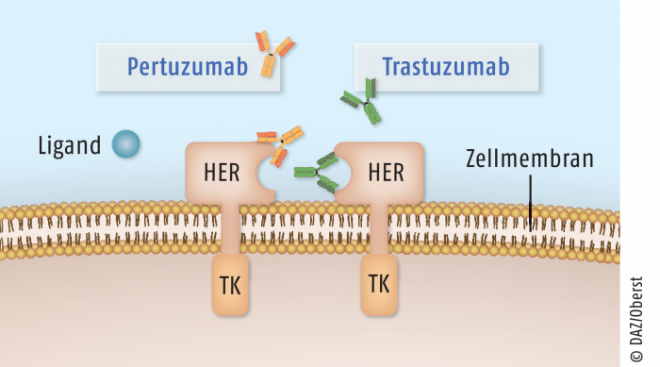
Pertuzumab (Perjeta®). Mit Pertuzumab (Roche) wurde 2013 ein weiterer HER2-Antikörper zur Therapie des Mammakarzinoms zugelassen [4]. Dieser humanisierte Antikörper unterscheidet sich allerdings in Bindungsspezifität und Wirkung vom Trastuzumab. Während Trastuzumab die Ligandenbindung an HER2 unterdrückt, verhindert Pertuzumab die Rezeptordimerisierung mit anderen Rezeptoren der EGFR-Familie und damit einen entscheidenden Aktivierungsstimulus. Zudem aktiviert Pertuzumab ebenfalls die körpereigene Immunabwehr.
Therapie mit Pertuzumab
Pertuzumab (Perjeta®) wird i. v. mit einer Initialdosis von 840 mg (Packungsgröße 420 mg) in einer Konzentration von ca. 3,4 mg/ml über 60 Minuten appliziert, gefolgt von einer Erhaltungsdosis von 420 mg im Abstand von drei Wochen. Dabei sind Diarrhö, Neutropenie, Leukopenie sowie Alopezie relativ häufig beschriebene Nebenwirkungen.
Obwohl normalerweise die Anwendung mehrerer Wirkstoffe am gleichen Target keinen therapeutischen Sinn ergibt, ergänzen sich Trastuzumab und Pertuzumab durch ihre unterschiedlichen Bindungsareale und Wirkungen ideal (Abb. 2). In der Zulassungsstudie (CLEOPATRA) bewirkte die Kombination beider Antikörper mit Docetaxel eine signifikante Verlängerung des progressionsfreien Überlebens der Patienten gegenüber der Anwendung von nur Trastuzumab und Docetaxel.
Pertuzumab ist zugelassen in Kombination mit Trastuzumab und Docetaxel zur Erst-Linien-Therapie des metastasierten HER2-positiven Mammakarzinoms.
In einer Bewertung durch das IQWiG wurde Pertuzumab (07/2013) in der Therapie des HER2-positiven Mammakarzinoms mit viszeralen Metastasen ein erheblicher Zusatznutzen zuerkannt [5].
Antikörper in der klinischen Entwicklung
Verschiedene therapeutische Antikörper zur Blockierung von Wachstumsfaktor-Rezeptoren befinden sich in der klinischen Entwicklung.
Nimotuzumab (Innokeys Pte Ltd): Der humanisierte IgG1-Antikörper gegen EGFR hat in einigen Ländern außerhalb Europas und der USA eine Zulassung zur Therapie plattenepithelialer Hals/Kopf-Tumore. In Europa und den USA erhielt Nimotuzumab den Orphan-Drug-Status zur Entwicklung als Therapeutikum zur Behandlung von Gliomen.
Sym004 (Symphogen A/S, Merck): Diese Entwicklung stellt eine Mischung zweier Antikörper mit unterschiedlichen und nicht überlappenden Bindungsepitopen am EGFR dar. Sym004 befindet sich in der klinischen Phase II zur Entwicklung als Therapeutikum plattenepithelialer Kopf/Hals-Tumore.
SAR256212 (Sanofi): Der humane Antikörper gegen den Wachstumsfaktor-Rezeptor HER3 befindet sich in verschiedenen Phase-I- und Phase-II-Studien zur Therapie unterschiedlicher solider Tumore.
CetuGEX (Glycotope GmbH): Der neuartige monoklonale Antikörper gegen EGFR weist eine optimierte voll-humane Glykosylierung auf. CetuGEX befindet sich in einer Phase-II-Studie in Kombination mit Chemotherapie im Vergleich zu Cetuximab an Patienten mit Kopf/Hals-Tumoren.
Biologicals richtig lagern
Die beschriebenen Antikörperpräparate sind wie alle rekombinanten therapeutischen Proteine zur Aufrechterhaltung ihrer Funktionalität an ihre intakte dreidimensionale Struktur gebunden. Dies stellt insbesondere Anforderungen an die richtige Lagerung hinsichtlich Temperatur und Lichtschutz. Biologicals sollen, sowohl als Lyophilisate als auch als Lösungen, bei 2 bis 8 °C gelagert werden, ein Einfrieren der Produkte mit einer resultierenden Strukturzerstörung ist zwingend auszuschließen. Dies muss in der Beratung dem Patienten verdeutlicht werden, bei Abgabe ist auf die Einhaltung der Kühlkette zu achten. Auch UV-Strahlung könnte chemisch die fragile Proteinstruktur beeinflussen, so dass die Präparate lichtgeschützt in der Originalverpackung zu lagern sind. Wässrige Proteinlösungen sollten nicht massiv geschüttelt werden, da sich Proteine als oberflächenaktive Strukturen unter Strukturänderung an der Wasser/Luft-Grenzfläche anreichern.
Wertung und therapeutischer Stellenwert
Die selektive Beeinflussung des Tumorzellwachstums durch Blockade von Wachstumsfaktor-Rezeptoren hat mit den verschiedenen Antikörperpräparaten bei der Behandlung einzelner Tumorentitäten immense Fortschritte erbracht und besitzt da einen festen therapeutischen Stellenwert. Diese Strategie bietet auch Ansatzpunkte für Synergien einer extra- und intrazellulären Hemmung der Wachstumssignale, wie die Kombination der HER2-Antikörper mit dem HER2-selektiven Tyrosinkinase-Inhibitor Lapatinib eindrucksvoll bestätigt. Antikörper zur Hemmung der Wachstumsfaktor-Rezeptoren ergänzen das Spektrum der innovativen onkologischen Strategien im entscheidenden Maße. |
Biologicals – die Zukunft
Biologicals sprießen wie Pilze aus dem Boden, sie sind teuer, und sie versprechen ungeahnte Möglichkeiten – gleichzeitig verwirren sie mit komplexen Wirkstoffbezeichnungen, mit ihrer Empfindlichkeit und unerwarteten Indikationsüberschneidungen.
Machen Sie sich vertraut mit diesen innovativen Arzneistoffen, indem Sie Grundkenntnisse zu Struktur und Herstellung aufpolieren, beispielhafte Indikationen und Targets kennenlernen und die Konsequenzen für das Handling in der Apotheke verstehen.
Biopharmazeutika liegen im Trend – daten Sie sich up!
Gerd Bendas, Martina Düfer
Update BiologicalsRekombinante Proteine und ihr therapeutischer Einsatz. Update Pharmazie. XII, 85 S., 42 farb. Abb., 2 farb. Tab., Kartoniert, ISBN 978-3-7692-6628-3
Deutscher Apotheker Verlag 2016
Einfach und schnell bestellen
Deutscher Apotheker Verlag, Postfach 10 10 61, 70009 Stuttgart
Tel. 0711 – 25 82 341, Fax: 0711 – 25 82 290
E-Mail: service@deutscher-apotheker-verlag.de
oder unter www.deutscher-apotheker-verlag.de
Literatur
[1] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011;144(5):646-674
[2] Verma S et al. EMILIA Study Group.; Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367(19):1783-1791
[3] G-BA-Nutzenbewertung von Trastuzumab Emtansin: www.iqwig.de/download/A14-01_Trastuzumab-Emtansin_Kurzfassung_Nutzenbewertung-35a-SGB-V.pdf
[4] Gemeinsam gegen HER2-positiven Brustkrebs. DAZ 2013;12:58-59
[5] G-BA-Nutzenbewertung von Pertuzumab: www.g-a.de/informationen/nutzenbewertung/65/
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.