
- DAZ.online
- DAZ / AZ
- DAZ 33/2016
- Kopfläuse im Anmarsch
Beratung
Kopfläuse im Anmarsch
Infektionsepidemiologie, Diagnose und Therapie der Pediculosis capitis
Verbreitung und Vermehrung
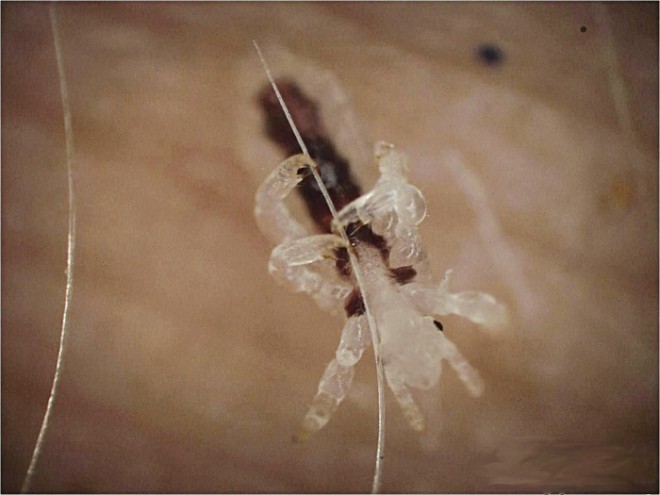
Kopfläuse (Pediculus humanus capitis) sind blutsaugende, flügellose Insekten (Abb. 1 und 2). Sie können weder fliegen noch springen und haben sich im Verlauf von mehreren Hunderttausend Jahren Koevolution zwischen Wirt und Parasit perfekt an die Kopfhaut und das Haar des Menschen angepasst. Es gibt kein Tierreservoir, der Mensch ist der einzige Wirt. Adulte Läuse leben circa drei Wochen. Jedes Weibchen produziert in dieser Zeit bis zu 300 Eier. Von der Anheftung eines Eies an ein Haar bis zur Präsenz einer fortpflanzungsfähigen Laus vergehen minimal 17 und maximal 21 Tage.
Im Gegensatz zu anderen Insekten machen Läuse nur eine inkomplette Metamorphose durch, es gibt also kein Larven- und kein Puppenstadium. Die aus dem Ei schlüpfende Nymphe sieht wie eine erwachsene Laus aus, ist nur deutlich kleiner. 99 Prozent der Nymphen schlüpfen innerhalb von sieben bis neun Tagen nach Anheftung des Eies an ein Haar, weniger als 0,1 Prozent erst nach zehn Tagen. Pedikulozide, die nicht auf Eier wirken, müssen deshalb nach acht bis neun Tagen ein zweites Mal angewandt werden, um die nachfolgende Generation von Nymphen abzutöten.
Nach dem Schlüpfen der Nymphen bleiben die leeren, weißlich erscheinenden Eihüllen (Nissen) am Haar kleben (Abb. 3 und 4). Sie entfernen sich mit dem wachsenden Haar peu à peu vom Haaransatz. Nissen sind nicht infektiös und brauchen deshalb nicht beseitigt werden. Sie stören allerdings unter ästhetischen Gesichtspunkten und führen möglicherweise zu einer Stigmatisierung des betroffenen Kindes.
Kopfläuse benötigen alle zwei bis drei Stunden Blut [31]. Sie können außerhalb des menschlichen Kopfes nur kurze Zeit überleben. Fallen sie vom Kopf, sind sie bereits nach wenigen Stunden so dehydriert, dass sie keinen Speichel mehr produzieren können, den sie benötigen, um Blut zu saugen; sie sind dann nicht mehr infektiös [31, 43].
Läuse besitzen ein simpel aufgebautes Atemwegssystem: Sie haben an jeder Längsseite sieben Atemöffnungen (Durchmesser etwa 10 μm; Abb. 2), die in winzige Luftröhren (Tracheen) übergehen. Über die Tracheen werden die Organe der Laus mit Sauerstoff versorgt und überschüssige Flüssigkeit in Form von Wasserdampf abgegeben. Das Tracheensystem ist eine Achillesferse des Parasiten.
Übertragung von Erregern
Auch in Fachkreisen ist weitgehend unbekannt, dass Kopfläuse potenzielle Überträger von hochpathogenen Bakterien sind (sie agieren also als Vektoren). Dazu gehören Rickettsia prowazekii (Erreger des klassischen Fleckfiebers), Borrelia recurrentis (Erreger des Läuserückfallfiebers) und Bartonella quintana (Erreger des Fünf-Tage-Fiebers) [13, 23]. Diese Bakterienspezies existieren in Mitteleuropa nicht bzw. sind sehr selten, kommen in Entwicklungsländern aber in unterschiedlicher Häufigkeit vor. B. quintana ist auch in den USA verbreitet. Zwischen Januar und November 2015 erkrankten 28 Flüchtlinge aus Somalia, Äthiopien und Eritrea nach ihrer Ankunft in Europa am Läuserückfallfieber. Davon wurden 15 Fälle bei in Bayern angekommenen Flüchtlingen registriert [3].
Staphylokokken und Streptokokken werden durch Kopfläuse passiv über die Kopfhaut verschleppt, z. B. nach Kontakt mit einer Eiterpustel, die infolge einer Kratzexkoriation entstanden ist [15].
Ansteckung
Die Übertragung erfolgt durch direkten Haar-zu-Haar-Kontakt. Liegen Haare von zwei Personen aneinander, können Kopfläuse rasch von dem einen Kopf auf den anderen wandern. Systematische Untersuchungen in Australien haben gezeigt, dass gemeinsam benutzte Kopfbedeckungen und Bettwäsche für die Übertragung von Kopfläusen keine Rolle spielen [42]. Selbst bei schwer infestierten Kindern mit mehr als hundert Kopfläusen ließ sich nach dem Verlassen des Bettes nur in Einzelfällen eine Kopflaus auf dem Kopfkissen nachweisen [43]. Unter infektionsepidemiologischen Gesichtspunkten sind Kopfbedeckungen und textile Oberflächen daher ohne Bedeutung [11]. Die von vielen Müttern bis zum Exzess betriebenen Hygiene- und Desinfektionsmaßnahmen sind also überflüssig. Sie verstärken nur die negativen Emotionen, die nach wie vor mit Kopflausbefall assoziiert sind.
Personen sind ansteckungsfähig, sobald sie mobile Läuse auf ihrem Kopf haben. Da bei einem Erstbefall das Leitsymptom Juckreiz erst mit einer Latenz von vier bis sechs Wochen auftritt, ist die Wahrscheinlichkeit groß, dass der Patient die Parasiten bereits auf andere Personen übertragen hat, bevor er sie an sich selbst entdeckt hat [14].
Sofort nach der Behandlung mit einem wirksamen Medikament besteht keine Ansteckungsgefahr mehr, und die Kinder können die Gemeinschaftseinrichtung wieder besuchen. Ein ärztliches Attest ist nicht erforderlich.
Krankheitszeichen
Um Blut aus den Kapillaren der Haut zu saugen, injizieren Läuse Speichel mit Antikoagulanzien in die Kopfhaut. Bislang nicht identifizierte Komponenten des Speichels induzieren eine allergische Reaktion [15]. Klinisch manifestiert sich die Immunreaktion in Form von erythematösen Papeln und Quaddeln, die intensiv jucken, insbesondere in der Nacht. Das durch den Juckreiz bedingte Kratzen der Haut verursacht Kratzexkoriationen, auf denen sich Krusten bilden. Länger bestehende Kratzdefekte werden bakteriell besiedelt und führen zu regionalen Lymphadenopathien [14]. Starker Juckreiz in der Nacht stört den Schlaf: Die Kinder sind am nächsten Tag unkonzentriert und „schlecht drauf“.
Diagnose
Krankheitszeichen entwickeln sich nur bei 14 bis 36 Prozent aller Personen mit Kopflausbefall [25]. Eine symptombasierte Diagnose ist deshalb nicht sinnvoll.
In Mitteleuropa haben befallene Kinder meist weniger als zehn Kopfläuse [25]. Je weniger Kopfläuse auf einem Kopf sind, desto schwieriger ist der Nachweis [25]. Einzig die Methode des feuchten Auskämmens hat ein hohe Empfindlichkeit [26]. Haare und Kopfhaut zu betrachten – selbst unter Zuhilfenahme einer Lupe – reicht nicht aus, um mit Sicherheit eine Pediculosis capitis auszuschließen.
Eltern, Erzieher und Lehrer sind in der Regel überfordert, eine korrekte Diagnose zu stellen: Entweder erkennen sie Nymphen, adulte Läuse oder embryonierte Eier nicht als solche und übersehen eine aktive Infestation, oder sie verwechseln ausgekämmte Artefakte mit Läusen und stellen eine falsch-positive Diagnose [34, 36].
Infektionsepidemiologie
In allen Kulturkreisen sind Mädchen deutlich häufiger betroffen als Jungen. Das Verhältnis Mädchen zu Jungen schwankt von 20 : 1 (Kolumbien) bis 2 : 1 (Mitteleuropa) [14]. Die überproportionale Häufigkeit der Pediculosis capitis bei Mädchen wird durch längere Haare und geschlechtsspezifisches Verhalten mit häufigeren und längeren Haar-zu-Haar-Kontakten erklärt. Die besonders bei weiblichen Teenagern beliebte Praxis von Selfies wird zu einer Zunahme der Pediculosis capitis in dieser Altersgruppe führen.
In Europa tritt die Pediculosis capitis in sogenannten spatio-temporalen Clustern auf, also in räumlich und zeitlich begrenzte Epidemien [14, 40]. Typisch sind Kleinepidemien in einer Familie, im Kindergarten oder in einer Schulklasse. In einer Familie sind nahezu immer mehrere, manchmal alle Kinder und auch die Erwachsenen infestiert [6]. In Ländern des globalen Südens ist die Parasitose endemisch, dort können bis zu 40 Prozent aller Kinder betroffen sein.
Auch wenn die Prävalenz in der gesamten Bevölkerung niedrig ist, ist die Zahl der jährlichen Neuerkrankungen pro 10.000 Kinder, die sogenannte Inzidenz, hoch. In Norwegen beispielsweise gab es in 36,4 Prozent der Haushalte innerhalb der letzten drei Jahre vor einer bevölkerungsbasierten Querschnittsuntersuchung einen Fall von Pediculosis capitis, während die – in der Querschnittsstudie bestimmte – Prävalenz nur 1,6 Prozent betrug [40]. In einer anderen Studie betrug die Häufigkeit in der Kinderpopulation 1,7 Prozent; gleichwohl hatten sechs Prozent der Kinder in den vorausgehenden drei bis sechs Monaten und 50 Prozent vor dem zwölften Lebensjahr bereits einmal Kopfläuse gehabt [6]. Diese Zahlen spiegeln die hohe Inzidenz von Kopflausbefall wider.
Beobachtungen in Großbritannien, Norwegen und Deutschland deuten darauf hin, dass Epidemien in Einrichtungen dann persistieren bzw. immer wieder aufflammen, wenn unerkannte symptomlose Träger von Kopfläusen in der Familie, im Freundeskreis oder in der Einrichtung vorhanden sind, die die bereits behandelten Kinder erneut anstecken [7, 31]. Diese Beobachtungen werden durch Computersimulationen untermauert [30]. Alternativ werden Kopfläuse durch Besucher oder Gäste mit einer unbehandelten Pediculosis capitis erneut in die Einrichtung bzw. Familie eingeschleppt [7].
Therapie
Bis auf wenige Ausnahmen ist die Datenlage zur Wirksamkeit von Pedikuloziden nicht ausreichend [16]. Häufig ist weder das postulierte Wirkprinzip durch adäquate In-vitro-Studien nachgewiesen, noch wurden randomisierte, kontrollierte und verblindete Studien durchgeführt – und falls doch, wurden die Ergebnisse nicht in internationalen begutachteten Fachzeitschriften publiziert [15, 18].
Vom Einsatz neurotoxisch wirksamer Pedikulozide auf der Basis von Pyrethroiden und Organophosphaten wird abgeraten [16]. Der massenhafte Einsatz dieser Substanzen hat weltweit zur Entwicklung resistenter Parasitenpopulationen geführt [5, 12, 24, 27, 28]. In Großbritannien beispielsweise sank die Wirksamkeit von Permethrin von 97 Prozent in den 1990er-Jahren auf 13 Prozent in 2013 [16]. Gegen den Einsatz von neurotoxisch wirkenden Pedikuloziden sprechen noch weitere Argumente:
- Pyrethroide werden über die Haut resorbiert [45]. Dies wird unter toxikologischen Gesichtspunkten als bedenklich betrachtet [41].
- Pyrethrum und Pyrethroide können eine Allergie auslösen bzw. eine existierende Allergie auf Chrysanthemen verstärken [2].
- Werden die Produkte akzidentell über den Mund aufgenommen, sind neurologische Komplikationen wie Paralyse und Polyneuropathie möglich [2].
- Sie erhöhen möglicherweise das Erkrankungsrisiko für Leukämie [33].
Pflanzliche Präparate
Für die meisten pflanzlichen Kopflausmittel gibt es keine adäquaten Studien zur Wirksamkeit und Verträglichkeit. Von insgesamt acht in Australien und Brasilien zugelassenen pflanzlichen Pedikuloziden, die in In-vitro-Studien getestet wurden, zeigte nur eines eine akzeptable Wirkung gegen Kopfläuse [4, 19]. Vom deutschen Markt seien zwei Produkte genannt (Tab. 1):
- Licener®, ein Shampoo auf der Basis eines Neemsamenextrakts (Azadirachta indica), zeigte in In-vitro-Studien eine gute adultizide und ovizide Wirkung [1, 20, 32]. Bisher fehlt jedoch der Wirksamkeitsbeleg durch eine randomisierte, kontrollierte und verblindete Studie.
- Paranix® ist ein Kombinationsprodukt aus Kokosöl, Anisöl und Ylang-Ylang-Öl. Die Wirksamkeit wurde in einer klinischen Studie belegt.
Produkt |
Inhaltsstoffe |
Wirkprinzip nachgewiesen? |
Wirksamkeit nachgewiesen gegen |
|
|---|---|---|---|---|
adulte Läuse? |
Eier? |
|||
Licener®
|
Neem-Extrakt, Hilfsstoffe |
ja: in vitro |
ja: in vitro |
ja: in vitro |
Paranix®
|
Kokosnussöl, Anisöl, Ylang-Ylang-Öl, Isopropanol |
nein |
ja: in vitro und durch RCT |
nein |
Dimeticon-haltige Präparate
Eine neue Generation von Pedikuloziden enthält Dimeticone und wirkt rein physikalisch [17, 18]. Dimeticone mit adäquaten physiko-chemischen Eigenschaften überziehen in kurzer Zeit mikroskopisch feine Oberflächen. Sie breiten sich über den Chitinkörper der Laus aus, dringen in das Tracheensystem ein und verdrängen dort den Sauerstoff, den der Parasit zum Atmen benötigt (Abb. 5) [8, 37]. Der rasche Wirkungseintritt und das physikalische Wirkprinzip der Dimeticone machen die Entwicklung resistenter Parasitenpopulationen extrem unwahrscheinlich [17]. Dimeticone sind biochemisch inert und werden nach oraler Aufnahme oder Applikation auf der Haut nicht resorbiert. Sie gelten als sicher untoxisch [35].
Die derzeit in Deutschland auf dem Markt befindlichen Dimeticon-haltigen Pedikulozide sind in der Tabelle 2 zusammengefasst. Alle Produkte sind als Medizinprodukte zugelassen. Sie enthalten verschiedene Dimeticone einzeln oder in Kombination, die sich in der Kettenlänge und in den physiko-chemischen Eigenschaften wie Viskosität und Benetzbarkeit unterscheiden. Weitere Unterschiede betreffen die Konzentration der Dimeticone, den Zusatz von Lösungsmitteln bzw. mineralischen Ölen sowie die Beimischung von z. B. Pflanzenölen, die ihrerseits eine pedikulozide Wirkung haben können.
Produkt |
Inhaltsstoffe |
Wirkprinzip nachgewiesen? |
Wirksamkeit nachgewiesen gegen |
|
|---|---|---|---|---|
adulte Läuse? |
Eier? |
|||
mosquito® med Läuse-Shampoo 10 |
Mineralöl, Aufschäumungsbestandteil, Parfüm |
ja: in vitro |
ja: durch RCT |
nein |
mosquito® dimed Läuse Haar-Fluid |
Dimeticon, Mineralöl |
nein |
nein |
nein |
Linicin®
|
Dimeticone, Vitamin E, Mandel- und Aprikosenkernöl |
nein |
nein |
nein |
Dimet 20®
|
Dimeticon, Dodecanol, Isopropanol |
nein |
nein |
nein |
Jacutin® Pedicul Fluid |
Dimeticon |
ja: in vitro |
nein |
ja: in vitro |
EtoPril® / Hedrin®
|
Dimeticon, Cyclomethicon |
ja: in vitro |
ja: in vitro und durch RCT |
unwirksam |
Nyda®
|
zwei Dimeticone mit unterschiedlicher Viskosität |
ja: in vitro |
ja: in vitro und durch RCT |
ja: in vitro |
Nur für die Produkte Nyda® und EtoPril/Hedrin® liegen publizierte Daten von lege artis durchgeführten Studien (randomisiert, kontrolliert, verblindet) vor. Nyda® zeigte eine klinische Wirksamkeit von 97%, bei EtoPril® schwankte die Wirksamkeit zwischen 70% und 92% in Abhängigkeit vom Studienort [9, 10, 21, 29]. Für Nyda® ist in In-vitro-Studien eine hohe ovizide Wirkung belegt: 98% auf reife Eier und 100% auf junge Eier [22, 44]. EtoPril®/Hedrin® hat dagegen keine Wirkung auf Eier.
Die Studien belegen, dass Dimeticon-haltige Produkte nicht per se eine hohe Wirksamkeit auf Läuse und Eier haben, sondern dass es auf die physiko-chemischen Eigenschaften des jeweiligen Dimeticons bzw. der Dimeticonkombination ankommt.
Dimeticone, die sowohl eine hohe Wirkung gegen adulte Läuse als auch auf Eier haben, brauchen theoretisch nur einmal angewandt zu werden. Gleichwohl empfehlen die Hersteller (basierend auf den Empfehlungen des Robert Koch-Instituts) eine zweite Anwendung nach acht bis zehn Tagen.
Unter infektionsepidemiologischen Gesichtspunkten ist es sinnvoll, Kontaktpersonen des Patienten – in der Familie, im Spielkreis, im Kindergarten usw. – ebenfalls mit einem adultizid und ovizid wirkenden Dimeticon zu behandeln. Die Behandlung muss synchron, also am gleichen Tag erfolgen. Wird dieses Prinzip konsequent durchgeführt, wird es langfristig zur Eliminierung der Parasiten aus der Kinderpopulation kommen.
GKV-Erstattung?
Laut Beschluss des Gemeinsamen Bundesausschusses werden einige Dimeticon-haltige Medizinprodukte (Dimet® 20, EtoPril®,Nyda®) zur Behandlung einer Pediculosis capitis bei Kindern bis zum vollendeten zwölften Lebensjahr (und bei Kindern mit Entwicklungsstörungen bis zum 18. Lebensjahr) durch die gesetzliche Krankenversicherung erstattet. Auch eine Kombination aus Anisöl, Kokosöl und Ylang-Ylang-Blütenöl (Paranix® ohne Nissenkamm) steht in der Übersicht der verordnungsfähigen Medizinprodukte (Anlage V der Arzneimittel-Richtlinie, Stand 26. Juli 2016) Das Apothekenteam kann also im Bedarfsfall einem Patienten empfehlen, ein Kassenrezept beizubringen, um die Behandlungskosten für die betroffene Familie zu senken. |
Literatur
[1] Abdel-Ghaffar F, Semmler M. Efficacy of neem seed extract shampoo on head lice of naturally infected humans in Egypt. Parasitol Res 2007;100:329-32
[2] (anonym). Behandlung von Kopfläusen. arznei-telegramm 2006;37:79-83
[3] Antinori S, et al. Louse-borne relapsing fever among East African refugees in Europe. Travel Med Infect Dis 2016;14(2):110-4
[4] Asenov A, et al. Efficacy of chemical and botanical over-the-counter pediculicides available in Brazil, and off-label treatments, against head lice ex vivo. Int J Dermatol 2010;49:324-30
[5] Bailey AM, Provic P. Persistent head lice following multiple treatments: evidence for insecticide resistance in Pediculus humanus capitis. Australasian J Dermatol 2000;41:250-54
[6] Birkemoe T, et al. Head lice predictors and infestation dynamics among primary school children in Norway. Fam Pract 2016;33(1):23-9
[7] Burgess, IF. Human lice and their management. Adv Parasitol 1995;36:271-342
[8] Burgess IF. The mode of action of dimeticone 4% lotion against head lice, Pediculus capitis. BMC Pharmacol 2009;9:3
[9] Burgess IF, Brown CM, Lee PN. Treatment of head louse infestation with 4% dimeticone lotion: randomised controlled equivalence trial. Br Med J 2005;330:1423-26
[10] Burgess IF, Lee PN, Matlock G. Randomised, controlled, assessor blind trial comparing 4% Dimeticone lotion with 0.5% Malathion liquid for head lice infestation. PLoS ONE 2007:e1127
[11] Canyon DV, Speare R. Indirect transmission of head lice via inanimate objects. Open Dermatol J 2010;4:72-76
[12] Durand R, et al. Detection of pyrethroid resistance gene in head lice in schoolchildren from Bobigny, France. J Med Entomol 2007;44:796-97
[13] Feldmeier H. Lice as vectors of pathogenic microorganisms. In: Heukelbach J (ed). Management and Control of Head Lice Infestation. Bremen, 2010
[14] Feldmeier H. Pediculosis capitis: New insights into epidemiology, diagnosis and treatment. Eur J Clinic Microbiol Infect Dis 2012;31:2105-10
[15] Feldmeier H, Jahnke C. Pediculosis capitis. Epidemiologie, Diagnose und Therapie. Pädiat Prax 2010;76:359-70
[16] Feldmeier H. Treatment of Pediculosis Capitis: A Critical Appraisal of the Current Literature. Am J Clinic Dermatol 2014;15:401-12
[17] Heukelbach J, et al. Dimethicone-Based Pediculocides: A Physical Approach to Eradicate Head Lice. Open Dermatol J 2010;4:77-81
[18] Heukelbach J. Kopflausmittel mit physikalischen Wirkprinzipien. Dtsch Apoth Ztg 2011;151(36):60-65
[19] Heukelbach J, et al. In vitro efficacy of over-the-counter botanical pediculicides against the head louse Pediculus humanus var. capitis based on a stringent standard for mortality assessment. Med Vet Entomol 2008;22:262-74
[20] Heukelbach J, Oliveira FAS, Speare R. A new shampoo based on neem (Azadirachta indica) is highly effective against head lice in vitro. Parasitol Res 2006;99:353-56
[21] Heukelbach J, et al. A highly efficacious pediculocide based on dimeticone: Randomized observer blinded comparative trial. BMC Infect Dis 2008;8:115
[22] Heukelbach J, et al. Ovicidal efficacy of high concentration dimeticone: A new era of head lice treatment. J Am Acad Dermatol 2011;64:e61-e62
[23] Houhamdi L, Parola P, Raoult D. Les poux et les maladies transmises à l‘homme. Médecine Tropicale 2005;65:1-11
[24] Hunter JA, Barker SC. Susceptibility of head lice (Pediculus humanus capitis) to pediculicides in Australia. Parasitol Res 2003;90:476-78
[25] Jahnke C, Bauer E, Feldmeier H. Pediculosis capitis im Kindesalter: Epidemiologische und sozialmedizinische Erkenntnisse einer Reihenuntersuchung von Schulanfängern. Gesundheitswesen 2008;70:667-73
[26] Jahnke C, et al. Accuracy of diagnosis of pediculosis capitis: visual inspection versus wet combing. Arch Dermatol 2009;145:309-13
[27] Kasai S, et al. Prevalence of kdr-like mutations associated with pyrethroid resistance in human head louse populations in Japan. J Med Entomol 2009;46:77-82
[28] Kristensen M, et al. Survey of permethrin and malathion resistance in human head lice populations from Denmark. J Med Entomol 2006;43:533-38
[29] Kurt O, et al. Treatment of head lice with dimeticone 4% lotion: comparison of two formulations in a randomised controlled trial in rural Turkey. BMC Public Health 2009;9:441
[30] Laguna MF, Risau-Gusman S. Of Lice and Math: Using Models to Understand and Control Populations of Head Lice. PLoS ONE 2011;6:e21848
[31] Mehlhorn H. Die Kopflaus – das unbekannte Wesen. Allgemeinarzt 2005;15:46-49
[32] Mehlhorn H, et al. Ovicidal effects of a neem seed extract preparation on eggs of body and head lice. Parasitol Res 2011;109:1299-302
[33] Menegaux F, et al. Household exposure to pesticides and risk of childhood acute leukaemia. Occup Environ Med 2006;63:131-34
[34] Mumcuoglu KY, et al. International guidelines for effective control of head louse infestations. J Drugs Dermatol 2007;6:409-14
[35] Nair B. Final report on the safety assessment of stearoxy dimethicone, dimethicone, methicone, amino bispropyl dimethicone, aminopropyl dimethicone, amodimethicone, amodimethicone hydroxystearate, behenoxy dimethicone, C24-28 alkyl methicone, C30-45 alkyl methicone, C30-45 alkyl dimethicone, cetearyl methicone, cetyl dimethicone, dimethoxysilyl ethylenediaminopropyl dimethicone, hexyl methicone, hydroxypropyldimethicone, stearamidopropyl dimethicone, stearyl dimethicone, stearyl methicone, and vinyldimethicone. Int J Toxicol 2003;22:11-35
[36] Pollack RJ, Kiszewski AE, Spielman A. Overdiagnosis and consequent mismanagement of head louse infestations in North America. Pediatr Infect Dis J 2000;19:689-93
[37] Richling I, Böckeler W. Lethal effects of treatment with a special dimeticone formula on head lice and house crickets (Orthoptera, Ensifera: Acheta domestica and Anoplura, Phthiraptera: Pediculus humanus). Arzneim-Forsch/Drug Res 2008;58:248-54
[38] Richter J, et al. Kopfläuse – Umgang mit einer wieder auflebenden Parasitose. Dtsch Ärztebl 2005;36:1909-12
[39] Rukke BA, et al. Head Lice in Norwegian Households: Actions Taken, Costs and Knowledge. PLoS ONE 2012;7:e32686
[40] Rukke BA, et al. Head lice prevalence among households in Norway; importance of spatial variables and individual and household characteristics. Parasitology 2011;138:1296-1304
[41] Sendzik J, Stahlmann R. Arzneimittel gegen Kopflausbefall. Toxikologie und Wirksamkeit. Med Monatsschr Pharm 2005;28:167-72
[42] Speare R, Buettner PG. Head lice in pupils of a primary school in Australia and implications for control. Int J Dermatol 1999;38:285-90
[43] Speare R, Cahill C, Thomas G. Head lice on pillows, and strategies to make a small risk even less. Int J Dermatol 2003;42:626-29
[44] Strycharz JP, et al. Ovicidal Respone of NYDA formulations on the human head louse (Anoplura: Pediculidae) using a hair tuft bioassay. J Med Entomol 2012;49:336-42
[45] Tomalik-Scharte D, et al. Dermal absorption of permethrin following topical administration. Eur J Clin Pharmacol 2005;61:399-404
Zu diesem Beitrag wurde in DAZ 2016, Nr. 36, S. 80 der nachfolgende Leserbrief mit der Antwort des Autors veröffentlicht:
Kopfläuse: Dimet® 20 in klinischer Studie
Sehr geehrter Herr Prof. Feldmeier,
als ein führender Experte bei Pediculosis capitis veröffentlichen Sie regelmäßig Beiträge zur Diagnostik und Therapie bei Kopflausbefall. Als spezialisiertes Unternehmen der Kinderheilkunde verfolgen wir natürlich Ihre Veröffentlichungen mit Interesse und können Ihre Bewertung unseres Kopflausmittels Dimet® 20 in Ihrem neuesten Artikel „Kopfläuse im Anmarsch“ wissenschaftlich in keiner Weise nachvollziehen.
Laut Ihres Artikels liegen zu Dimet® 20 keine Daten von lege artis durchgeführten Studien vor. Lege artis definieren Sie mit randomisiert, kontrolliert und verblindet. Dieser Aussage müssen wir widersprechen. Wie Sie zu Recht erwähnen, ist Dimet® 20 erstattungsfähig bis zwölf Jahre. Dies setzt unabdingbar voraus, dass eine Studie nach den wissenschaftlichen Regeln und Grundsätzen der wissenschaftlichen Forschung durchgeführt und dem Gemeinsamen Bundesausschuss (G-BA) vorgelegt wurde, die nach „ihrer Methodik internationalen Standards entspricht“ und eine positive Nutzenbewertung nach Auswertung des „relevanten wissenschaftlichen Erkenntnismaterials“ erfolgte [1]. Nichtsdestotrotz sprechen Sie unserem Präparat eine nachgewiesene Wirksamkeit ab.
Die vom G-BA akzeptierte und über die G-BA-Homepage öffentlich zugängliche Studie [2] wird von Ihnen nicht berücksichtigt. Dabei handelt es sich um eine randomisierte, Untersucher-verblindete In-vivo-Studie zwischen einem von Ihnen als wirksam eingestuften Referenzprodukt und Dimet® 20. Die Anwendung beider Präparate erfolgte entsprechend dem empfohlenen Schema des Robert Koch-Instituts, wobei die vom jeweiligen Hersteller genannte Einwirkzeit beachtet wurde. Dimet® 20, das Produkt mit in Ihren Augen fehlendem Wirksamkeitsbeleg, konnte zum Studienende bei 100% der Patienten Lausfreiheit erreichen, während das Referenzprodukt, das von Ihnen als nachgewiesen wirksam eingestuft wird, nur bei 92,3% wirksam war. Das Ergebnis für Dimet® 20 konnte, anders als in allen anderen In-vivo-Untersuchungen mit Dimeticon-haltigen Produkten, bereits nach 20 Minuten Einwirkzeit erreicht werden. Die von Ihnen aufgeführten In-vivo-Untersuchungen für Nyda® und EtoPril® erfordern eine achtstündige Einwirkdauer [3, 4, 5]. Es ist für uns nicht ersichtlich, warum die vorliegenden öffentlich zugänglichen wissenschaftlichen Studiendaten zu Dimet® 20 nicht in Ihrer Publikation berücksichtigt wurden und so ein sachlich und wissenschaftlich falscher Eindruck vermittelt wird. Wir können nur vermuten, dass handwerkliche Fehler, insbesondere eine mangelnde Literaturrecherche, den Ausschlag gaben.
Die Tabelle fasst die korrekten Daten zu Dimet® 20 und der von Ihnen zitierten erstattungsfähigen Dimeticonpräparate und Daten zusammen.
Produkt |
Inhaltsstoffe |
erstattungsfähig bis zwölf Jahre |
Einwirkzeit |
Wirksamkeit nachgewiesen gegen |
|
|---|---|---|---|---|---|
adulte Läuse? |
Eier? |
||||
Dimet® 20[2, 6]
|
Dimeticon, Dodecanol |
ja |
20 Minuten |
ja: in vitro und RCT |
ja: in vitro |
Nyda® [3]
|
Dimeticone |
ja |
8 Stunden |
ja: in vitro und RCT |
ja: in vitro |
EtoPril® / Hedrin® (4, 5)
|
Dimeticon, Cyclomethicon |
ja |
8 Stunden |
ja: in vitro und RCT |
unwirksam |
RCT = randomisierte kontrollierte verblindete Studie |
|||||
Dimeticon-Präparate unterscheiden sich in ihrer Einwirkdauer,
einer oviziden Wirkung und in ihren physikalischen Parametern wie der
Brennbarkeit, aber nicht – wie Sie richtigerweise im Abschnitt
„Dimeticon-haltige Präparate“ ausführen – in ihrem Wirkmechanismus auf
die Läuse. Die Studie zu Dimet® 20 erfüllte die strengen
Maßstäbe des G-BA, erzielte in einem Vergleich zu einem von Ihnen als
wirksam anerkannten Präparat sehr gute Ergebnisse und liefert bei einer
objektiven Beurteilung eindeutige Wirksamkeitsbelege. Zusammenfassend
möchten wir daher anmerken, dass mit Dimet® 20 ein geeignetes
Präparat zur Behandlung des Kopflausbefalls zur Verfügung steht, dessen
Wirksamkeit nachgewiesen ist und deshalb von den Krankenkassen
erstattet wird.
Dr. Markus Rudolph, Geschaftsführer Pädia GmbH
Literatur
[1] Verfahrensordnung des Gemeinsamen Bundesausschusses, in der Fassung vom 18. Dez. 2008.
[2] https://www.g-ba.de/informationen/beschluesse/1175/
[3] Heukelbach J, et al. A highly efficacious
pediculicide based on dimeticone: Randomized observer blinded comparative trial. BMC lnfect Dis 2008;8:115
[4]
Burgess IF, et al. Randomised, Controlled, Assessor Blind Trial
Comparing 4% Dimeticone Lotfon with 0,5% Malathion Liquid for Head Louse
lnfestation. PLoS ONE 2007:e1127
[5] Burgess IF, et al. Treatment
of head louse infestation with 4% dimeticone Iotion: randomised
controlled equivalence trial. Br Med J 2005;330: 1426-26; d) Kurt 0, et
al. Treatment of head lice with dimeticone 4% Iotion: comparison oftwo
formulations in a randomised controlled trial in rural Turkey. BMC
Public Health 2009;9:441
[6] http://www.ipqr.de/dimet20-2
Antwort des Autors
Herr Dr. Rudolph bemängelt, dass die Wirksamkeit des Dimeticon-haltigen Produkts Dimet® 20 nicht richtig beurteilt würde.
1.
Nach international anerkannten Prinzipien gelten die Ergebnisse einer
klinischen Studie erst dann als evidenzbasiert und zitierfähig, wenn die
Studie in einer wissenschaftlichen Fachzeitschrift veröffentlicht
wurde. Vor einer Veröffentlichung lässt der Herausgeber der
Fachzeitschrift das eingereichte Manuskript durch Gutachter prüfen. Das
Prinzip Begutachtung vor Veröffentlichung wird aus gutem Grund weltweit
eingesetzt, denn nur so ist gewährleistet, dass nur Daten von lege artis
durchgeführten Studien veröffentlicht werden, und die betreffende
therapeutische Maßnahme als evidenzbasiert zitiert werden kann.
Der
große Anteil von Gutachtern abgelehnter Manuskript-Einreichungen zeigt,
dass die Autoren von klinischen Studien häufig falsche
Schlussfolgerungen über die Wirksamkeit der von ihnen untersuchten
Therapie ziehen, insbesondere wenn die Studie vom Hersteller selbst
durchgeführt wurde, wie es bei der von Dr. Rudolph genannten
Untersuchung über die Wirksamkeit von Dimet® 20 der Fall war.
Aus den o. g. Gründen ist in der Tabelle 2 (des Beitrags in DAZ Nr. 33)
mit dem Titel „Pedikulozide auf Dimeticon- oder Mineralöl-Basis mit
lege artis durchgeführten Studien und publizierten Daten zum Wirkprinzip
bzw. zur Wirksamkeit“ die vorhandene Evidenz für jedes einzelne Produkt
dokumentiert. Da die Studie zu Dimet® 20 nicht publiziert, sondern nur
auf der Internetseite des Herstellers nachlesbar ist, steht deshalb in
der Spalte vier mit Recht „Nein“. Aus dem gleichen Grund wird die Studie
zu Dimet® 20 auch nicht in aktuellen systematischen Übersichtsartikeln in führenden Fachzeitschriften gelistet [1, 2].
2.
Ein Charakteristikum von Therapiestudien bei der Pediculosis capitis
ist, dass die Methode, die zur Bestimmung des Therapieerfolgs eingesetzt
wird, nämlich das nasse Auskämmen des Haares mit einem Läusekamm,
gleichzeitig eine therapeutische Wirkung hat [3]. Das bedeutet, je
häufiger nach der Anwendung eines Pedikulozids das Haar ausgekämmt wird,
desto wahrscheinlicher ist, dass am Ende einer Studie keine Laus mehr
auf dem Kopf zu finden ist.
In dem Studienprotokoll zu Dimet®
20 heißt es auf Seite 17 – 18: „Die Patienten erhielten zusätzlich noch
einen Nissenkamm, der nach Gebrauchsinformation von Dimet®
20 anzuwenden war“. In der Gebrauchsinformation wird die Anwendung wie
folgt präzisiert: „Nasses Auskämmen am Tag 1, 5, 9 und 13. Am 17. Tag
eventuell nochmals eine Kontrolle durch nasses Auskämmen durchführen.“
Daraus resultiert, dass bei den Patienten in der Dimet®
20-Gruppe mindestens vier Mal, möglicherweise sogar fünf Mal Läuse mit
einem Nissenkamm entfernt wurden, in der Kontrollgruppe jedoch nicht ein
einziges Mal. Es ist offensichtlich, dass die Wirksamkeit von Dimet®
20 bei einem derartigen Studiendesign nicht beurteilt werden kann, weil
unbekannt ist, welchen Anteil das nasse Auskämmen und welchen Anteil
das Dimeticon-Produkt an der „Heilungsrate von 100%“ hatte. Die Autoren
der Studie waren sich der Problematik offensichtlich bewusst, denn sie
schreiben auf Seite 17: „Gemäß Herstellerangaben ist EtoPril® ohne
Anwendung eines Nissenkamms wirksam.“
Die von Dr. Rudolph genannte
Studie ist somit ein Musterbeispiel dafür, wie durch gezielte Eingriffe
in das Studiendesign zwangsweise eine hohe Wirksamkeit in der
Verumgruppe „berechnet“ werden kann. Man kann nur vermuten, dass den
Autoren der Studie der systematische Fehler im Studiendesign bekannt war
und deshalb auf eine Publikation der Daten verzichtet wurde.
3.
Die von Dr. Rudolph gemachte Aussage „Dimeticon-Produkte unterscheiden
sich nicht in ihrem Wirkmechanismus“ ist falsch und steht auch nicht in
meinem Artikel. Im Gegenteil, die bisher publizierten Daten zeigen
unterschiedliche Wirkmechanismen. Während für Nyda®
nachgewiesen wurde, dass ein akuter Sauerstoffmangel lebenswichtiger
Organe innerhalb von Minuten zum Tod von adulten Läusen führt [4], ist
für EtoPril® belegt, dass eine Störung des Wasserhaushalts
mit nachfolgendem osmotischem Stress zeitverzögert um mehrere Stunden
zum Tod der Parasiten führt [5]. Dementsprechend steht auch in Spalte
drei der Tabelle 2 (des Beitrags in DAZ Nr. 33) für Dimet®
20 „Nein“. Richtig ist dagegen, dass das Wirkprinzip von Dimeticonen
identisch ist. Dimeticone wirken rein physikalisch im Gegensatz zu
klassischen Pedikuloziden, die pharmakologische Wirkprinzipien haben.
Hermann Feldmeier, M.D., Ph.D., Professor of Tropical Medicine, Charité University Medicine Berlin
Referenzen
[1] Burgess IF. Head lice. Clinical Evidence (Online). 2015;01:1703.
[2]
Feldmeier H. Treatment of pediculosis capitis: a critical appraisal of
the current literature. Am J Clin Dermatol. 2014;15:401-12.
[3]
Dawes M. Wet combing compared with pediculicides for head lice: single
blind randomised study. Student BMJ. 2005;13:338-9.
[4] Richling
I, Böckeler W. Lethal effects of treatment with a special dimeticone
formula on head lice and house crickets (Orthoptera, Ensifera: Acheta
domestica and Anoplura, Phthiraptera: Pediculus humanus).
Arzneim-Forsch/Drug Res. 2008;58:248-54.
[5] Burgess IF. The mode
of action of dimeticone 4% lotion against head lice, Pediculus capitis.
BMC Pharmacol. 2009;9(3):doi:10.1186/471-2210-9-3.



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.