
- DAZ.online
- DAZ / AZ
- DAZ 33/2016
- Das erste onkolytische ...
Arzneimittel und Therapie
Das erste onkolytische Immuntherapeutikum
Herpes-simplex-Viren mal ganz anders
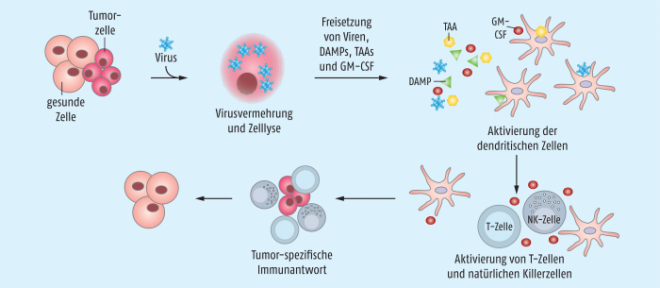
Die ersten Veröffentlichungen, die in PubMed zum Thema „onkolytische Viren“ zu finden sind, datieren auf die 1950er-Jahre zurück. Damals war die tumorspezifische Zytotoxizität der untersuchten Viren eher zufälliger Natur. Es dauerte dann noch einige Jahrzehnte, bis die molekularbiologischen Methoden so weit etabliert waren, dass auch virale Nukleinsäuren gezielt modifiziert werden konnten, um schließlich für eine Onkolyse optimierte Viren zu kreieren. Dann allerdings, beginnend mit dem Jahr 2000, stieg die Zahl der Publikationen zu diesem Thema stark. Der Ansatz ist im Prinzip ja auch verblüffend einfach und gleichermaßen genial: Lassen sich Viren tatsächlich so „abrichten“, dass sie nicht mehr willkürlich in irgendwelche (gesunden) Körperzellen eindringen, sie für die Virusvermehrung missbrauchen und anschließend lysieren, sondern vielmehr ganz gezielt Tumorzellen als ihre zerstörerische „Kinderstube“ verwenden?
Zusätzlich zur direkten Zerstörung kommt als zweiter positiver Effekt hinzu, dass bei der Zelllyse tumorspezifische Moleküle und sogenannte damage-associated molecular patters (DAMPs) freigesetzt werden, die das Immunsystem stimulieren, ebenfalls gegen die Krebszellen aktiv zu werden. Die große Herausforderung bei diesem Ansatz ist jedoch, wirklich sehr spezifisch Tumorzellen anzusteuern und gesunde Körperzellen unbehelligt zu lassen.
Verschiedene Faktoren unterstützen die Selektivität: Zum einen sind häufig gerade die von einem Virus als Eintrittspforte verwendeten Moleküle auf Tumorzellen überexprimiert, so dass das Viruspartikel bereits recht spezifisch diese Wirtszelle infiziert. Sollte dies noch nicht ausreichend sichergestellt sein, lässt sich über entsprechende gentechnische Veränderungen des Viruspartikels noch eine Verbesserung der Selektivität erreichen. Für eine optimale Virusvermehrung ist häufig eine metabolisch aktive Wirtszelle mit hoher Teilungsrate erforderlich, weshalb sich gerade schnell wachsende Tumoren bestens eignen. Und zudem ist in Tumorzellen häufig der Interferonsignalweg, der in gesunden Zellen für eine effiziente Virusabwehr sorgt, defekt, so dass dieser Störfaktor für eine Virusvermehrung im Krebsgewebe wegfällt.
Obwohl einige Besonderheiten der Tumorzellen die Spezifität der onkolytischen Viren für das Tumorgewebe stützen, ist die Tumorselektivität immer noch der Knackpunkt, mit dem der Therapieansatz zu kämpfen hat. Wie kann man verhindern, dass vielleicht doch auch andere Zellen infiziert werden? Können die gentechnisch veränderten onkolytischen Viren im Körper mit ihren Wildtyp-Verwandten, die vielleicht ebenfalls bereits vorhanden sind, rekombinieren und Teile des Genoms austauschen? Das könnte zu unvorhergesehenen Reaktionen führen und die Wirksamkeit der onkolytischen Viren beeinträchtigen.
Zum Teil wird eine zusätzliche „Spezifität“ dadurch erreicht, dass die Viren direkt ins Tumorgewebe injiziert werden und dort sofort auf ihre Wirtszellen treffen. Das setzt allerdings voraus, dass der Tumor lokal gut greifbar ist. Der Nachteil besteht darin, dass Metastasen, die sich an irgendwelchen anderen Stellen im Körper angesiedelt haben, bei der Behandlung nicht attackiert werden.
Mittlerweile findet man 69 laufende klinische Studien unter dem Stichwort „oncolytic virus“ in der Datenbank der U.S. National Institutes of Health. Zwei davon sind Phase-III-Studien mit einem onkolytischen Virus auf der Basis eines Adeno-Virus bzw. eines Vaccinia-Virus. Daneben werden auch andere Viren als mögliche onkolytische Agenzien beforscht, wie Masern-Viren, Polio-Viren, Coxsackie-Viren oder eben Herpes-Viren wie diejenigen in Talimogen laherparepvec, das mittlerweile europaweit zugelassen ist.
HSV-1 als onkolytisches Virus
Bereits 1991 wurden die ersten replikationskompetenten Herpes-Viren (HSV) im Einsatz gegen maligne Gliome getestet. Jetzt hat es ein Herpes-simplex-Virus Typ 1 (HSV-1) als erstes geschafft, die Zulassungskriterien sowohl der FDA als auch der EMA zu erfüllen. HSV-1 ist ein gut bekanntes „Haustierchen“ des Menschen: Ca. 80 bis 90% der Erwachsenen sind Träger des Virus und werden immer mal wieder durch Lippenbläschen an diese Infektion erinnert. Abgesehen davon haben Herpes-Viren jedoch einige Eigenschaften, die sie für den Einsatz als onkolytische Viren prädestinieren:
- viele unterschiedliche Zelltypen werden infiziert,
- die Wirtszelle wird im normalen Vermehrungszyklus des Virus immer lysiert,
- das virale Genom besteht aus doppelsträngiger DNA, ist mit 152 kbp sehr groß und gut bekannt: bis zu 30 kbp umfassen unwichtigere, virale Gene, die leicht durch andere Gene ersetzt werden können,
- einige dieser unwichtigeren Gene sind für die Neurovirulenz verantwortlich,
- das virale Genom integriert nicht in die DNA der Wirtszelle, sondern persistiert episomal, also als zusätzliches ringförmiges Molekül; somit können keine Insertionsmutationen im Zell-Genom durch die Infektion mit dem Virus auftreten,
- etliche Virustatika gegen Herpes-Viren sind bekannt, die bei einer unerwünschten Vermehrung der onkolytischen Viren eingesetzt werden können, was die Sicherheit der Behandlung steigert.
Recht schnell waren etliche verschiedene HSV-1-Subtypen verfügbar, die über unterschiedliche Genmutationen verfügten und auf ihre onkolytische Fähigkeit untersucht wurden. In der Folge zeigte sich, welche Deletionen im viralen Genom vorteilhaft und welche weniger vorteilhaft waren. So ist z. B. die virale Thymidinkinase eine sehr wertvolle Eigenschaft, um im Zweifelsfall auch die onkolytischen Viren mit Aciclovir oder Ganciclovir zu bekämpfen. Demgegenüber sorgt das infected cell protein 34.5 (ICP34.5) dafür, dass auch ruhende, sich nicht teilende Zellen infiziert werden, was im schlimmsten Fall eine Enzephalitis hervorrufen könnte. Deshalb kann auf dieses virale Gen gut verzichtet werden, was jedoch dann eine verringerte Virusausbeute pro Infektionszyklus nach sich zieht.
Sehr früh wurden auch schon verschiedene, zusätzliche Gene in das virale Genom eingebracht. Eines der ersten war das bakterielle Gen LacZ, das für das Enzym β-Galactosidase codiert. Über eine recht einfache Farbreaktion lässt sich das rekombinante Enzym und damit auch das Virus im Gewebe nachweisen und von einer Infektion mit Wildtyp-Viren unterscheiden.
Talimogen laherparepvec
Mit Talimogen laherparepvec (T-VEC, Imlygic®, früher als OncoVEXGM-CSF bezeichnet) hat die Entwicklung onkolytischer Herpes-Viren einen vorläufigen Höhepunkt erreicht. In diesem Virus-Subtyp wurde das Gen für ICP34.5 durch das Gen für den humanen Granulozyten/Makrophagen-Koloniestimulierenden Faktor (GM-CSF) ersetzt. Durch die Expression des GM-CSF im Tumorgewebe werden dendritische Zellen und Makrophagen stimuliert, die dann wiederum Tumor-spezifische T-Zellen aktivieren. Außerdem wurde das Gen ICP47 inaktiviert. Das von diesem Gen abgeleitete Protein sorgt normalerweise dafür, dass in der Wirtszelle die Antigenpräsentation über den Major Histocompatibility Complex I (MHC-I) gestört ist, wodurch zytotoxische T-Zellen schlechter rekrutiert werden. Mit der Deletion des Gens wird also eine bessere Antigenpräsentation erreicht, was sich dann natürlich nicht nur auf die viralen Peptide beschränkt, sondern auch Peptide der Wirtszelle, also Antigene des Tumors, mit einbezieht. Gleichzeitig führt die Deletion von ICP47 zu einer verbesserten Replikation des Virus in der Tumorzelle und beeinträchtigt nicht die Gewebeselektivität. Somit sind die Herpes-Viren in Talimogen laherparepvec optimal aufgestellt, um einerseits die Tumorzellen direkt zu lysieren, andererseits das Immunsystem zu stimulieren, spezifisch gegen das Melanom aktiv zu werden.
Gezüchtet werden die neu konstruierten onkolytischen Herpes-Viren in Vero-Zellen, einer Nierenzelllinie, die ursprünglich aus Grünen Meerkatzen stammt. Diese Zelllinie ist gut charakterisiert und wird für die Anzucht verschiedener Viren zur Impfstoffherstellung verwendet. Um die Ausbeute an Viruspartikeln zu ermitteln, infiziert man eine konfluent gewachsene Zellschicht mit einer stark verdünnten Virussuspension und zählt nach einer gewissen Inkubationszeit die Anzahl an Lücken (= Plaques) im Zellrasen aus. Unter der Annahme, dass jeder Plaque durch ein infektiöses Virus gebildet wurde, lässt sich aus der Anzahl Plaques, der Menge an eingesetzter Virussuspension und der Verdünnungsstufe die Virusmenge als Plaque-bildenden Einheiten (PFU) pro Milliliter errechnen.
Das Arzneimittel Imlygic® ist in zwei verschiedenen Konzentrationen verfügbar, entweder mit 106 oder mit 108 PFU/ml Injektionslösung, und ist derzeit zugelassen für Erwachsene mit nicht resezierbarem, lokal oder entfernt metastasiertem Melanom (Stadium IIIB, IIIC und IVM1a) ohne Knochen-, Hirn-, Lungen- oder andere viszerale Beteiligung. Für die erste Behandlung wird die niedriger dosierte Virussuspension eingesetzt, alle weiteren Anwendungen werden mit der 108 PFU/ml-Konzentration im Abstand von drei Wochen nach der ersten Injektion und danach nach jeweils zwei Wochen durchgeführt. Die onkolytischen Viren werden dabei direkt in die Tumorläsionen injiziert, wobei sich die Menge nach der Größe der Läsion richtet. Pro Behandlung dürfen maximal 4 ml Virussuspension appliziert werden. Für acht Anwendungen wird ein Gesamtpreis von ca. 80.000 Euro veranschlagt.
Die Studienergebnisse
In der OPTiM-Studie, in der 436 Patienten mit fortgeschrittenem Melanom entweder mit Talimogen laherparepvec oder mit GM-CSF allein (Kontrolle) behandelt wurden, zeigte sich, dass es bei der Verum-Gruppe bei 16,3% der Patienten gegenüber 2,1% in der Kontroll-Gruppe zu einer Verkleinerung der Hautläsionen und der befallenen Lymphknoten kam. Die mittlere Gesamtüberlebenszeit lag bei den mit Talimogen laherparepvec behandelten Patienten bei 23,3 Monaten im Vergleich zu 18,9 Monaten bei denjenigen, die GM-CSF erhalten hatten. Bei 90% der Patienten, denen Talimogen laherparepvec injiziert worden war, traten grippeähnliche Symptome auf, die umso schlimmer waren, wenn die Betroffenen vor Behandlungsbeginn HSV-1-negativ waren. Dies ist nicht weiter verwunderlich, schließlich erhielten die Patienten infektiöse Viruspartikel, auf die das Immunsystem entsprechend reagiert. In einer retrospektiven Follow-up-Analyse der OPTiM-Studie konnte bei 17% der Studienteilnehmer in der Verum-Gruppe ein komplettes Ansprechen gezeigt werden. Diese sehr positiven Studienergebnisse bei dem schwierig behandelbaren Krankheitsstadium haben das Committee for Medicinal Products for Human Use (CHMP) bei der EMA überzeugt, eine positive Zulassungsempfehlung auszusprechen. Allerdings soll die Anwendung weiterhin kritisch beobachtet werden. Ein Risk Management Plan, der bei der Therapie berücksichtigt werden muss, soll die Anwendung des onkolytischen, infektiösen Virus so sicher wie möglich machen. Am 16. Dezember 2015 wurde die Zulassung erteilt und am 15. Juni 2016 Imlygic® in Deutschland eingeführt.
Große Hoffnungen setzen die bisherigen Anwender und der Hersteller auf eine Kombinationstherapie mit den neuen Checkpoint-Inhibitoren, die die Antwort des Immunsystems auf die Therapie mit den onkolytischen Viren noch verstärken dürfte. Entsprechende Studien laufen bereits.
Sehr viel kritischer sieht das Deutsche Ärzteblatt den neuen Arzneistoff und schätzt die Therapie als „eine rein palliative Wirkung“ ein. Diejenigen, die mit ihrem fortgeschrittenen Melanom von Talimogen laherparepvec profitiert haben und noch profitieren werden, sehen das eventuell ganz anders. |
Literatur
[1] Varghese S, Rabkin SD. Oncolytic herpes simplex virus vectors for cancer virotherapy. Cancer Gene Ther 200;9:967-978
[2] Lawler SE, Speranza MC, Cho CF, Chiocca EA. Oncolytic Viruses in Cancer Treatment: A Review. JAMA Oncol 2016; 21. Juli 2016, doi: 10.1001/jamaoncol.2016.2064
[3] Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N et al. Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol 2015;33:2780-2788
[4] Ott PA, Hodi FS. Talimogene Laherparepvec for the Treatment of Advanced Melanoma. Clin Cancer Res 2016; 22:3127-3131
[5] Breitbach CJ, Lichty BD, Bell JC. Oncolytic Viruses: Therapeutics With an Identity Crisis. EBioMedicine 2016;9:31-36
[6] Johnson DB, Puzanov I, Kelley MC. Talimogene laherparepvec (T-VEC) for the treatment of advanced melanoma. Immunotherapy 2015;7:611-619
[7] Imlygic®: EPAR-Summary fort he public und Imlygic: EPAR – Risk-Management-Plan summary. www.ema.europa.eu
[8] USA: Onkolytische Viren zur Melanombehandlung zugelassen. 29. Oktober 2015, www.aerzteblatt.de























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.