
- DAZ.online
- DAZ / AZ
- DAZ 29/2016
- Den Reifungsprozess von ...
Prisma
Den Reifungsprozess von HIV stoppen
Mit stabiler Struktur ist das Virus harmlos
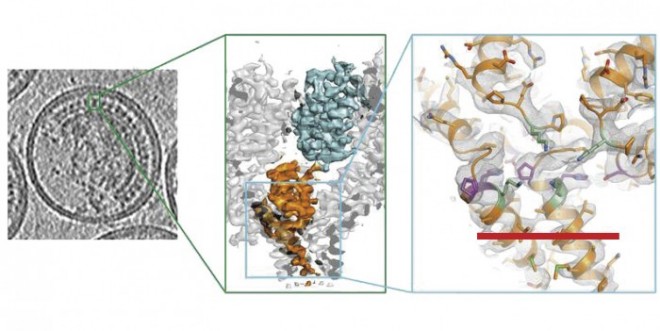
Virologen am European Molecular Biology Laboratory (EMBL) in Heidelberg und an der dortigen Universität haben sich auf das Gag-Polyprotein spezialisiert, das die Bausteine der Hülle des HI-Virus (und anderer Retroviren) bildet (vgl. DAZ 2014, Nr. 46, S. 6). Mithilfe der Kryoelektronentomografie, die ihnen derzeit eine Auflösung bis 3,9 Angström (3,9 nm) ermöglicht, und einer speziellen EDV-Auswertung (subtomogram averaging) haben sie dargestellt, wie Maturations-Inhibitoren am Gag-Polyprotein angreifen und den letzten Schritt bei der Replikation des Virus verhindern. Somit bleibt das Virus „unreif“ und kann keine Zellen infizieren.
Zwei benachbarte Regionen des Gag-Polyproteins sind für die sogenannte Reifung des Virus essenziell: Das Capsidprotein p24 (CA) und das Spacerpeptid 1 (SP1). Die proteolytische Spaltung der Verbindung von CA und SP1 ist die unabdingbare Voraussetzung für die Fertigstellung der Virushülle. Diese Schnittstelle ist allerdings „versteckt“ und für die zuständige Protease unzugänglich. Erst nach einem strukturellen Umbau aufgrund intra- und intermolekularer Interaktionen des Gag-Polyproteins kann die Protease wirksam werden. Die bereits seit etwa zehn Jahren intensiv erforschten Maturations-Inhibitoren (z. B. Bevirimat; PA-457) blockieren nicht, wie früher vermutet, die Schnittstelle, sondern sie stabilisieren die Struktur des Gag-Polyproteins und verhindern seine Prozessierung, durch die die Schnittstelle zugänglich wird.
Zugleich haben die Heidelberger Virologen geklärt, warum HI-Viren mit bestimmten Genmutationen gegen Maturations-Inhibitoren resistent sind: Ihr Gag-Polyprotein lässt sich nicht stabilisieren. Hier liegt der Schlüssel für die Optimierung dieser potenziellen Arzneistoffe, von denen bisher noch keiner die Phase III der klinischen Prüfung bestanden hat. |
Quelle
Schur FKM, et al. An atomic model of HIV-1 capsid-SP1 reveals structures regulating assembly and maturation. Science; Epub 14.7.2016





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.