
- DAZ.online
- DAZ / AZ
- DAZ 24/2016
- Vom Antitussivum zum ...
Pharmakologie
Vom Antitussivum zum Antidiabetikum
Dextromethorphan weist den Weg für neue Ansätze in der Diabetestherapie
Die Erkrankung Diabetes mellitus umfasst eine Gruppe von Stoffwechselstörungen, bei denen es infolge einer ungenügenden Blutglucoseregulation zu pathologisch erhöhten Blutzuckerspiegeln kommt (Hyperglykämien) [3]. Letztere sind, ebenso wie pathologisch erniedrigte Blutzuckerspiegel (Hypoglykämien), mit langfristigen Schäden und akuten lebensbedrohlichen Ereignissen assoziiert [3, 4]. Daher ist es wichtig, den Blutzuckerspiegel innerhalb eines relativ eng definierten Bereichs aufrechtzuerhalten (Glucosehomöostase).
Die Glucosehomöostase wird primär über die kontrollierte Freisetzung pankreatischer Polypeptidhormone in den Blutkreislauf reguliert [5]. Diese Hormone werden von unterschiedlichen Zelltypen der Langerhans-Inseln der Bauchspeicheldrüse (Pankreas) synthetisiert und sezerniert. Ein gesundes menschliches Pankreas besitzt etwa eine Million solcher Langerhans-Inseln, die sich größtenteils aus den Insulin-produzierenden Betazellen (ca. 50%) und den Glucagon-produzierenden Alphazellen (ca. 35 – 40%) zusammensetzen [6, 7]. Insulin ist das einzige Hormon, welches den Blutzuckerspiegel senken kann, während Glucagon den Blutzuckerspiegel vorübergehend erhöht [6, 8].
Den verschiedenen Formen des Diabetes ist es gemein, dass es im Verlauf der Erkrankung zu einer Fehlfunktion und einem sukzessiven Absterben der Betazellen kommt. Die Folgen sind eine gestörte bis fehlende Insulinsekretion und das Auftreten von Hyperglykämien [9]. Hinsichtlich ihrer Ätiologie können die verschiedenen Diabetesformen grob in vier Kategorien unterteilt werden (Tab. 1) [3]. Am häufigsten sind der Typ-2-Diabetes (T2DM; 90 – 95% aller Diabetesformen) sowie der bei Kindern und Jugendlichen dominierende Typ-1-Diabetes (T1DM; 5 – 10%) [3].
Typ-1-Diabetes mellitus (T1DM) |
|
Typ-2-Diabetes mellitus (T2DM) |
|
seltene spezifische Formen eines Diabetes, z. B. durch |
|
Schwangerschaftsdiabetes (Gestationsdiabetes) |
|
Typ-1-Diabetes mellitus (T1DM)
Der T1DM ist eine der häufigsten chronischen Erkrankungen im Kindes- und Jugendalter. Bevölkerungsbezogenen Registern zufolge wird in Deutschland jährlich bei etwa 3500 Kindern und Jugendlichen im Alter bis 19 Jahren die Diagnose eines T1DM gestellt [2]. Man geht heute davon aus, dass sich zu Beginn eines T1DM autoreaktive Immunzellen an die Langerhans-Inseln ansiedeln (Periinsulitis). Einige wenige Immunzellen infiltrieren die Inseln auch und dringen zu den Betazellen vor (Insulitis). Die Immunzellen (vor allem T-Lymphozyten, später auch B-Lymphozyten, Makrophagen) sind vermutlich Teil einer inflammatorischen Reaktion, die mit der Freisetzung verschiedener Zytokine (z. B. IL-1β, TNF-α und IFN-γ) und schließlich der selektiven Zerstörung der Insulin-produzierenden Betazellen einhergeht [10]. Hierbei begünstigt das Zusammenspiel aus genetischer Prädisposition und verschiedenen Umweltfaktoren das Auftreten eines T1DM (multifaktorielle Genese) [11, 12].
Mit Beginn der inflammatorischen Reaktion kann ein normaler Blutzuckerspiegel noch für viele Jahre aufrechterhalten werden. Jedoch lassen sich im Serum genetisch prädisponierter Individuen bereits zu diesem Zeitpunkt verschiedene Autoantikörper nachweisen, z. B. Antikörper gegen Glutaminsäure-Decarboxylase 65 (GADA), Tyrosinphosphatase IA-2 (IA-2A) und Insulin (IAA), die mit einem zum Teil stark erhöhten Risiko für die Entwicklung eines T1DM einhergehen [13, 14]. Dies erlaubt es, genetisch vorbelasteten Individuen mit hoher Wahrscheinlichkeit vorherzusagen, dass sie an einem T1DM erkranken werden, und in Zukunft könnte es möglich sein, durch eine frühe medikamentöse Intervention die progressive Zerstörung der Betazellen aufzuhalten.
Zur klinischen Manifestation eines T1DM kommt es, wenn bereits 80 bis 95 Prozent der Betazellen zerstört sind [15]. Obwohl die Zerstörung der Betazellen zum Zeitpunkt der Diagnosestellung bereits so weit fortgeschritten ist, entwickeln 60 bis 80 Prozent der Diabetiker nach den ersten Insulingaben eine passagere Remission mit vermehrter Insulinsekretion. Diese sogenannte Honeymoonphase hält jedoch nur wenige Wochen bis Monate an. Danach ist in aller Regel eine lebenslange Substitution mit Insulin erforderlich [16].
Typ-2-Diabetes mellitus (T2DM)
Der T2DM tritt bevorzugt im höheren Lebensalter auf, findet sich jedoch zunehmend auch bei Kindern und Jugendlichen [17]. So hat sich in Deutschland die Anzahl der T2DM-Neuerkrankungen bei Jugendlichen in den letzten zehn Jahren verfünffacht [2]. Der T2DM entwickelt sich graduell über mehrere Jahre und ist neben erblichen Faktoren insbesondere mit Adipositas und Bewegungsmangel assoziiert [18].
Zu Beginn eines T2DM kommt es in der Regel zur Unempfindlichkeit der peripheren Gewebe gegenüber Insulin (periphere Insulinresistenz), die durch eine gesteigerte Insulinsekretion kompensiert wird (hyperinsulinämische Phase des T2DM). Im Verlauf der Erkrankung kommt es jedoch zu Betazellfehlfunktionen und Sekretionsdefekten der Langerhans-Inseln [18, 19], zum Absterben funktionaler Betazellen und zum Teil auch zu ihrer Dedifferenzierung [20, 21]. Die Sekretionsdefekte haben zur Folge, dass die periphere Insulinresistenz nicht mehr kompensiert wird und Hyperglykämien auftreten.
Die periphere Insulinresistenz, Betazellfehlfunktionen und der Betazelltod werden durch Sekrete des Fettgewebes wie Leptin, ungesättigte Fettsäuren (Lipotoxizität) und proinflammatorische Zytokine sowie durch die chronisch erhöhten Blutglucosekonzentrationen (Glucotoxizität) begünstigt [18, 19, 22 – 24].
Gegenwärtige Therapieoptionen
Mit den aktuell zur Verfügung stehenden Medikamenten lassen sich die chronisch erhöhten Blutzuckerspiegel zwar relativ gut senken, jedoch ist es bisher nicht möglich, die progressive Zerstörung der Betazellen aufzuhalten oder die Betazellfunktion dauerhaft wiederherzustellen [25 – 27]. Entsprechend ist der Diabetes in den meisten Fällen bis heute nicht heilbar.
Für den T1DM stellt die Substitution der endogenen Insulinproduktion durch injizierbares rekombinantes Insulin die zentrale Therapiekomponente dar [13]. Immunsuppressive oder immunmodulatorische Medikamente, die die autoimmune Zerstörung der Betazellen erfolgreich aufhalten, stehen trotz zahlreicher Forschungsbestrebungen bis heute nicht zur Verfügung [28]. Jedoch könnten vielleicht in ein bis drei Jahrzehnten oral verfügbare Insulinrezeptor-Agonisten die Insulininjektionen ablösen [29].
In der Therapie des T2DM werden verschiedene Antidiabetika eingesetzt, z. B. das Biguanid Metformin, Sulfonylharnstoffe oder die neueren Inkretinmimetika, d. h. Dipeptidylpeptidase‑4-(DPP4-)Inhibitoren, und Glucagon-Like-Peptide-1-(GLP-1-)Analoga [25, 30]. Um dauerhaft eine effiziente Senkung des Blutzuckerspiegels zu erreichen, ist im Verlauf der Erkrankung in aller Regel eine Kombinationstherapie verschiedener antidiabetischer Medikamente erforderlich; nach etwa zehn bis 15 Jahren nach Diagnosestellung muss häufig Insulin injiziert werden, um den Blutzuckerspiegel ausreichend gut einzustellen [31].
Leider induzieren einige der am häufigsten verschriebenen Antidiabetika teils gefährliche Nebenwirkungen, z. B. Hypoglykämien (Sulfonylharnstoffe) [25, 32]. Zudem können auch die neuesten Antidiabetika, wie die DPP4-Inhibitoren, die GLP-1-Analoga und die SGLT-2-Inhibitoren (SGLT = Sodium-dependent Glucose Transporter) die Betazellfunktion nicht dauerhaft wiederherstellen [26, 27, 33]. Langfristiges Ziel der Diabetesforschung ist es daher, nebenwirkungsarme Medikamente zu entwickeln, die die Betazellfunktion wiederherstellen und den Verlust funktionaler Betazellmasse aufhalten. Solche Medikamente könnten bei möglichst frühzeitiger Anwendung die derzeit notwendigen Insulininjektionen ersetzen.
NMDA-Rezeptoren (NMDAR)
N-Methyl-D-Aspartat-Rezeptoren (NMDAR) sind nichtselektive, liganden- und spannungsabhängige Kationenkanäle. Das bedeutet, dass zu ihrer Aktivierung nicht nur die Bindung eines Agonisten (Glutamat) und eines Co-Agonisten (Glycin oder Serin), sondern auch die Depolarisation der Zellmembran erforderlich ist. Denn erst nach der Depolarisation verlässt ein blockierendes Magnesium-Ion den Kanal [36].
Die Funktion der NMDAR ist bisher vor allem im Zentralnervensystem (ZNS) untersucht worden [34, 35]. Dort sind sie wichtig für die Zell-Zell-Kommunikation, spielen aber auch bei der Glutamat-vermittelten Exzitotoxizität eine Rolle. Hierbei kommt es infolge massiver Aktivierung von NMDAR zum Absterben von Nervenzellen. NMDAR-Fehlfunktionen wurden bei diversen neurologischen Erkrankungen (wie M. Alzheimer, Schlaganfall, Depression) nachgewiesen, und zahlreiche Studien haben die Effekte von NMDAR-Antagonisten auf den Verlauf dieser Erkrankungen untersucht [34].
Obwohl seit Längerem bekannt ist, dass Glutamat die Insulinsekretion und das Überleben der Langerhans-Inseln beeinflusst, war bisher nur wenig über die Funktion pankreatischer NMDAR bekannt [37 – 41]. Anhand mehrerer In-vitro- sowie In-vivo-Studien haben wir erstmals systematisch die Funktion der NMDAR in den Langerhans-Inseln im Hinblick auf die Insulinsekretion, Glucosehomöostase und das Überleben der Betazellen untersucht [42].
NMDAR-Antagonisten als Diabetes-Therapeutika
Die bisherigen Ergebnisse unserer Arbeitsgruppen haben gezeigt, dass NMDAR-Antagonisten selektiv die Glucose-stimulierte Insulinsekretion (GSIS) steigern; das heißt, die mit NMDAR-Antagonisten behandelten Langerhans-Inseln sezernieren nur dann mehr Insulin als unbehandelte Langerhans-Inseln, wenn sie einer hohen Glucosekonzentration ausgesetzt sind [42]. Unsere Experimente zeigten auch, dass die Kombination des NMDAR-Antagonisten Dextrorphan (DXO) mit dem GLP-1-Analogon Exendin-4 einen signifikant stärkeren Effekt auf die GSIS hat als die alleinige Applikation einer der beiden Substanzen. Anhand verschiedener Mausmodelle konnten wir nachweisen, dass die NMDAR-Antagonisten Dextromethorphan (DXM) und DXO in vivo die Glucosetoleranz verbessern, und trotz vermehrter Insulinsekretion traten keine Hypoglykämien auf [42].
In weiteren präklinischen Experimenten zeigte sich zudem, dass NMDAR-Antagonisten die Langerhans-Inseln vor einem Zelltod schützen: Zunächst wurden isolierte menschliche Langerhans-Inseln in vitro mit den inflammatorischen Zytokinen IL-1β, TNF-α und IFN-γ behandelt, d. h. in ein diabetogenes, zellangreifendes Milieu gebracht. Wie zu erwarten, kam es unter dieser Behandlung zu einem signifikanten Absterben der Langerhans-Inseln. Wurden die Inseln jedoch gleichzeitig mit DXO behandelt, waren sie größtenteils vor dem Zelltod geschützt. Sehr ähnliche Effekte konnten auch in vivo anhand eines Mausmodells für den Typ-2-Diabetes mellitus (db/db-Maus) nachgewiesen werden. Dabei erhielten db/db-Mäuse kontinuierlich über einen Zeitraum von insgesamt acht Wochen DXM mit dem Trinkwasser. Diese Langzeitbehandlung führte zu signifikant niedrigeren Nüchtern-Blutzuckerwerten, schützte die Inselzellen vor dem programmierten Zelltod und erhöhte die Betazellmasse und die Anzahl der Langerhans-Inseln [42].
Aufgrund der positiven präklinischen Daten wurden klinische Studien mit Typ-2-Diabetikern durchgeführt [42, 43]. Bei einem Glucosetoleranztest zeigte sich, dass die einmalige orale Verabreichung einer hohen Dosis DXM (270 mg) den Blutzuckerspiegel signifikant verbessert und die Insulinsekretion steigert. Andererseits reichte eine niedrige Dosis DXM (60 mg) aus, um die blutzuckerspiegelsenkenden und insulinsekretorischen Effekte des DPP4-Inhibitors Sitagliptin signifikant zu verstärken [42, 43].
Bei DXM handelt es sich um ein altbewährtes, relativ sicheres Medikament, das seit Langem als rezeptfreies Antitussivum zugelassen ist [44]. Nach der enteralen Resorption wird es durch das CYP2D6 in der Leber rasch zum aktiven Metaboliten DXO verstoffwechselt [45].
NMDAR-vermittelte Hemmung der Insulinfreisetzung
Voraussetzung für die GSIS ist die Metabolisierung von Glucose in der Betazelle. Dabei entsteht ATP, das die ATP-abhängigen Kaliumkanäle (KATP -Kanäle) schließt und daher zur Depolarisation der Plasmamembran führt. Infolgedessen kommt es zur Aktivierung spannungsabhängiger Calciumkanäle und einem oszillatorischen Anstieg der intrazellulären Calciumkonzentration, dem auslösenden Signal für die Insulinsekretion [6, 46].
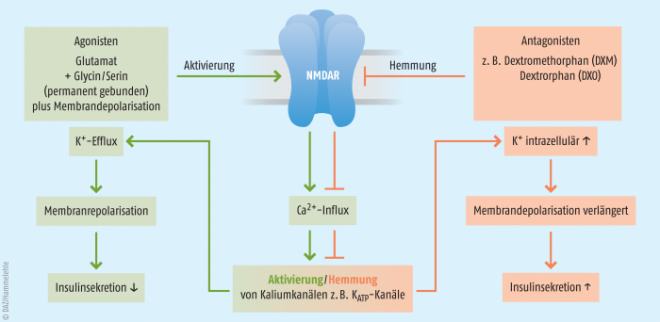
Auf der Grundlage zahlreicher Experimente konnte folgendes Modell der NMDAR-vermittelten Hemmung der Insulinfreisetzung erstellt werden (Abb. 1) [42]: Unter physiologischen Bedingungen sind der Agonist Glutamat sowie der Co-Agonist Glycin (oder Serin) an NMDAR gebunden. Infolge hoher Glucosekonzentrationen kommt es zur Depolarisation der Betazellmembran und daher zur Aktivierung der NMDAR (Beseitigung der Blockade durch Mg2+). Diese geht mit der Aktivierung verschiedener Kaliumkanäle der Betazellmembran einher (z. B. KATP -Kanäle, s. o.). Eine entsprechende Interaktion wurde bereits in spezifischen Neuronen nachgewiesen [47 – 49]. Zudem deuten auch unsere Daten darauf hin, dass die insulinsekretorischen Eigenschaften der NMDAR-Antagonisten Kaliumkanal-abhängig sind. Die Öffnung der Kaliumkanäle führt zum Kaliumefflux, zur Repolarisation der Plasmamembran und daher zur Beendigung der Insulinsekretion. Gemäß diesem Modell sind NMDAR unter physiologischen Bedingungen Teil eines negativen Feedback-Mechanismus, der eine exzessive Insulinsekretion unter anhaltender Glucosestimulation verhindern kann. NMDAR-Antagonisten durchbrechen diesen Feedback-Mechanismus, wie wir nachgewiesen haben: Sie verlängern die Membrandepolarisation (bzw. verzögern die Membranrepolarisation), erhöhen die intrazelluläre Calciumkonzentration und steigern die Insulinsekretion [42].
Pharmakologische Intervention (rechts): NMDAR-Antagonisten wie Dextromethorphan (DXM) und Dextrorphan (DXO) verhindern die Aktivierung des NMDAR. Dadurch unterbleiben der Ca2+-Influx, die Aktivierung der K+-Kanäle und der K+-Efflux. Die Phase der Membrandepolarisation ist verlängert, die intrazelluläre Calciumkonzentration erhöht und die Insulinsekretion verstärkt.
Perspektiven
Unsere Arbeiten deuten erstmals darauf hin, dass NMDAR-Antagonisten aufgrund ihrer antidiabetischen und Inselzell-protektiven Eigenschaften die Therapie des Diabetes mellitus ergänzen könnten [42, 43]. Jedoch sind zunächst viele weitere klinische Studien erforderlich, um die Langzeiteffekte von NMDAR-Antagonisten im Hinblick auf die Betazellfunktion, das Überleben der Betazellen und mögliche Nebenwirkungen (z. B. Schwindel und Müdigkeit) sowie weitere Wirkungen (z. B. Reduktion der diabetischen Langzeitkomplikationen Retinopathie und Neuropathie, Reduktion des Schlaganfallrisikos) zu untersuchen. Grundsätzlich wäre der Einsatz von NMDAR-Antagonisten bei allen Diabetesformen denkbar.
In Folgeprojekten soll zunächst untersucht werden, welchen Einfluss NMDAR-Antagonisten auf die autoreaktive Zerstörung der Betazellen beim T1DM nehmen. Hier stellt sich die Frage, ob DXM bei Typ-1-Diabetikern die Honeymoonphase verlängern und unter Umständen sogar eine längere „Insulinfreiheit“ (Verzicht auf Insulininjektionen) herbeiführen kann. Da DXM die Blut-Hirn-Schranke passiert und in höheren Dosen aufgrund der Interaktion mit neuronalen NMDAR zentralnervöse Nebenwirkungen auslösen kann (z. B. Schwindel, Übelkeit) [42, 50], ist die Entwicklung peripherer NMDAR-Antagonisten – möglichst mit höherer Affinität zu den spezifischen NMDAR der Betazellen – wünschenswert.
Die Entwicklung eines neuen, nebenwirkungsarmen Medikamentes, das eine normale Betazellfunktion wiederherstellen, den progressiven Betazelltod verhindern und dadurch das Fortschreiten einer Diabeteserkrankung verzögern oder sogar aufhalten kann, ist ein lohnenswertes Ziel und wäre ein sehr großer Gewinn für die mehr als 400 Millionen Diabetiker weltweit. |
Literatur
[1] International Diabetes Federation. IDF Diabetes Atlas, 7th edn. Brussels 2015
[2] diabetesDE – Deutsche Diabetes-Hilfe und Deutsche Diabetes Gesellschaft (DDG). Deutscher Gesundheitsbericht Diabetes 2016. Mainz 2015
[3] Diagnosis and classification of diabetes mellitus. Diabetes Care 2014;37(Suppl 1):S81-90
[4] Lotfy M, et al. Chronic complications of diabetes mellitus: A mini review. Curr Diabetes Rev 2015;12:1–8
[5] Folias AE, Hebrok M. Part VI: Pancreas. In: Lammert E, Zeeb M. Metabolism of Human Diseases. Berlin 2014:156-162
[6] Rorsman P, Braun M. Regulation of insulin secretion in human pancreatic islets. Annu Rev Physiol 2013;75:155-179
[7] Cabrera O, et al. The unique cytoarchitecture of human pancreatic islets has implications for islet cell function. Proc Natl Acad Sci USA 2006;103:2334-2339
[8] Habegger KM, et al. The metabolic actions of glucagon revisited. Nat Rev Endocrinol 2010;6:689-697
[9] Donath MY, Halban PA. Decreased beta-cell mass in diabetes: significance, mechanisms and therapeutic implications. Diabetologia 2004;47:581-589
[10] In‘t Veld P. Insulitis in human type 1 diabetes: The quest for an elusive lesion. Islets 2011;3:131-138
[11] Concannon P, Rich SS, Nepom GT. Genetics of type 1A diabetes. N Engl J Med 2009;360:1646-1654
[12] Peng H, Hagopian W. Environmental factors in the development of Type 1 diabetes. Rev Endocr Metab Dis 2006;7:149-162
[13] Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 2014;383(9911):69-82
[14] Ziegler AG, et al. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children. J Am Med Assoc 2013;309:2473-2479
[15] Klinke DJ, 2nd. Extent of beta cell destruction is important but insufficient to predict the onset of type 1 diabetes mellitus. Plos One 2008;3:e1374
[16] Abdul-Rasoul M, Habib H, Al-Khouly M. ‘The honeymoon phase‘ in children with type 1 diabetes mellitus: frequency, duration, and influential factors. Pediatric Diabetes 2006;7:101-107
[17] Dabelea D, et al. Prevalence of type 1 and type 2 diabetes among children and adolescents from 2001 to 2009. J Am Med Assoc 2014;311:1778-1786
[18] Kahn SE, Hull RL, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature 2006;444:840-846
[19] Stumvoll M, Goldstein BJ, van Haeften TW. Type 2 diabetes: principles of pathogenesis and therapy. Lancet 2005;365:1333-1346
[20] Butler AE, et al. Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes. Diabetes 2003;52:102-110
[21] Talchai C, et al. Pancreatic beta cell dedifferentiation as a mechanism of diabetic beta cell failure. Cell 2012;150:1223-1234
[22] Fasshauer M, Bluher M. Adipokines in health and disease. Trends Pharmacol Sci 2015;36:461-470
[23] Boden G. Role of fatty acids in the pathogenesis of insulin resistance and NIDDM. Diabetes 1997;46:3-10
[24] Donath MY, et al. Mechanisms of beta-cell death in type 2 diabetes. Diabetes 2005;54(Suppl 2):S108-113
[25] Tahrani AA, et al. Management of type 2 diabetes: new and future developments in treatment. Lancet 2011;378:182-197
[26] Bunck MC, et al. Effects of exenatide on measures of beta-cell function after 3 years in metformin-treated patients with type 2 diabetes. Diabetes Care 2011;34:2041-2047
[27] Retnakaran R, et al. Liraglutide and the preservation of pancreatic beta-cell function in early type 2 diabetes: the LIBRA trial. Diabetes Care 2014;37:3270-3278
[28] Ben Nasr M, et al. The rise, fall, and resurgence of immunotherapy in type 1 diabetes. Pharmacol Res 2015;98:31-38
[29] Qiang G, et al. Identification of a small molecular insulin receptor agonist with potent antidiabetes activity. Diabetes 2014;63:1394-1409
[30] Bailey CJ, Tahrani AA, Barnett AH. Future glucose-lowering drugs for type 2 diabetes. Lancet Diabetes Endocrinol 2016;4:350-359
[31] Nathan DM. Clinical practice. Initial management of glycemia in type 2 diabetes mellitus. N Engl J Med 2002;347:1342-1349
[32] Amiel SA, et al. Hypoglycaemia in Type 2 diabetes. Diabet Med 2008;25:245-254
[33] Del Prato S, et al. Long-term glycaemic response and tolerability of dapagliflozin versus a sulphonylurea as add-on therapy to metformin in patients with type 2 diabetes: 4-year data. Diabetes Obes Metab 2015;17:581-590
[34] Paoletti P, Bellone C, Zhou Q. NMDA receptor subunit diversity: impact on receptor properties, synaptic plasticity and disease. Nat Rev Neurosci 2013;14:383-400
[35] Hardingham GE, Bading H. Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders. Nat Rev Neurosci 2010;11:682-696
[36] Zhu S, et al. Mechanism of NMDA Receptor Inhibition and Activation. Cell 2016;165:704-714
[37] Gonoi T, et al. Functional neuronal ionotropic glutamate receptors are expressed in the non-neuronal cell line MIN6. J Biol Chem 1994;269:16989-16992
[38] Molnar E, et al. Identification of functional ionotropic glutamate receptor proteins in pancreatic beta-cells and in islets of Langerhans. FEBS Lett 1995;371:253-257
[39] Inagaki N, et al. Expression and role of ionotropic glutamate receptors in pancreatic islet cells. FASEB J 1995;9:686-691
[40] Feldmann N, et al. Reduction of plasma membrane glutamate transport potentiates insulin but not glucagon secretion in pancreatic islet cells. Mol Cell Endocrinol 2011;338:46-57
[41] Di Cairano ES, et al. The Glial Glutamate Transporter 1 (GLT1) Is Expressed by Pancreatic beta-Cells and Prevents Glutamate-induced beta-Cell Death. J Biol Chem 2011;286:14007-14018
[42] Marquard J, et al. Characterization of pancreatic NMDA receptors as possible drug targets for diabetes treatment. Nat Med 2015;21:363-72
[43] Marquard J, et al. Effects of dextromethorphan as add-on to sitagliptin on blood glucose and serum insulin concentrations in individuals with type 2 diabetes mellitus: a randomized, placebo-controlled, double-blinded, multiple crossover, single-dose clinical trial. Diabetes Obes Metab 2016;18:100-103
[44] Dicpinigaitis PV. Clinical perspective – cough: an unmet need. Curr Opin Pharmacol 2015;22:24-28
[45] Nguyen L, et al. Involvement of sigma-1 receptors in the antidepressant-like effects of dextromethorphan. Plos One 2014;9:e89985
[46] Ashcroft FM, Rorsman P. Diabetes mellitus and the beta cell: the last ten years. Cell 2012;148:1160-1171
[47] Shen KZ, Johnson SW. Ca2+ influx through NMDA-gated channels activates ATP-sensitive K+ currents through a nitric oxide-cGMP pathway in subthalamic neurons. J Neurosci 2010;30:1882-1893
[48] Shen KZ, et al. AMP kinase regulates K-ATP currents evoked by NMDA receptor stimulation in rat subthalamic nucleus neurons. Neuroscience 2014;274:138-152
[49] Isaacson JS, Murphy GJ. Glutamate-mediated extrasynaptic inhibition: direct coupling of NMDA receptors to Ca(2+)-activated K+ channels. Neuron 2001;31:1027-1034
[50] Siu A, Drachtman R. Dextromethorphan: a review of N-methyl-d-aspartate receptor antagonist in the management of pain. CNS Drug Rev 2007;13:96-106
Danksagung
Diese Forschung wurde gefördert von der Forschungskommission der Medizinischen Fakultät der Heinrich-Heine-Universität Düsseldorf, dem Ministerium für Innovation, Wissenschaft und Forschung des Landes Nordrhein-Westfalen und dem Bundesministerium für Gesundheit.


























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.