
- DAZ.online
- DAZ / AZ
- DAZ 23/2016
- Der Cheese-Effekt
Beratung
Der Cheese-Effekt
Tyramin-haltige Lebensmittel und ihre Wechselwirkung mit MAO-Hemmern
Eine der bekanntesten Interaktionen zwischen Arznei- und Lebensmitteln ist die Problematik des sogenannten „Cheese-Effekts“. Dieses durch potenziell lebensbedrohliche hypertensive Krisen gekennzeichnete Phänomen kommt durch die Verstärkung der sympathomimetischen Wirkung von Tyramin bei gleichzeitiger Gabe eines Monoaminoxidase-Hemmers zustande.
Tyramin
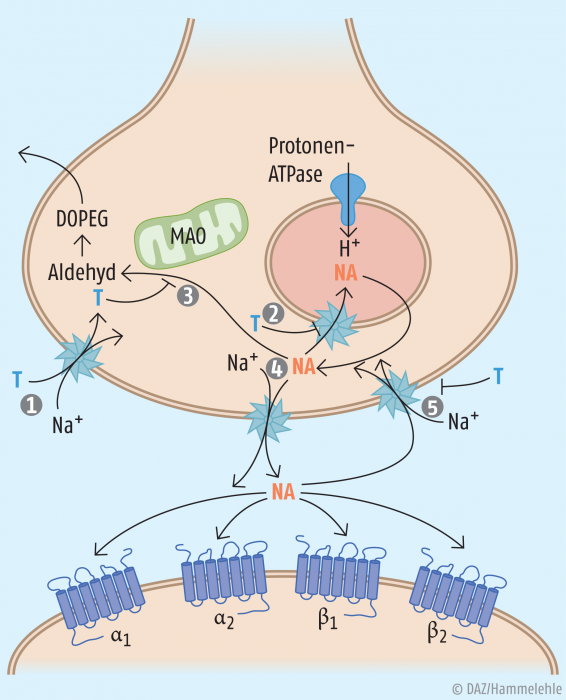
Tyramin gehört wie Histamin und Serotonin zu den biogenen Aminen. Es entsteht beim Reifen und Lagern von Lebensmitteln durch bakteriellen enzymatischen Abbau der Aminosäure L-Tyrosin [1]. In der Regel weisen also solche Lebensmittel, die durch Pökeln, Trocknen, Fermentation oder ähnliches haltbar gemacht wurden oder die sich bereits in einem fortgeschrittenen Stadium des Verderbs befinden, einen höheren Tyramin-Gehalt auf als frische, unverarbeitete Nahrungsmittel (Tab. 1). Außerdem hängt dieser vom L-Tyrosin-Gehalt des Ausgangsprodukts ab [2]. Als Substrat des Noradrenalin-Transporters in sympathischen Nervenendigungen hemmt Tyramin die Aufnahme von Noradrenalin in die Speichervesikel (Abb. 1). Dadurch reichert sich Noradrenalin im Axon an und wird unter Umkehrung der normalen Transportrichtung nicht-exozytotisch in den synaptischen Spalt freigesetzt. Außerdem erhöht Tyramin die Wiederaufnahme von freigesetztem Noradrenalin ins Axon und wirkt somit in der Summe durch Wirkverstärkung von Noradrenalin indirekt sympathomimetisch; die Noradrenalin-vermittelte Vasokonstriktion hat einen Anstieg von systolischem und diastolischem Blutdruck zur Folge [3]. In Anlehnung an den hohen Tyramin-Gehalt gereiften Käses wird dieses Phänomen als „Cheese-Effekt“ bezeichnet. Im Übrigen ist bei Tyramin anders als bei anderen indirekten Sympathomimetika nicht mit einer zentralnervös stimulierenden Wirkung zu rechnen: Aufgrund seiner geringen Lipophilie kann Tyramin die Blut-Hirn-Schranke nicht überwinden [3].
Lebensmittel |
Tyramin-Gehalt in mg/kg |
|---|---|
Fleisch | |
Hackfleisch |
3,9 |
Huhn |
0,44 |
Hühnerleber |
5 bis 10 |
Rinderleber |
27,4 |
Schweinefleisch, gekocht |
0,4 |
Wurst | |
Bratwurst |
2,9 |
Cervelatwurst |
20,9 |
Leberwurst |
2,5 bis 7,3 |
Mettwurst |
13,5 |
Salami |
22,6 |
Schinken |
1,0 bis 61,8 |
Thüringer Wurst |
16,5 |
Fisch | |
Fischstäbchen |
< 0,1 |
Hering |
300 bis 464 |
Lachs |
13,7 |
Sardinen |
0,4 bis 60 |
alkoholische Getränke | |
Rotwein |
< 25 |
Weißwein |
1 bis 8 |
Milchprodukte | |
Vollmilch |
0,04 bis 0,26 |
Quark |
1,75 |
Brie |
0 bis 26 |
Camembert |
1,3 bis 200 |
Cheddar |
7,2 bis 153 |
Gorgonzola |
100 |
Tilsiter |
221 |
Obst und Gemüse | |
Banane |
0,1 bis 9,5 |
Blumenkohl |
40 |
Champignons |
24,4 bis 120 |
Sauerkraut |
2 bis 31 |
Sojabohnen |
9,5 |
Spinat |
28,6 |
Wassermelone |
46 |
sonstiges | |
Schokolade |
0,1 bis 12 |
Abb. 1: Wirkmechanismus von Tyramin1: Cotransport von Tyramin und Na+ ins Axoplasma. 2: Hemmung der vesikulären Aufnahme von Noradrenalin durch Tyramin. 3: Hemmung des Abbaus von Noradrenalin durch die Monoaminoxidase. 4: nicht-exozytotischer Cotransport von Noradrenalin und Na+ in den synaptischen Spalt. 5: Hemmung der Noradrenalin-Wiederaufnahme durch Tyramin. DOPEG: 3,4-Dihydroxy-Phenylethylenglykol, NA: Noradrenalin, T: Tyramin. [nach Aktories et al. 2013]
Monoaminoxidasen
Um den Organismus vor den negativen Folgen einer erhöhten Tyramin-Aufnahme zu schützen, wird dieses im Normalfall bereits in der Darmschleimhaut durch Monoaminoxidasen (MAO) präsystemisch eliminiert [4]. Erst bei Verzehr sehr großer Tyramin-Mengen von über 1000 mg ist die Eliminationskapazität der MAO weitgehend erschöpft, sodass mit einem klinisch relevanten Blutdruckanstieg zu rechnen ist [5]. Die entspräche beispielsweise über zwei Kilogramm Hering oder fünf Kilogramm Tilsiter-Käse und ist für die Praxis nicht relevant. Neben Tyramin werden auch die vaso- bzw. neuroaktiven körpereigenen Neurotransmitter Dopamin, Serotonin, Adrenalin und Noradrenalin durch die beiden MAO-Isoformen A und B oxidativ desaminiert. Pharmakologisch macht man sich dies bei Erkrankungen zunutze, deren Pathophysiologie im Sinne der Monoamin-Mangel-Hypothese mit der Konzentration dieser Neurotransmitter zusammenhängt. MAO-Inhibitoren werden zum Beispiel bei Depressionen und Morbus Parkinson eingesetzt, um durch Abbauhemmung die Konzentration an Serotonin und Noradrenalin bzw. Dopamin zu erhöhen und so die Krankheitssymptome zu lindern. Als unerwünschte Wirkung ergibt sich aus diesem nicht-substratspezifischen Mechanismus jedoch eine mögliche Interaktion mit in der Nahrung enthaltenem Tyramin. Auch dessen Abbau wird gehemmt, was eine Verstärkung seiner indirekten sympathomimetischen Wirkung und möglicherweise lebensbedrohliche Blutdruckkrisen zur Folge haben kann.
Vor oder nach dem Essen – das ist nicht alles!
Wechselwirkungen zwischen Arzneimitteln und Lebensmitteln können klinisch ebenso relevant sein wie Wechselwirkungen zwischen einzelnen Arzneistoffen. Bereits eine einzige Mahlzeit enthält mehrere Hundert potenziell interagierende Verbindungen, was im Einzelfall über Erfolg oder Misserfolg einer Therapie entscheiden kann. Die daraus resultierenden, teilweise gravierenden Risiken sind vielen Ärzten und Apothekern sowie den meisten Patienten unbekannt.
Wer sich mit angewandter Arzneimitteltherapie beschäftigt, behält mit diesem Praxisbuch den Überblick im komplexen Feld der Arzneimittelinteraktionen. Die Autoren, ausgewiesene Experten für Klinische Pharmakologie und Pharmakonutrition, zeigen die wichtigsten Wechselwirkungen und geben konkrete Handlungsempfehlungen. Tabellen und Übersichten ermöglichen einen schnellen Zugriff auf potenziell problematische Kombinationen.
Martin Smollich und Julia Podlogar
Wechselwirkungen zwischen Arzneimitteln und Lebensmitteln
VIII, 120 S., 21 farb. Abb., 16 farb. Tab., Kartoniert, 24,80 Euro, ISBN 978-3-8047-3520-0
Wissenschaftliche Verlagsgesellschaft Stuttgart 2016
Besonders problematisch: Tranylcypromin
Das Antidepressivum Tranylcypromin (Jatrosom®) ist ein irreversibler Inhibitor beider Isoformen der MAO. Aufgrund seiner relativ schlechten Verträglichkeit gilt Tranylcypromin als Reservetherapeutikum und wird in der antidepressiven Therapie nur dann eingesetzt, wenn andere Arzneistoffe kontraindiziert sind oder nicht den gewünschten Erfolg bringen. Der therapeutische Schwerpunkt liegt dabei auf der psychomotorisch aktivierenden Therapie gehemmt-depressiver Syndrome, da Tranylcypromin initial vor allem stark antriebssteigernd wirkt [6]. Neben der erwünschten Konzentrationssteigerung von Noradrenalin und Serotonin wird auch der Abbau exogen zugeführten Tyramins größtenteils verhindert, was unter Umständen zu hypertensiven Krisen führen kann. Daher ist zur Vermeidung einer übermäßigen sympathomimetischen Wirkung zwingend auf eine streng Tyramin-arme Ernährungsweise zu achten. Zumindest die Neueinstellung auf Tranylcypromin sollte unbedingt qualifiziert ernährungsmedizinisch begleitet werden. Aufgrund der Irreversibilität der MAO-Inhibition und der zur Wirkungsaufhebung notwendigen Enzymneusynthese muss diese Diät bis zwei Wochen nach Therapieende eingehalten werden.
Weniger kritisch: Selektive MAO-Hemmer
Im Gegensatz zur dualen und irreversiblen MAO-Hemmung durch Tranylcypromin ist der Einsatz selektiver MAO-Inhibitoren in Bezug auf die Kombination mit Tyramin-reichen Speisen und Getränken deutlich weniger problematisch. Der ebenfalls als Antidepressivum eingesetzte Arzneistoff Moclobemid (Aurorix®) hemmt selektiv die MAO-A; für den Abbau von in der Nahrung enthaltenem Tyramin steht in der Regel noch ausreichend MAO-B zur Verfügung. Darüber hinaus wird Moclobemid durch hohe Tyramin-Konzentrationen wieder vom Enzym verdrängt [6]. Da allerdings Einzelfallberichte über starke Blutdruckanstiege nach Einnahme von Moclobemid zusammen mit Tyramin-reicher Nahrung existieren [7] und bestimmte Patienten offenbar eine erhöhte Sensibilität gegenüber Tyramin aufweisen, wird unter der Therapie mit Moclobemid sicherheitshalber vom Verzehr größerer Mengen Tyramin-reicher Nahrungsmittel abgeraten. Bei der ohnehin empfohlenen Einnahme nach dem Essen kann jedoch auch dieser mögliche Effekt umgangen werden, da das in der Nahrung enthaltene Tyramin bereits vor Einsetzen der MAO-Hemmung abgebaut wird.
Ähnliches gilt für die in der Parkinson-Therapie allein oder in der Kombination mit Levodopa eingesetzten selektiven MAO-B-Inhibitoren Selegilin und Rasagilin. Da die in der Darmmucosa hauptsächlich vorkommende MAO-A bei Berücksichtigung der maximalen Tagesdosis nicht von der Enzyminhibition betroffen ist und somit auch bei Blockade der MAO-B eine ausreichende Tyramin-Metabolisierung gewährleistet ist, sind keine Wechselwirkungen mit Tyramin-haltigen Nahrungsmitteln zu erwarten. Unabhängig davon sollten beide Wirkstoffe aus Gründen der Bioverfügbarkeit nach dem Essen eingenommen werden [8]. Probleme können allerdings auftreten, wenn der Patient zusätzlich mit einem MAO-A-Inhibitor antidepressiv behandelt wird: In diesem Fall muss der Verzehr Tyramin-reicher Nahrungsmittel ähnlich streng limitiert werden wie bei Gabe von Tranylcypromin [9].
Arzneistoffe mit MAO-inhibitorischer Partialwirkung
Neben den beschriebenen MAO-Hemmern im engeren Sinn muss eine mögliche Interaktion mit Tyramin auch bei solchen Stoffen Beachtung finden, bei denen die Inhibition der MAO nur eine therapeutisch nicht genutzte Partialwirkung darstellt. Dies betrifft zum Beispiel das Reserveantibiotikum Linezolid (Zyvoxid®), das zur Behandlung des Hodgkin-Lymphoms eingesetzte Alkylans Procarbazin (Natulan®) sowie das Tuberkulostatikum Isoniazid (z. B. Isozid®). Während im Falle des Linezolids eine zwar duale, aber reversible und schwach ausgeprägte Hemmung der MAO vorliegt und daher in der Regel keine diätetischen Restriktionen erforderlich sind [10], muss unter der Therapie mit Procarbazin möglichst vollständig auf Tyramin-reiche Nahrungsmittel verzichtet werden. Der Hersteller gibt hierzu übersichtlich gestaltete Patientenflyer heraus, die die Problematik erläutern und Listen mit sicheren und zu vermeidenden Lebensmitteln enthalten [11]. Isoniazid hemmt beide Monoaminoxidasen zwar schwach, aber irreversibel. Da es außerdem durch Inhibition der Diaminoxidase den Abbau von mit der Nahrung aufgenommenem Histamin einschränkt, sollten betroffene Patienten sowohl auf Tyramin- als auch auf Histamin-reiche Nahrung verzichten, um neben einem Tyramin-vermittelten Blutdruckanstieg auch Histamin-induzierte Hitzewallungen, Schleimhautschwellungen und Hautrötungen zu vermeiden.
Fazit
Nicht alle Hemmstoffe der Monoaminoxidase erfordern eine streng Tyramin-limitierte Diät. In Bezug auf die in der Therapie von Depressionen und Morbus Parkinson eingesetzten klassischen MAO-Hemmer ist die Gefahr des sogenannten „Cheese-Effekts“ lediglich bei der Einnahme von Tranylcypromin tatsächlich klinisch relevant. Beachtet werden müssen darüber hinaus Substanzen aus anderen Indikationsbereichen, die eine MAO-inhibierende Begleitwirkung aufweisen: Diätetische Restriktionen sind dabei vor allem unter der Therapie mit Isoniazid und Procarbazin relevant. |
Literatur
[1] Biesalski HK et al. Ernährungsmedizin. 4. Aufl., Thieme Verlag, Stuttgart 2010
[2] Rehner G, Daniel H. Biochemie der Ernährung. 3. Aufl., Spektrum Akademischer Verlag, Heidelberg 2010
[3] Aktories et al. Allgemeine und spezielle Pharmakologie und Toxikologie. 11. Aufl., Elsevier, München 2013
[4] Weiß C. Biogene Amine. Ernährungs Umschau 2009;3:172-179
[5] Berlin I et al. Determination and comparison of the pressor effect of tyramine during long term moclobemide and tranylcypromine treatment in healthy volunteers. Clin Pharmacol Ther 1989;46(3):344-351
[6] Mutschler E et al. Arzneimittelwirkungen. Lehrbuch der Pharmakologie, der klinischen Pharmakologie und Toxikologie. 10. Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012
[7] Boyd IW. Hypertension with moclobemide. Lancet 1995;346:1498
[8] Barrett JS et al. The Effect of Dosing Regimen and Food on the Bioavailability of the Extensively Metabolized, Highly Variable Drug Eldepryl® (Selegiline Hydrochloride). Am J Ther 1996;3:298-313
[9] Korn A. Tyramine pressor sensitivity in healthy subjects during combined treatment with moclobemide and selegiline Eur J Clin Pharmacol 1996;49(4):273-278
[10] Rumore MM, Roth M, Orfanos A. Dietary tyramine restriction for hospitalized patients on linezolid: an update. Nutr Clin Pract 2010;25:265-269
[11] Tyramin-arme Ernährung bei Einnahme von Procarbazin-haltigen Arzneimitteln. Patienteninformation der sigma tau GmbH, www.sigma-tau.de/assets/Uploads/Folder-Patienten-130215-1.pdf, abgerufen am 1. Mai 2016
[12] Klimek L. Das Histaminintoleranzsyndrom. Journal Med 2009;11
[13] Maintz L, Novak N. Histamine and histamine intolerance. Am J Clin Nutr 2007;85:1185–1196
























1 Kommentar
Abb1
von Hans Wunderlich am 30.12.2019 um 3:45 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.