
- DAZ.online
- DAZ / AZ
- DAZ 20/2016
- 100 Billionen kleine ...
Physiologie
100 Billionen kleine Helfer
Die Mikrobiota - wie Darmbakterien unsere Gesundheit beeinflussen
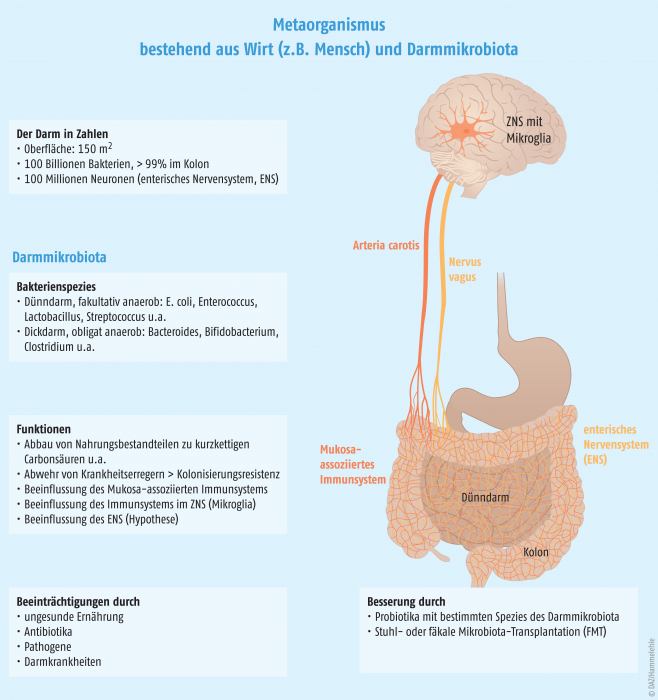
Die Darmmikrobiota erhöht nicht nur die Verdauungskapazität des menschlichen Wirtes, indem sie unverdauliche Nahrungsbestandteile zu kurzkettigen Fettsäuren wie Butyrat, Propionat, Acetat und Lactat fermentiert, sondern sie ist auch untrennbar mit der Funktion des Immunsystems verknüpft. Bedenkt man, dass der Gastrointestinaltrakt mit einer Oberfläche von mehr als 150 m2 die größte Kontaktfläche des Körpers zur Außenwelt darstellt, überrascht es nicht, dass hier etwa zwei Drittel aller Abwehrzellen lokalisiert sind. Mittlerweile weiß man, dass die Mikrobiota bei der Entwicklung und Regulierung des Mukosa-assoziierten Immunsystems eine tragende Rolle spielt und zur Aufrechterhaltung der Schleimhautbarriere beiträgt. Zudem produzieren die Darmbakterien antimikrobielle Substanzen und hindern fremde Bakterien durch kompetitive Ausgrenzung an der Besiedlung des Darmepithels (Kolonisierungsresistenz).
Dank moderner DNA-Sequenzierungsmethoden hat man inzwischen ein gutes Bild davon, welche Bakterienspezies den menschlichen Darm besiedeln und wie sich diese Zusammensetzung bei bestimmten Erkrankungen verändert. Dennoch gibt es für den Begriff „gesunde Mikrobiota“ keinen Referenzmaßstab, und die Übergänge von physiologisch zu pathologisch sind fließend. Abgesehen von einer Kern-Mikrobiota, die allen Menschen gemeinsam ist, bestehen große individuelle Unterschiede, die von verschiedenen Faktoren wie Genetik, Ernährung, Alter und Umwelt beeinflusst wird [3]. Da verschiedene Bakterienspezies die gleichen metabolischen Funktionen ausüben können, kann die Mikrobiota zweier Menschen trotz unterschiedlicher Zusammensetzung ein ähnliches metabolisches Profil aufweisen.
Veränderungen der Mikrobiota sind für zahlreiche Erkrankungen beschrieben worden, darunter Morbus Crohn, Colitis ulcerosa, Reizdarmsyndrom und Adipositas. Allerdings ist in den meisten Fällen noch unklar, ob die veränderte Mikrobiota eine Ursache oder eine Folge der Krankheit ist.
Darm-Hirn-Achse: Kommunikation in beide Richtungen
Es ist seit Langem bekannt, dass zwischen der Mikrobiota, dem Darmepithel und dem Immunsystem ein permanenter Informationsaustausch stattfindet, der essenziell für die Erhaltung der intestinalen Homöostase ist. Dabei wurde jedoch meist die Tatsache außer Acht gelassen, dass der Gastrointestinaltrakt nicht nur die größte Anzahl an Immunzellen, sondern auch die größte Ansammlung von Nervenzellen außerhalb des zentralen Nervensystems beherbergt: Er ist von einem Netz aus mehr als 100 Millionen Neuronen durchzogen, die das enterische Nervensystem (ENS) oder auch „Bauchhirn“ bilden.
Das ENS überwacht und koordiniert verschiedene gastrointestinale Funktionen wie Sekretion, Durchblutung und Darmmotilität und sorgt somit für den gerichteten Transport des Darminhalts. Es arbeitet dabei weitgehend autonom, denn das zentrale Nervensystem (Gehirn und Rückenmark) übt nur einen modulierenden Einfluss auf die Darmfunktion aus. ENS und ZNS sind über den Vagusnerv direkt miteinander verbunden, wobei lange Zeit angenommen wurde, dass das Hirn den Bauch regiert. Heute weiß man, dass der Informationsfluss bidirektional ist, wobei jedoch nur zehn Prozent der Fasern des Vagusnervs Informationen vom Gehirn zum Bauch leiten und 90 Prozent in die umgekehrte Richtung.
Beziehungen zwischen der Darmmikrobiota und Verhaltensmustern wurden in Tierversuchen beobachtet. Entsprechende Experimente beim Menschen verbieten sich aus ethischen Gründen.
Zudem können Darm und Gehirn auch über die Blutbahn mittels endokriner und immunspezifischer Botenstoffe Informationen austauschen. Während die neuronalen und humoralen Kommunikationswege zwischen ZNS und ENS schon seit Langem unter dem Begriff „Darm-Hirn-Achse“ bekannt sind, ist die Vorstellung, dass die intestinale Mikrobiota auch „mitredet“, vergleichsweise neu. Erst als in den vergangenen Jahren Veränderungen in der Mikrobiota auch immer häufiger bei neurologischen und psychischen Erkrankungen wie Multiple Sklerose, Depression, Angststörungen und Autismus beobachtet wurden, begannen Wissenschaftler, sich mit der Möglichkeit auseinanderzusetzen, dass die intestinale Mikrobiota auch mit dem Nervensystem interagieren könnte. Zwar haben die Darmbakterien keinen direkten Kontakt zu den Neuronen des ENS, jedoch können ihre Stoffwechselprodukte mit den Darmepithelzellen und somit über das Blut-, Nerven- und Immunsystem vermutlich mit dem gesamten Organismus kommunizieren.
Darmmikroben und Verhaltensstörungen
Mittlerweile haben mehrere Forschergruppen gezeigt, dass keimfrei aufgezogene Mäusen im Vergleich zu Artgenossen mit natürlicher Mikrobiota veränderte Verhaltensmuster bezüglich Stressbewältigung [4, 5] und Ängstlichkeit [6, 7] aufweisen. Zudem beeinflusst nicht nur die Abwesenheit der Darmmikrobiota das Verhalten, sondern auch das Zufüttern bestimmter Bakterienstämme [8 – 10]. Wurde Mäusen regelmäßig das Bakterium Lactobacillus rhamnosus gegeben, waren diese anschließend weniger ängstlich und wiesen weniger Stresshormone im Blut auf. Diese Effekte blieben jedoch aus, wenn der Vagusnerv vor Zugabe der Bakterien durchtrennt wurde [8, 11, 12]. Bakterien sind also in der Lage, den Vagusnerv zu aktivieren und mit dem Gehirn zu kommunizieren.
Interessanterweise konnte eine Übertragung der natürlichen Darmbakterien nur bei sehr jungen, keimfreien Mäusen eine Normalisierung der abnormen Verhaltensmuster bewirken, während das Stress- und Angstverhalten der Tiere bei einer Wiederbesiedlung zu späteren Zeitpunkten unverändert blieb. Basierend auf diesen Ergebnissen wurde postuliert, dass es in der Entwicklung ein kritisches Zeitfenster gibt, in dem die Darmmikrobiota Einfluss auf die Gehirnentwicklung und das Verhalten nimmt – mit möglicherweise lebenslangen Konsequenzen. Der menschliche Darm wird nach der Geburt von verschiedenen Bakterien besiedelt, wobei die Mikrobiota in den ersten Lebensjahren aufgrund funktioneller und immunologischer Reifungsprozesse noch relativ großen Änderungen unterliegt, bis sie schließlich eine stabile, funktionelle Einheit mit ihrem Wirt bildet. Ob Störungen während dieser Etablierungsphase – z. B. durch eine Antibiotikatherapie – auch beim Menschen Auswirkungen auf die frühkindliche Gehirnentwicklung haben, kann zurzeit allerdings noch nicht beantwortet werden.
Darmmikrobiota und Mikroglia des Gehirns
Während seit Langem bekannt ist, dass die Mikrobiota regulierend auf das Mukosa-assoziierte Immunsystem des Darms einwirkt, entdeckten Forscher nun, dass die intestinale Mikrobiota auch die Reifung und Funktion der Immunzellen des Gehirns, der sogenannten Mikroglia, kontrolliert [13]. So zeigt die Mikroglia keimfreier Mäuse einen unreifen Phänotyp und ist nicht in der Lage, eine effektive Immunantwort zu generieren. Wurde die Diversität der natürlichen Mikrobiota bei normalen Mäusen durch eine vierwöchige Antibiotikabehandlung stark reduziert, führte dies zu einem ähnlichen Phänotyp. In beiden Fällen war der Effekt reversibel, und die Rekonstitution der natürlichen, komplexen Mikrobiota bewirkte eine fast vollständige Wiederherstellung der normalen Immunfunktion im Gehirn.
Ob die Ergebnisse aus dem Mausmodell auf den Menschen übertragbar sind und eine reduzierte Diversität der Mikrobiota ebenfalls den Immunstatus des Gehirns beeinflusst, muss noch geprüft werden. Da dysfunktionale Mikrogliazellen u. a. mit der Entstehung neurodegenerativer Erkrankungen wie multipler Sklerose und Alzheimer-Demenz in Verbindung gebracht werden, stellt sich auch die Frage, ob die Darmmikrobiota den Krankheitsverlauf beeinflussen kann und somit eventuell einen Ansatzpunkt bei der Prävention und Therapie darstellt. Um diese und weitere Fragen beantworten zu können, gilt es jedoch zunächst, die grundlegenden Mechanismen zu entschlüsseln, mittels derer die Mikrobiota mit den Darmepithelzellen, Immunzellen, den Neuronen des ENS und möglicherweise auch dem menschlichen Gehirn kommuniziert.
Probiotika und ihre Anwendungsgebiete
Im Gefolge der expandierenden Erforschung der Darmmikrobiota hat auch das Konzept, die Physiologie des Verdauungstraktes mit lebenden Mikroorganismen, sogenannten Probiotika, zu beeinflussen, mehr Beachtung erfahren. Während die Hersteller zahlreiche gesundheitsfördernde Wirkungen von Probiotika bereits jahrelang medienwirksam beworben haben, ist ihr Stellenwert bei der Prävention und Therapie von Krankheiten in Fachkreisen immer noch umstritten. Das liegt an den meist ungenügenden Wirksamkeitsnachweisen, die oftmals auf Studien mit mangelhaftem Design (unverblindet, ohne Placebo-Kontrolle) und kleinen Teilnehmerzahlen beruhen. Die Inkonsistenzen bezüglich des verwendeten Bakterienstamms, der Dosis und der Darreichungsfom (Kapsel, Flüssigkeit, Lebensmittel) erschweren zudem die Vergleichbarkeit verschiedener Studien.
Grundsätzlich gilt, dass die Wirkung eines Probiotikums stamm- und krankheitsspezifisch ist. Entsprechend können keine Rückschlüsse auf verwandte Bakterienspezies oder einen möglichen Nutzen bei anderen Erkrankungen gezogen werden. Während es bei extraintestinalen Erkrankungen noch keine evidenzbasierte Empfehlung für den Einsatz von Probiotika gibt, konnte bei einigen intestinalen Krankheitsbildern ein Nutzen bestimmter Probiotika wissenschaftlich belegt werden.
Der Begriff „Probiotika“
Der Verbraucherzentrale Bundesverband (vzbv) weist darauf hin, dass die Einstufung von Lebensmitteln mit speziellen Bakterienkulturen als „Probiotika“ nicht mehr üblich ist. Nachdem die Europäische Behörde für Lebensmittelsicherheit (EFSA) keine gesundheitsbezogenen Angaben bei diesen Produkten erlaubt hat (sofern sie außer den Bakterien nicht andere gesundheitsfördernde Stoffe enthalten), stellt die Bezeichnung eines Lebensmittels als „Probiotikum“ eine nicht zugelassene gesundheitsbezogene Angabe dar. Die Hersteller haben daher das Wort „probiotisch“ aus ihrem Wortschatz und von den Verpackungen ihrer Produkte gestrichen. Dagegen ist die Bezeichnung eines Arzneimittels als „Probiotikum“ erlaubt, wenn seine entsprechende Wirksamkeit nachgewiesen wurde.
In der wissenschaftlichen Literatur ist der Begriff „Probiotikum“ seit Langem eingeführt und wird dort weitgehend unabhängig von aktuellen lebensmittelrechtlichen Bestimmungen verwendet. Deshalb dürfte der Begriff dort auch nicht so schnell verschwinden wie im Markt, sondern weiterhin bestehen bleiben. Auch in diesem Beitrag wird „Probiotikum“ wie in der wissenschaftlichen Literatur verwendet und stellt keine Bewertung von Produkten dar.
Quelle: www.verbraucherzentrale.de/Probiotika, Stand 4.3.2016
Colitis ulcerosa. In Hinsicht auf Indikation, Wirksamkeit und Verträglichkeit ist das probiotische Arzneimittel Mutaflor® mit dem Escherichia coli-Stamm Nissle 1917 am besten untersucht. Dieser Bakterienstamm wurde bereits 1917 von dem Freiburger Bakteriologen Alfred Nissle aus dem Stuhl eines Soldaten isoliert, der im Gegensatz zu seinen Kameraden nicht an Diarrhö erkrankt war. Mittlerweile wurde ein klinischer Nutzen von E. coli Nissle 1917 bei der remissionserhaltenden Therapie von Colitis ulcerosa in sechs Placebo-kontrollierten Studien mit mehr als 700 Patienten nachgewiesen. Dabei zeigte das Probiotikum im Vergleich zur Standardtherapie mit dem Entzündungshemmer Mesalazin eine äquivalente Wirksamkeit und Sicherheit [14]. Für Patienten mit einer Mesalazin-Unverträglichkeit stellt E. coli Nissle 1917 somit eine effektive und sichere Alternative zur Rezidivprophylaxe dar [14]. Allerdings wurde bei aktiver Colitis ulcerosa keine Remissionsinduktion durch E. coli Nissle 1917 nachgewiesen.
Ein weiteres Probiotikum, das im Zusammenhang mit Colitis ulcerosa häufig Erwähnung findet, ist VSL#3. Das Kombinationspräparat aus acht verschiedenen grampositiven Bakterien (Streptococcus salivarius ssp. thermophilus, Bifidobacterium longum, B. infantis, B. breve, Lactobacillus casei, L. plantarum, L. acidophilus und L. delbrueckii ssp. bulgaricus) wird in Deutschland als Nahrungsergänzungsmittel vertrieben, für das kein Wirksamkeitsnachweis geführt werden muss. Die Studienlage ist jedoch vielversprechend: Fünf Studien mit mehr als 400 Patienten kamen zu dem Ergebnis, dass VSL#3 als Ergänzung zur Standardtherapie bei Patienten mit aktiver Colitis ulcerosa die Remissionsrate signifikant stärker erhöht [15]. Während E. coli Nissle 1917 und VSL#3 inzwischen in die aktuellen Leitlinien zur Behandlung von Colitis ulcerosa aufgenommen wurden, konnte ein klinischer Nutzen von Probiotika bei Morbus Crohn bislang nicht festgestellt werden – weder zur Remissionsinduktion noch zur Rezidivprophylaxe.
Reizdarmsyndrom. Auch in der aktuellen S3-Leitlinie zum Reizdarmsyndrom (RDS) wird erstmalig die Gabe ausgewählter Probiotika als evidenzbasierte Therapieoption empfohlen [14]. Dabei können einzelne Symptome des RDS durch Probiotika gelindert, in der Regel jedoch nicht zum vollständigen Abklingen gebracht werden. Entscheidend ist, dass die Wahl des Probiotikums Symptom-orientiert erfolgt, denn nicht jeder Bakterienstamm wirkt bei jedem RDS-Typ [16]. Bei Obstipation können neben E. coli Nissle 1917 auch Lactobacillus casei Shirota (in Yakult®) und Bifidobacterium lactis DN-173010 (in Activia®) eine Verkürzung der Kolontransitzeit bewirken. Im Tierversuch wurde gezeigt, dass keimfreie Ratten eine gesteigerte viszerale Sensitivität entwickeln, nachdem ihnen die Mikrobiota von RDS-Patienten transplantiert wurde [17]. Diese Ergebnisse legen nahe, dass die Darmbakterien auch Einfluss auf die Reizempfindlichkeit nehmen können. Tatsächlich wurde für bestimmte probiotische Bakterienstämme wie L. casei Shirota und B. lactis DN‑173010 gezeigt, dass sie bei RDS-Patienten einen Rückgang abdominaler Schmerzen bewirken können. Da das RDS verschiedene pathophysiologische Ursachen hat, kann nur die praktische Anwendung zeigen, ob ein Patient von einem bestimmten Probiotikum profitiert oder nicht.
Antibiotika-assoziierte Diarrhö. Der am häufigsten untersuchte Anwendungsbereich von Probiotika ist die Antibiotika-assoziierte Diarrhö, die bei prophylaktischer Einnahme der Hefe Saccharomyces boulardii (in Perenterol®) weniger als halb so häufig auftritt [18]. Zudem wurde gezeigt, dass S. boulardii und Lactobacillus rhamnosus GG (LGG®, in Aktifit) [19] die Krankheitsdauer um durchschnittlich einen Tag verkürzen können.
Fäkale Mikrobiota-Transplantation (FMT)
Während probiotische Lebensmittel mit lebenden Mikroorganismen schnell auf eine breite Akzeptanz in der Bevölkerung stießen, wurde der Therapieansatz der Stuhlübertragung lange Zeit als Sinnbild von Verzweiflung belächelt. Dabei ist das Konzept nicht neu: Bereits im 4. Jahrhundert beschrieb der chinesische Arzt Ge Hong in einem Lehrbuch der Notfallmedizin die Stuhltransplantation bei Diarrhö. Nachdem 1958 eine erste kleine Fallserie der Fäkaltherapie mit guten Erfolgen bei schwersten Diarrhöen publiziert worden war, geriet die Methode aufgrund der Entdeckung immer neuer Antibiotika wieder in Vergessenheit [20]. Erst Jahrzehnte später weckte die zunehmende Inzidenz von therapierefraktären Infektionen mit toxinbildenden Clostridium-difficile-Stämmen erneut das Interesse an der Stuhltransplantation oder fäkalen Mikrobiota-Transplantation (FMT) [21].
C. difficile ist der häufigste Erreger nosokomialer Diarrhöen und kann im schwersten Fall eine lebensbedrohliche Darmentzündung hervorrufen. Da eine initiale C. difficile-Infektion (CDI) besonders häufig nach einer Antibiotikatherapie auftritt, wird angenommen, dass erst die Störung der natürlichen Mikrobiota die unkontrollierte Vermehrung von C. difficile möglich macht [22 – 24]. Die FMT zielt auf die schnelle Wiederherstellung der intestinalen Homöostase und der damit einhergehenden Kolonisierungsresistenz gegenüber C. difficile ab. Der entscheidende Unterschied zur Einnahme von Probiotika besteht darin, dass nicht ein einzelner, gezüchteter Bakterienstamm transferiert wird, sondern ein Kollektiv unterschiedlichster Mikroorganismen, wie es natürlicherweise im Darm eines gesunden Spenders vorkommt. In der Tat konnte im Rahmen der ersten kontrollierten Studie zur FMT bei rezidivierender CDI gezeigt werden, dass sich die ursprünglich stark reduzierte Diversität der Mikrobiota bereits zwei Wochen nach der FMT auf dem Niveau des gesunden Spenders befand [25]. Diese Studie wurde vorzeitig beendet, da die FMT der Standardtherapie (und dem Placebo) so signifikant überlegen war, dass ein Weiterführen für die Patienten der Kontrollgruppe ethisch nicht vertretbar gewesen wäre. Mittlerweile wurde eine klinische Heilungsrate von durchschnittlich 85 Prozent bei mehr als 500 Patienten mit rezidivierender CDI bestätigt [26]. Schwere Nebenwirkungen der FMT wurden bislang nicht beschrieben, jedoch stehen Langzeitbeobachtungen noch aus, sodass Spätrisiken möglich sind.
Der Spenderstuhl ist per se infektiöses Material. Um das Risiko einer Krankheitsübertragung zu minimieren, werden Blut- und Stuhlproben des potenziellen Spenders auf das Vorhandensein zahlreicher Infektionskrankheiten untersucht. Da die Rolle der Darmmikrobiota bei der Entstehung verschiedenster Erkrankungen noch nicht geklärt ist, bleibt jedoch ein Restrisiko, denn theoretisch ist es möglich, dass durch eine FMT derzeit noch unbekannte prädisponierende Krankheitsfaktoren übertragen werden können.
Aufgrund der Erfolge bei rezidivierender CDI stellt sich die Frage, ob die Stuhltransplantation auch für Patienten mit anderen Erkrankungen Heilungschancen birgt. Aufgrund der noch unbekannten Langzeitrisiken ist die Indikationsstellung der FMT jedoch sehr eng. Die Durchführung erfolgt derzeit ausschließlich bei CDI-Patienten, die trotz Anwendung etablierter Therapieschemata multiple Rezidive hatten. Weitere Anwendungsgebiete für die Stuhltransplantation müssen in kontrollierten Studien geprüft werden. Erste Ergebnisse liegen für die Anwendung der FMT bei aktiver Colitis ulcerosa vor, wo der erhoffte Erfolg allerdings weit hinter den Erwartungen zurückblieb [27].
Um die Erfolgsvoraussetzungen und mögliche Spätrisiken der FMT erkennen zu können, hat das Universitätsklinikum Jena in Zusammenarbeit mit der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) ein zentrales, deutschlandweites Online-Register der Patienten- und Spenderdaten („MikroTrans“) eingerichtet. Anhand der gesammelten Informationen sollen standardisierte Protokolle bezüglich des Spenderscreenings, der Aufbereitung des Stuhls und der optimalen Applikationsart erarbeitet werden.
Künftige Erforschung des Ökosystems Darm
Alle vielzelligen Organismen sind dauerhaft mit spezifischen Gemeinschaften von Mikroorganismen assoziiert und bilden mit ihnen eine funktionelle Einheit, den „Metaorganismus“ oder „Holobiont“ [28, 29]. Deshalb können Störungen innerhalb der mikrobiellen Lebensgemeinschaft erhebliche Konsequenzen für den Wirt haben. Während der Darm urspünglich als reines Verdauungsorgan betrachtet wurde, weiß man heute, dass er mit der Mikrobiota ein komplexes Ökosystem beherbergt, das mit dem Immunsystem und dem Nervensystem kommuniziert. Beim Menschen korrelieren zahlreiche chronische Erkrankungen mit Veränderungen der Darmmikrobiota, und die Wiederherstellung der physiologischen Mikrobiota gewinnt als therapeutisches Konzept immer mehr an Bedeutung.
Bei den meisten Mikrobiota-assoziierten Erkrankungen wurde eine deutliche Abnahme der bakteriellen Diversität beobachtet, die meist auch mit dem Verlust bestimmter metabolischer Funktionen einhergeht. Man nimmt daher an, dass eine hohe Arten- und Genvielfalt im Ökosystem Darm für die Gesundheit von großer Bedeutung ist. Dies erklärt auch den Effekt der FMT bei therapierefraktären C. difficile-Infektionen. Ob die FMT auch bei multifaktoriellen und genetisch heterogenen Erkrankungen eine Behandlungsoption darstellt, bleibt noch abzuwarten. Erste Versuche der Stuhltransplantation bei Colitis-ulcerosa-Patienten zeigten, dass die stabile Etablierung der komplexen Spendermikrobiota nicht bei allen Menschen gelingt.
Eine hohe Artenvielfalt allein macht das Ökosystem Darm offenbar nicht stabil; auch Faktoren des Wirts (Mensch), die sowohl genetisch als auch durch Umwelteinflüsse bedingt sind, haben entscheidenden Einfluss. Beispielsweise wurden bereits mehr als 100 verschiedene Genvariationen ermittelt, die in bestimmten Kombinationen die Entstehung einer chronisch entzündlichen Darmerkrankung (CED) wie Morbus Crohn oder Colitis ulcerosa begünstigen können. Insofern erscheint es unwahrscheinlich, dass es eine universelle, für jeden CED-Patienten anwendbare mikrobielle Therapie gibt. Durch die Einbeziehung genetischer Determinanten des Wirts wird die Entwicklung neuer Therapieformen zwar komplexer, aber auch realistischer.
Der menschliche Darm ist von mehreren hundert Bakterienspezies besiedelt, die in vielfältigen Beziehungen zueinander stehen. Sie konkurrieren um Nährstoffe und Bindungsstellen, verdrängen sich unter Umständen gegenseitig oder profitieren voneinander und wirken dabei auf metabolische, immunologische und möglicherweise auch neurologische Prozesse des menschlichen Wirts ein.
Versuche mit Hydra
Der Süßwasserpolyp Hydra, ein naher Verwandter der Quallen, ist auch ohne adaptives Immunsystem in der Lage, eine diverse bakterielle Gemeinschaft zu orchestrieren. Dabei läuft die Etablierung der Mikrobiota in jungen Individuen nach ähnlichen Regeln ab wie beim Menschen [30].
Die natürliche Mikrobiota schützt Hydra vor Pilzinfektionen, während sie in Abwesenheit ihrer bakteriellen Partner erkrankt [31]. Entscheidend ist auch hier die Diversität der Mikrobiota. Wurden keimfreie Individuen nur mit einzelnen Bakterienspezies besiedelt, konnten sie keinen vollständigen Schutz gegenüber pathogenen Pilzen ausbilden; erst nach der Wiederherstellung der komplexen Mikrobiota waren sie resistent.
Diese Ergebnisse zeigen, dass die Kolonisierungsresistenz ein uralter Schutzmechanismus ist, der in der Evolutionsgeschichte von Hydra bis zum Menschen erhalten geblieben ist. Einfache Organismen stellen somit wertvolle Modelle dar, um grundlegende Prinzipien der Entstehung und Erhaltung eines Metaorganismus zu entschlüsseln.
Die grundlegenden Prinzipien, die zur stabilen Etablierung einer diversen Mikrobiota beitragen, versucht man in den letzten Jahren auch systembiologisch zu erforschen. (Die Systembiologie beschreibt Stoff- oder Signalflüsse innerhalb komplexer biologischer Systeme in Form von mathematischen Modellen.) Das Fernziel ist es, mithilfe von Modellen das Verhalten einer definierten bakteriellen Gemeinschaft in einem bestimmten Umfeld vorhersagen zu können. So wüsste man auch, welche Bakterienspezies bzw. Konsortien für die gezielte Hemmung von spezifischen Pathogenen geeignet sind. Ein entsprechendes Probiotikum könnte dann nach einer Antibiotikatherapie zur Prävention von Clostridium-difficile-Infektionen Anwendung finden.
Derzeit sind solche individualisierten Probiotika, deren Komposition unter Berücksichtigung des Krankheitsbildes bzw. der gestörten Mikrobiota des Empfängers erfolgt, allerdings noch Zukunftsmusik. Nicht nur die Artenvielfalt der Mikrobiota, auch die Komplexität des Immunsystems und die hohe genetische Variabilität des Menschen machen es schwierig, computergestützte Vorhersagen experimentell zu überprüfen. Eine Alternative sind Experimente mit primitiven, einfach gebauten Vielzellern (s. Kasten „Versuche mit Hydra“). |
Literatur
[1] Qin J, et al. A human gut microbial gene catalogue established by metagenomic sequencing. Nature 2010;464(7285):59-65
[2] Wu GD, Lewis JD. Analysis of the human gut microbiome and association with disease. Clin Gastroenterol Hepatol 2013;11(7):774-7
[3] Structure, function and diversity of the healthy human microbiome. Nature 2012;486(7402):207-14
[4] Sudo N, et al. Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 2004;558(1):263-75
[5] Clarke G, et al. The microbiome-gut-brain axis during early life regulates the hippocampal serotonergic system in a sex-dependent manner. Mol Psychiatry 2013;18(6):666-73
[6] Heijtz RD, et al. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci 2011;108(7):3047-3052
[7] Neufeld KM, et al. Reduced anxiety-like behavior and central neurochemical change in germ-free mice. Neurogastroenterol Motil 2011;23(3):255-64
[8] Perez-Burgos A, et al. Psychoactive bacteria Lactobacillus rhamnosus (JB-1) elicits rapid frequency facilitation in vagal afferents. Am J Physiol Gastrointest Liver Physiol 2013;304(2):G211-20
[9] Bravo JA, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci 2011;108(38):16050-5
[10] Bercik P, et al. The anxiolytic effect of Bifidobacterium longum NCC3001 involves vagal pathways for gut-brain communication. Neurogastroenterol Motil 2011;23(12):1132-9
[11] Wang X, et al. Evidences for vagus nerve in maintenance of immune balance and transmission of immune information from gut to brain in STM-infected rats. World J Gastroenterol 2002;8(3):540-5
[12] Borovikova LV, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature 2000;405(6785):458-62
[13] Erny D, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci 2015;18(7):965-977
[14] Losurdo G, et al. Escherichia coli Nissle 1917 in Ulcerative Colitis Treatment: Systematic Review and Meta-analysis. J Gastrointestin Liver Dis 2015;24(4):499-505
[15] Mardini HE, Grigorian AY. Probiotic mix VSL#3 is effective adjunctive therapy for mild to moderately active ulcerative colitis: a meta-analysis. Inflamm Bowel Dis 2014;20(9):1562-7
[16] Andresen V, et al. Reizdarmsyndrom – die wichtigsten Empfehlungen. Dtsch Arztebl Int 2011;108(44):751-60
[17] Crouzet L, et al. The hypersensitivity to colonic distension of IBS patients can be transferred to rats through their fecal microbiota. Neurogastroenterol Motil 2013;25(4):e272-82
[18] Micklefield G. Saccharomyces boulardii bei Antibiotika-assoziierter Diarrhöe. MMW Fortschr Med 2014;156(S1):18-22
[19] Szajewska H, Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther 2015;42(10):1149-57
[20] Eiseman B, et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958;44(5):854-9
[21] Ananthakrishnan AN. Clostridium difficile infection: epidemiology, risk factors and management. Nat Rev Gastroenterol Hepatol 2011;8(1):17-26
[22] Brown KA, et al. Meta-analysis of antibiotics and the risk of community-associated Clostridium difficile infection. Antimicrob Agents Chemother 2013;57(5):2326-32
[23] Deshpande A, et al. Community-associated Clostridium difficile infection and antibiotics: a meta-analysis. J Antimicrob Chemother 2013;68(9):1951-61
[24] Slimings C, Riley TV. Antibiotics and hospital-acquired Clostridium difficile infection: update of systematic review and meta-analysis. J Antimicrob Chemother 2014;69(4):881-91
[25] van Nood E, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013;368(5):407-15
[26] Drekonja D, et al. Fecal Microbiota Transplantation for Clostridium difficile Infection: A Systematic Review. Ann Intern Med 2015;162(9):630-8
[27] Rubin DT. Curbing our enthusiasm for fecal transplantation in ulcerative colitis. Am J Gastroenterol 2013;108(10):1631-3
[28] Fraune S, et al. Das Prinzip Metaorganismus. BIOspektrum 2011;17(6):634-636
[29] Bosch TCG, Miller DJ. The Holobiont Imperative: Perspectives from Early Emerging Animals. Springer, 2016
[30] Franzenburg S, et al. Bacterial colonization of Hydra hatchlings follows a robust temporal pattern. ISME J 2013;7(4):781-90
[31] Fraune S, et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J 2015;9(7):1543-56
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.