
- DAZ.online
- DAZ / AZ
- DAZ 17/2016
- Mischen impossible
Rezeptur
Mischen impossible?
Rezepturen mit industriell gefertigten Dermatika
Industrieprodukte als Ausgangsstoffe?
Rechtlich kann es sich bei industriell hergestellten Produkten, die in der Rezeptur als Ausgangsstoffe verwendet werden, um zugelassene oder registrierte Fertigarzneimittel handeln, um Halbfertigware für die Arzneiherstellung, Medizinprodukte oder Kosmetika. Entscheidend für die Rezepturherstellung ist, ob das Präparat unter Produktionsbedingungen eines Arzneimittels hergestellt worden ist (siehe Tabelle 1). Unabhängig vom Produktstatus sind nur solche Ausgangsstoffe für die Arzneiherstellung erlaubt, deren pharmazeutische Qualität nachgewiesen ist.
industriell gefertigte Produkte |
in der Rezeptur erlaubt? |
Beispiele |
|
|---|---|---|---|
zugelassene oder registrierte Fertigarzneimittel
|
wirkstoffhaltig |
ja |
Ciclopoli® Creme
Decoderm® BasiscremeDecoderm® CremeLinoladiol® N Creme
Linola® Fett Creme
|
Halbfertigware = Zwischenprodukte und Ausgangsstoffe für die Arzneiherstellung ohne Zulassung als Fertigarzneimittel
|
Markenprodukte |
nur unter folgenden Bedingungen:
arzneimittelrechtliche Eignung durch valides produkt- und chargenbezogenes Prüfzertifikat bestätigt
+
Identitätsnachweis in der Apotheke
|
Basis Cordes® RKEucerinum® anhydricumUnguentum Cordes®
|
vorgefertigt bezogene offizinelle Grundlagen |
Basiscreme DACWollwachsalkoholsalbe DAB |
||
Zubereitungen, die als Medizinprodukte in den Verkehr gebracht werden |
Wasserfuhr Elektrodengel®(Fa. Caelo) |
||
Kosmetika |
Asche Basis® Creme, Excipial® Mandelölsalbe |
||
Zugelassene Fertigarzneimittel machen da weniger Probleme. Ihre Zulassung setzt voraus, dass Herstellung und Qualität dem Arzneimittelrecht entsprechen, sie dürfen in der Rezeptur verwendet werden. Anders ist das für wirkstofffreie Zubereitungen ohne Zulassung, die ausschließlich als Arzneiträger gedacht sind. Sie zählen zu den Ausgangsstoffen als Zwischenprodukte. Liegt ein valides Prüfzertifikat nach § 6 ApBetrO vor, so dürfen sie verwendet werden. Zertifikate liefern die Hersteller meistens mit dem Produkt oder zum Download. Liegt kein Prüfzertifikat vor, so müssen in der Apotheke vollumfänglich Identität, Gehalt und Reinheit geprüft werden. Für Medizinprodukte und Kosmetika gilt grundsätzlich dasselbe: Sie dürfen verarbeitet werden, allerdings nur, wenn ein gültiges Prüfzertifikat die arzneimittelrechtliche Eignung sowohl für das Produkt als auch für die Charge bestätigt [7, 11]. Trotz vorliegender Zertifikate muss die Apotheke bei Ausgangsstoffen und Arzneimitteln, die keine Fertigarzneimittel sind (vgl. ApBetrO § 11) einen eindeutigen Identitätsnachweis führen. Dies erleichtern apothekengerechte Prüfanweisungen, die viele Hersteller rezepturüblicher Zwischenprodukte inzwischen entwickelt haben. Fertigarzneimittel nimmt die ApBetrO ausdrücklich von der Prüfpflicht für Ausgangsstoffe aus.
Galenische Problematik
Grundsätzlich muss man sich klar machen, dass jedes Industriepräparat ein ausgeklügeltes galenisches System ist. Es wurde über Jahre entwickelt mit dem Ziel bestmöglicher Stabilität. Das betrifft die pH-Wert-Optimierung für Konservierungsmittel und Wirkstoffe ebenso wie die häufig hochkomplexe Kombination von Emulgatoren. Jede Weiterverarbeitung gefährdet das Gleichgewicht und damit die Stabilität. Was ist dabei zu beachten?
- Die Konservierung muss gewährleistet sein.
- Nachteilige pH-Veränderungen und das Aufeinandertreffen inkompatibler Verbindungsklassen sind auszuschließen.
- Es dürfen nur gleiche Emulsionstypen gemischt werden.
Risikofaktor Unterkonservierung
Mikrobiell instabile Rezepturen zählen zu den Arzneimitteln, bei denen man ganz besonders auf die Sicherstellung der erforderlichen Qualität achten muss. Die Frage nach der Konservierung ist daher von zentraler Bedeutung. Handelspräparate sind über einen gewissen Zeitraum mikrobiell stabil. Sofern sie ein Konservierungsmittel enthalten, ist dieses optimal konzentriert. Beim Mischen verdünnen sich die beteiligten Präparate gegenseitig, was zur Unterkonservierung führen kann. Sind die Konservierungsstoffe ohne Mengenangabe deklariert, hilft nur abzuschätzen, ob die Konzentration im Endprodukt ausreicht: Sofern beide Komponenten mit dem gleichen Stoff ausreichend konserviert sind, kann man es für deren Mischung auch annehmen (siehe Beispiel 1):
Ciclopoli® Creme |
20,0 g |
O/W, nicht-ionisch, konserviert mit Benzylalkohol |
Dermatop® Creme |
ad 30,0 g |
O/W, nicht-ionisch, konserviert mit Benzylalkohol |
zugelassene Fertigarzneimittel, gleicher Grundlagentyp, gleiches Konservierungsmittel, pH-Bereiche kompatibel [12] → Rezeptur ist galenisch plausibel | ||
Ist eine Komponente nicht konserviert, verdünnt sie die Konservierung der anderen. Es muss entsprechend nachkonserviert werden. Das kann selbst dann der Fall sein, wenn mit einer reinen Fettgrundlage verdünnt wird, denn Konservierungsstoffe verteilen sich teilweise in die Fettphase um. Gefährlich wird es, wenn zwei verschieden konservierte Präparate gemischt werden – siehe Beispiel 2.
Betnesol® V Creme |
50,0 g |
O/W-Creme, konserviert mit Chlorokresol |
Betnesol® V Crinale |
30,0 g |
Lösung, konserviert durch Isopropanol |
Aqua purificata |
ad 100,00 g |
|
In der Kombination und wegen zusätzlicher Wasserzugabe sind im Endprodukt beide konservierenden Stoffe deutlich verdünnt! Konservierung ist nicht gesichert! [12] → Nachkonservierung erforderlich | ||
Im Endprodukt fallen beide Substanzen unter die jeweils wirksame Konzentration. Falls es im konkreten Fall nicht zufällig zu synergistischen Effekten der beiden Konservierungsmittel kommt, wird das Keimwachstum nicht mehr zuverlässig gehemmt und möglicherweise eine Resistenzentwicklung begünstigt. Wenn für eine solche Mischung die Stabilität nicht experimentell nachgewiesen ist, ist davon abzuraten. Außer dem Verdünnen können auch das Verschieben des pH-Werts und das Aufeinandertreffen inkompatibler Verbindungsklassen die Konservierung gefährden.
pH-Wert-Veränderungen
In wasserhaltigen Zubereitungen sind die pH-Verhältnisse wesentlich für die Stabilität und Wirksamkeit der Arzneistoffe. Fast alle Konservierungsstoffe sind nur in einem bestimmten pH-Bereich wirksam! Bei Produkten, die als Arzneiträger vertrieben werden, gibt der Hersteller den pH-Wert in der Regel an. Ist der pH-Wert einer Grundlage nicht angegeben, kann man versuchen ihn abzuleiten: Fertigarzneimittel sind auf Stabilität optimiert. Sie sind also auf den rezeptierbaren pH-Bereich des Wirkstoffs oder des Konservierungsmittels eingestellt. Die beste Einschätzung ermöglicht ein vorhandenes Puffersystem. Sofern die pH-Bereiche übereinstimmen, ist Mischen unproblematisch, andernfalls ist davon abzuraten. Umgekehrt ist zu beachten, dass Wirkstoffe ihrerseits den pH-Wert verschieben können und dadurch andere Bestandteile gefährden – siehe Beispiele 3 und 4.
Erythromycin |
1,0 g |
pH-Bereich 7 bis 10 |
Milch Cordes®
|
zu 50,0 g |
konserviert mit Sorbinsäure, pH 3,5 bis 4,7 |
Der Hersteller bestätigt für die genannte Formel galenische Stabilität und ausreichenden Wirkstoffgehalt bis zu vier Wochen, gibt aber zu Bedenken, dass Sorbinsäure bei Verarbeitung von basisch reagierenden Wirkstoffen ihre Wirksamkeit verliert [4] → sehr kurze Aufbrauchsfrist | ||
Clotrimazol |
1,0 g |
hydrolysiert im Sauren |
Salicylsäure |
2,5 g |
bewirkt sauren pH-Wert |
Asche Basis® Creme
|
ad 50,0 g |
enthält Polyacrylatgel |
Salicylsäure erzeugt ein saures Milieu, in dem Clotrimazol hydrolysiert, außerdem verflüssigt die Säure das Polyacrylatgel der Creme [10] → Rezeptur ist nicht plausibel | ||
Inkompatible Verbindungsklassen
Aus kationischen und anionischen Stoffen können sich im wässrigen Milieu schwerlösliche Verbindungen bilden. Darunter kann die Wirksamkeit von Emulgatoren, Konservierungsmitteln oder Wirkstoffen leiden. Des Weiteren können sich Stoffe mit macrogolischen und phenolischen Strukturen gegenseitig inaktivieren. Auch wenn die Wechselwirkung nicht immer zu galenisch relevanten Reaktionen führt, sollte man sicherheitshalber auch larvierten Inkompatibilitäten vorbeugen. Beim Zusammentreffen zweier Cremes ist dies zwischen nicht-ionischen Emulgatoren, die häufig Macrogol-Partialstrukturen enthalten, und Parabenen (p-Hydroxybenzoesäureestern) denkbar. Hier könnte das Konservierungsmittel unwirksam werden oder die Emulsion auch später noch brechen. Darum ist es nötig, auch die Bestandteile der Grundlagen auf ihre Verbindungsklassen zu überprüfen. Die Verbindungsklassen und pH-Bereiche der Inhaltsstoffe der meisten rezepturüblichen Handelspräparate findet man in den gängigen Printwerken und Datenbanken zur Plausibilitätsprüfung.
Verschiedene Emulsionstypen nicht mischen
Bei halbfesten Mischungen gehört das Aufeinandertreffen von gegensätzlichen Emulgatoren zu den bedeutsamen Inkompatibilitäten. Das DAB 10 wies daher an: „Das Verdünnen von Fertigarzneimittelsalben muss [...] mit einer geeigneten Salbengrundlage vom gleichen Typ erfolgen“ [2]. Dies findet sich in der aktuellen Leitlinie der Gesellschaft für Dermopharmazie wieder: „Ein Fertigarzneimittel soll möglichst mit der identischen Grundlage oder nach Plausibilitätsprüfung durch den Apotheker mit einer voraussichtlich kompatiblen Grundlage verarbeitet werden“ [1]. Beim Mischen von O/W- und W/O-Systemen resultieren in der Regel instabile Zubereitungen. Kombinationen beider Emulgator-Typen, wie man sie von amphiphilen Cremes kennt, werden in intensiver Forschung geplant und laboranalytisch untersucht. Zufällig entstehen solche Systeme nicht. Normalerweise stören sich die verschiedenartigen Emulgator-Moleküle an der Grenzfläche, so dass als Folge die homogene Wirkstoffverteilung und die dermale Verfügbarkeit leiden. Auch kann die Emulsion brechen. Aus galenischer Sicht sollten solche Mischungen nur hergestellt werden, wenn die Kompatibilität nachgewiesen wurde.
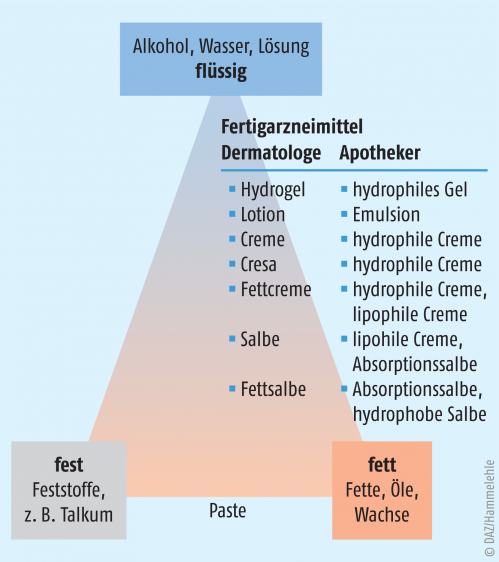
Woran erkennt man den Grundlagentyp?
Gemeinhin geht man davon aus, dass sich O/W-Systeme mit Wasser und W/O-Systeme mit Öl verdünnen lassen. Die Ergebnisse dieser experimentellen Methode sind bei hochkomplexen Industrieprodukten jedoch oft unklar. Auch aus der Bezeichnung lassen sich nur ungefähre Rückschlüsse auf die Phasenlage ziehen. Die Angaben bei Fertigarzneimitteln entsprechen eher der ärztlichen Systematik als der des Arzneibuchs. Während „Salbe“ pharmazeutisch ein wasserfreies einphasiges System bezeichnet, bezeichnen Dermatologen auch lipophile Cremes als „Salbe“ (siehe Abb. 1). Für die Rezeptur ist es zu begrüßen, dass zunehmend mehr Hersteller auch die pharmazeutisch korrekte Bezeichnung angeben. Andernfalls lässt sich die Phasenlage aus den verwendeten Emulgatoren erschließen. Eine Liste von Emulgatoren, auch solchen, die weniger üblich sind, findet man im NRF-Rezepturhinweis „Tenside – Netzmittel, Emulgatoren und Solubilisatoren“ [8].
Wozu Emulsionstypen mischen?
Die Grundlage leistet einen wesentlichen Beitrag zum Therapieerfolg. Der Arzt wählt sie nach dem Hautzustand des erkrankten Areals. W/O-Cremes halten Wasser in der Hornschicht und sind für trockene Hautbezirke und bei chronischen Prozessen angezeigt. O/W-Systeme wirken kühlend und austrocknend. Sie werden bei akuten und subakuten Prozessen, auf normaler, fetter und sezernierender Haut angewendet. Da beide Hautzustände nicht gleichzeitig vorliegen können, ist es auch aus therapeutischer Sicht unlogisch Emulsionstypen zu mischen. Die Frage ist: Was will der Arzt durch das Mischen erreichen? Häufig möchte er einfach nur das wirkstoffhaltige Fertigarzneimittel verdünnen und greift aus Mangel an galenischen Kenntnissen zu einer ungeeigneten Grundlage. Das könnte beim aufgeführten Rezepturbeispiel (siehe Abb. 2) der Fall sein. Um den Wirkstoff zu verdünnen, lässt sich auf die bereits enthaltene Grundlage zurückgreifen. Besteht der Arzt trotz eines aufklärenden Gesprächs auf Verdünnung mit einer O/W-Absorptionsbase, sollte man zumindest eine Mischung wählen, deren Stabilität belegt ist [9].
Warum aber werden Fertigarzneimittel mit O/W-Systemen und W/O-Systemen gemischt und es wird kein zusätzlicher Wirkstoff eingebracht? Mediziner stellen therapeutische Überlegungen an und entscheiden sich für einen therapiegerechten Fett- und Feuchtigkeitsgehalt. Galenische Sachverhalte sind ihnen meist unbekannt. Der Rezeptur mag die irrige Vorstellung zugrunde liegen, durch Kombination von O/W- und W/O-Cremes lediglich das Fett-Wasser-Verhältnis zu beeinflussen [10]. Dazu lässt sich die folgende, verbreitete Rezepturformel betrachten:
Linola® Creme
Linola® Fett N Creme āā
Diese Rezeptur ist galenisch eine spannende Sache: Das Endprodukt hängt nämlich von der Herstellungsweise ab! Erwärmt man die beiden Komponenten auf mindestens 65°C und rührt sie bis zum Erkalten, erhält man nach Phasenumkehr eine stabile O/W-Creme. Eine hydrophile Creme resultiert bei Raumtemperatur nur dann, wenn man Linola® vorlegt und die Linola® Fett N Creme einarbeitet. Geht man dagegen in umgekehrter Reihenfolge vor, erhält man eine festere W/O-Emulsion. Jedoch zeigen beide kalt hergestellten Varianten unter dem Mikroskop größere, tröpfchenartige Einschlüsse und keine homogene Cremestruktur [6]. Die Ausbildung geordneter Systeme nach Phasenumkehr wird durch Überschreiten der Phaseninversionstemperatur erleichtert, was jedenfalls für Erwärmen spricht. Letzten Endes bleibt aber der Zweifel, welches therapeutische Ziel mit der Mischung verfolgt wird. Nachdem die O/W-Creme Linola® durch Zugabe von Linola® Fett N „aufgefettet“ wurde, liegt der Fettgehalt bei etwa 40%. Das ist eher typisch für lipophile Cremes. War also wirklich eine O/W-Creme erwünscht oder doch eine W/O-Creme [10]? Es ist sicher sinnvoll, das Ziel des Arztes zu erfragen, um eine geeignetere Grundlage vorzuschlagen.
Informationen zu industriell hergestellten Produkten in der Rezeptur
Der Leitfaden „Plausibilitäts-Check Rezeptur“ beinhaltet eine umfangreiche Tabelle von Handelspräparaten und deren Bestandteile und Emulsionstypen [11]. Online helfen Rezeptur-Datenbanken, wie der „Rezepturenfinder“ des DAC/NRF (www.dac-nrf.de). Er enthält eine wachsende Sammlung häufig angefragter Rezepturen mit Beurteilung durch die Experten des DAC/NRF. Zu Handelspräparaten, die zu Rezepturzwecken auf den Markt gebracht wurden, findet man die benötigten Informationen auf den Internetseiten der Hersteller. Die dort zur Verfügung gestellten Unterlagen weisen die arzneimittelrechtliche Qualität der Grundlagen nach und helfen, Inkompatibilitäten zu erkennen und zu vermeiden. Sind auf einer Packung Kosmetik-Inhaltsstoffe nach dem INCI-System deklariert, finden sich hier häufig auch die pharmazeutischen Bezeichnungen. Die Unternehmen informieren zudem über Rezepturformeln, deren Stabilität experimentell gesichert ist. Zuletzt noch ein Tipp zur korrekten Kennzeichnung: Grundlagen ohne Fertigarzneimittelzulassung müssen nach ApBetrO mit allen Bestandteilen deklariert werden. Das vereinfachen Druckvorlagen für Aufkleber, die manche Firmen zum Download bereithalten.
Mischen ist möglich, aber mit Vorsicht!
Wenn man Fertigarzneimittel oder industriell gefertigte Arzneiträger verarbeitet, drohen wegen der Vielzahl der Bestandteile zahlreiche galenische Wechselwirkungen. Die Gesellschaft für Dermopharmazie rät daher eindeutig: „Rezepturen auf der Basis von Fertigarzneimitteln oder vorgefertigt bezogenen Grundlagen sollen nur dann verschrieben werden, wenn seitens des Herstellers experimentell gesicherte Daten zur physikalischen, chemischen und mikrobiologischen Qualität und Haltbarkeit über einen für die vorgesehene Behandlung angemessenen Zeitraum vorgelegt werden können“ [1]. Liegen keine Daten vor, sind Fertigarzneimittel mit einfach zusammengesetzten, offizinellen Grundlagen zu verdünnen, damit die möglichen Wechselwirkungen überschaubar bleiben. Zudem empfiehlt sich bei der Plausibilitätskontrolle, außer der üblichen Literatur die aktuellen Herstellerinformationen heranzuziehen. Die Plausibilität von Mischungen, deren Stabilität nicht belegt ist, sollte erst einmal zurückhaltend beurteilt werden. |
Literatur
[1] Dermatologische Rezepturen – Leitlinie GD Gesellschaft für Dermopharmazie e.V., www.gd-online.de, Stand: 21. März 2013
[2] Deutsches Arzneibuch 10 (DAB 10). Deutscher Apotheker Verlag, Stuttgart 1991
[3] Fahr A, Voigt R. Pharmazeutische Technologie. 12. Auflage, Deutscher Apotheker Verlag, Stuttgart 2015
[4] Informationsportal für Fachkreise. www.ichthyol.de, aufgerufen 11. März 2016
[5] PZ-Expertenrat, Spezial: Apothekenbetriebsordnung, Rezeptur und Defektur, Pharmazeutische Zeitung online, www.pharmazeutische-zeitung.de, aufgerufen 11. März 2016
[6] Rezepturbroschüre. www.wolff-arzneimittel.de (Bereich Fachkreise), Stand 1/2015, und Auskunft des Rezepturservice per E-Mail vom 24. März 2016
[7] Rezepturhinweis: Transparenz von Dermatikagrundlagen, Pharmazeutisches Laboratorium des NRF (Hrsg.), www.dac-nrf.de, Stand: 8. Dezember 2015
[8] Rezepturhinweis: Tenside - Netzmittel, Emulgatoren und Solubilisatoren, Pharmazeutisches Laboratorium des NRF (Hrsg.), www.dac-nrf.de, Stand: 8. Dezember 2015
[9] Rezepturhilfe für unsere Topisolon®-Salbe, www.sanofi-aventis.de, aufgerufen 11. März 2016
[10] Wolf G. Rezepturen - Probleme erkennen, lösen und vermeiden, 4. Auflage. Deutscher Apotheker Verlag, Stuttgart 2012
[11] Ziegler AS. Plausibilitäts-Check Rezeptur, 3. Auflage. Deutscher Apotheker Verlag, Stuttgart 2015
[12] Caelo Rezepturforum, www.rezepturforum.de, aufgerufen 13. April 2016
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.