
- DAZ.online
- DAZ / AZ
- DAZ 49/2015
- Toxische Wirkungen der ...
Arzneimittel und Therapie
Toxische Wirkungen der Fluorchinolone
Wie alarmierend sind die neuen epidemiologischen Daten?
Am häufigsten sind demnach gastrointestinale Störungen, wie bei anderen antibiotisch wirksamen Substanzen auch. Wirkungen auf das Zentralnervensystem treten ebenfalls nicht selten auf. Dieses neurotoxische Potenzial kann sich in Form von Krampfanfällen und akuten psychotischen Reaktionen manifestieren. Neurotoxische Effekte werden sicherlich häufig übersehen, wenn sie leichter ausgeprägt sind und als Symptome der vorliegenden akuten Infektion angesehen werden. Hier ist eine besondere Wachsamkeit erforderlich. Offenbar können sich die neurotoxischen Wirkungen nicht nur im Zentralnervensystem manifestieren. Seit einigen Monaten mehren sich die Hinweise, dass in seltenen Fällen auch periphere Neuropathien auftreten können.
Diverse toxische Wirkungen betrafen offenbar nur einzelne Derivate aus dieser Arzneimittelgruppe und lassen sich nicht für alle Derivate verallgemeinern. Sehr gut bekannt sind beispielsweise die Strukturwirkungsbeziehungen hinsichtlich der Phototoxizität. Einige Chinolone, wie etwa Sparfloxacin oder Fleroxacin, die heute nicht mehr im Handel sind, waren in dieser Hinsicht sehr problematisch. Unter den drei heute häufig angewandten Chinolonen besitzt Ciprofloxacin ein geringes phototoxisches Potenzial, während die Phototoxizität bei Levofloxacin und Moxifloxacin keine wesentliche Rolle spielt. Die anderen drei Chinolone Norfloxacin, Ofloxacin und Enoxacin besitzen eine ungünstigere Nutzen-Risiko-Relation und haben spezielle Nachteile, so dass ihre Verwendung heute nicht mehr empfehlenswert ist.
Schwieriger zu beurteilen sind selten auftretende, aber schwerwiegende unerwünschte Wirkungen der Chinolone. Wie bei keiner anderen Arzneimittelgruppe sind im Laufe von drei Jahrzehnten einzelne Wirkstoffe bekannt geworden, die spezielle toxische Risiken aufweisen, welche erst nach der Zulassung erkannt wurden und zur Rücknahme der Präparate führten. Hämolytische Anämien nach Temafloxacin, kardiovaskuläre Effekte durch Sparfloxacin und Grepafloxacin, und hepatotoxische Wirkungen von Trovafloxacin sind nur einige Beispiele. Es ist daher naheliegend, dass weiter nach bisher unerkannten toxischen Wirkungen dieser Medikamente gesucht wird. Es ist durchaus möglich, dass seltene, aber schwerwiegende unerwünschte Wirkungen von Arzneimitteln erst Jahrzehnte nach ihrer Markteinführung erkannt werden. Die Fluorchinolone haben in den vergangenen Jahrzehnten häufiger unter einem entsprechenden Verdacht gestanden: Manche der proklamierten Nebenwirkungen konnten bestätigt werden, andere erwiesen sich nach weiteren Untersuchungen als unbegründet. Aktuell sind mögliche Effekte auf die Netzhaut (Retina) und auf die Aorta in der Diskussion.
Wirkstoff (Handelsname in D) |
Anzahl der Fälle
(EBGM)
|
Lebensalter(Jahre) |
Gleichzeitige Glucocorticoid-Therapie |
|---|---|---|---|
Levofloxacin (Tavanic®)
|
1555 (55,2) |
60,0 |
27,1 |
Ciprofloxacin (Ciprobay®)
|
606 (20) |
54,5 |
10,4 |
Moxifloxacin (Avalox®)
|
230 (13,3) |
54,0 |
14,7 |
Ofloxacin (Tarivid®)
|
70 (8,6) |
66,7 |
5,3 |
Norfloxacin (Barazan®)
|
30 (9,6) |
57,7 |
2,4 |
* zu Enoxacin (Enoxor®) keine Angaben, da in USA nicht im Handel | |||
Netzhautablösung durch Chinolone?
Vor etwa drei Jahren veröffentlichten kanadische Autoren eine epidemiologische Studie über Patienten, die innerhalb eines Zeitraums von acht Jahren einen Augenarzt aufgesucht hatten. Sie fanden ein signifikant erhöhtes Risiko für Netzhautablösungen bei Patienten, die mit Ciprofloxacin, Levofloxacin oder anderen Chinolonen behandelt worden waren. Bei der vergleichend vorgenommenen Auswertung von Patienten, die ein ß-Laktamantibiotikum erhalten hatten, ließ sich dagegen kein erhöhtes Risiko berechnen. Da es sich um eine schwerwiegende, wenn auch seltene, unerwünschte Wirkung handelt, gab diese Publikation den Anstoß für weitere epidemiologische Studien. Unklar war vor allem, ob die Assoziation zwischen einer Chinolon-Therapie und einer Netzhautablösung auch bei Patienten gefunden werden kann, bei denen keine Augenerkrankung besteht.
Zunächst wurde 2014 aus Dänemark darüber berichtet, dass eine signifikante Assoziation zwischen einer Chinolon-Therapie und einer Netzhautablösung nicht besteht, wenn die Analyse von der Allgemeinbevölkerung ausgeht und nicht nur Patienten berücksichtigt, die sich in augenärztlicher Behandlung befinden. Bemerkenswert ist eine weitere Studie aus dem Jahr 2014. Daten von US-amerikanischen Patienten wurden ausgewertet, um die Studie aus Kanada mit dem gleichen methodischen Ansatz zu wiederholen und gegebenenfalls die Ergebnisse zu bestätigen. Zusätzlich wurden weitere Datenanalysen von insgesamt etwa 125 Millionen Patienten vorgenommen. Im Gegensatz zu der Mitteilung aus Kanada konnte kein ähnlich hohes Risiko ermittelt werden. Der zuvor beschriebene Unterschied hinsichtlich des Risikos einer Netzhautablösung bei den Patienten, die mit Chinolonen und jenen, die mit ß-Laktamantibiotika behandelt worden waren, war nicht erkennbar.
Im asiatischen Raum wurde ebenfalls eine Studie durchgeführt. Auch hier konnten die kanadischen Daten nicht bestätigt werden. Die Autoren weisen darauf hin, dass die Daten von Chinesen stammen und eventuell ethnische Unterschiede bestehen könnten. Von der gleichen Arbeitsgruppe wurde eine Metaanalyse veröffentlicht, in der alle bisherigen Arbeiten zusammenfassend ausgewertet wurden. Auch in dieser Arbeit wurde keine signifikante Assoziation festgestellt. Insgesamt kann man wohl davon ausgehen, dass der ursprünglich postulierte Zusammenhang zwischen einer Chinolon-Behandlung und Retinaschäden nicht existiert und es sich eher um eine zufällige Häufung solcher Fälle handelt.
Über 20 Kollagen-Typen
Über 20 Varianten sind bislang bekannt. Tab. 2 listet einige Beispiele auf.
- Primärstruktur: Polypeptidketten mit repetitiven Gly-X-Y-Sequenzen
- Sekundärstruktur: linksgängige Kollagen-Helix (α-Ketten)
- Tertiärstruktur: rechtsgängige Tripelhelix aus 3 Polypeptidketten (Tropokollagen Ø 1,5 nm)
- Quartärstruktur: Mikrofibrillen Ø 20-40 mm, Fibrillen Ø 300-500 nm, Fasern Ø 4-12 µm
Typ |
Vorkommen |
Struktur |
|---|---|---|
I |
Haut, Sehnen, Knochen, Cornea |
300 nm, 67 nm Fibrillen |
II |
Knorpel, Bandscheiben |
300 nm, kleine 67-nm-Fibrillen |
III |
Herz-Kreislauf-System, Reticulinfasern, fetale Haut |
300 nm, kleine 67-nm-Fibrillen |
IV |
Basallamina |
390 nm, C-terminale globuläre Domäne, nichtfibrillär |
V |
Intestinale Gewebe, mit Typ I assoziiert |
390 nm, N-terminale globuläre Domäne, kleine Fibrillen |
VI |
Intestinale Gewebe, mit Typ I assoziiert |
150 nm, N-+C-terminale globuläre
Domäne, Mikrofibrillen, 100 nm
gebänderte Fibrillen
|
VII |
Epithelien |
450 nm, Dimer |
Chinolone und Aortendissektion?
Epidemiologen aus Taiwan beschrieben im Oktober 2015 erstmals eine Assoziation zwischen der Einnahme eines Chinolons und dem Auftreten eines Aorten-Aneurysmas oder einer Aortendissektion [1]. Wie bei jeder epidemiologischen Untersuchung kann nur eine Assoziation, aber kein Kausalzusammenhang ermittelt werden, weil es vielfältige Störmöglichkeiten gibt. Die Autoren der Arbeit diskutieren zum Beispiel die Möglichkeit, dass die morphologischen Veränderungen der Aorta auch Zufallsbefunde sein könnten. Wenn bei einem Patienten mit einer akuten Infektion der Atemwege vor der Verschreibung eines Antibiotikums eine CT-Untersuchung durchgeführt wurde, könnten Aortenaneurysmen entdeckt worden sein. Die Resultate weiterer Studien müssen daher abgewartet werden, bevor diese schwerwiegenden Gefäßveränderungen auf die Liste der unerwünschten Chinolon-Wirkungen aufgenommen werden können.
Epidemiologisch ermittelte Assoziationen sind immer dann von besonderem Interesse, wenn sie biologisch plausibel sind, wenn zum Beispiel die mögliche Nebenwirkung eines Arzneimittels durch einen bestimmten Mechanismus erklärt werden kann, der einen Kausalzusammenhang wahrscheinlich macht.
Die aktuell beschriebenen Veränderungen der Aorta werden in einen Zusammenhang gestellt mit Wirkungen der Chinolone auf Bindegewebsstrukturen, zum Beispiel Sehnen, die eindeutig durch Chinolone verursacht werden können und bei denen kein Zweifel an einem Kausalzusammenhang besteht (siehe auch Tab. 1). Ausgangspunkt der Überlegungen ist der Kollagen-Anteil der Aorta. Da Sehnen einen extrem hohen Gehalt an Kollagen I aufweisen und Tendopathien durch Chinolone verursacht werden können, wird auch das Kollagen in der Aortenwand als mögliches Target postuliert. Diese Überlegungen sind allerdings sehr oberflächlich und berücksichtigen zum Beispiel nicht die unterschiedlichen Kollagen-Arten, die in verschiedenen Geweben nachgewiesen werden können (Tab. 2).Kollagen I kommt in der Haut, Sehnen, Faszien, inneren Organen und anderen Strukturen vor, Kollagen II ist charakteristisch für Knorpelgewebe. Das Kollagen Typ III ist wichtiger Bestandteil der Gefäßwände, aber neben Kollagen I auch in der Haut und inneren Organen nachweisbar.
Ähnliche, eher unpräzise Argumentationen wurden in den letzten Jahren vorgebracht, um die Assoziationen zwischen den Retinopathien und einer Chinolontherapie zu erklären. Sicherlich trifft es zu, dass Auge und Aorta – wie praktisch alle Organe im menschlichen Körper – Kollagen enthalten. Im Unterschied zu Sehne oder Knorpel werden andere Organe aber besser mit Blut und Nährstoffen versorgt. Während Knorpel und Sehne bradytrophe, nicht vaskularisierte Gewebe sind, erhalten die Kollagen-Schichten in anderen Organen rascher und unmittelbarer Nährstoffe aus dem Blut. Dies ist wahrscheinlich pathogenetisch von Bedeutung.
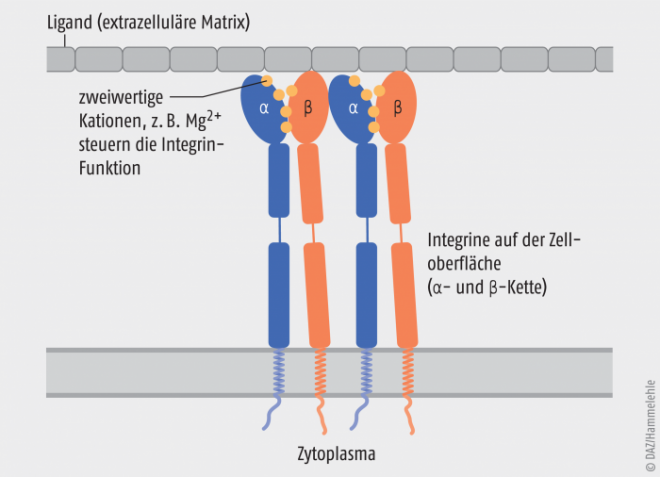
Integrine stellen den Kontakt zwischen einer Zelle und Kollagen sowie anderen Komponenten der extrazellulären Matrix her. Sie werden durch divalente Kationen, wie Magnesium, reguliert. Da alle Chinolone mit Magnesium Chelatkomplexe bilden, ist eine Störung der Integrinfunktionen möglich. In gut durchbluteten Geweben kann der Mangel an funktionell verfügbarem Magnesium offenbar rasch wieder ausgeglichen werden. Die bei Chinolon-Therapie beobachteten Sehnenschäden sind aber – zumindest teilweise – durch diese Vorgänge zu erklären, denn im nicht vaskularisierten Gewebe kann der Mangel nicht rasch ausgeglichen werden, und wenn weitere ungünstige Faktoren hinzukommen, ist ein Sehnenschaden möglich.
Wahrscheinlich schädigen die Chinolone Knorpel und Sehne, weil sie mit Magnesium Chelate bilden und der Mangel an funktionell verfügbarem Magnesium nicht rasch ausgeglichen werden kann (siehe Abbildung) [2]. Nur in jenen Organen, die nicht vaskularisiert sind, führt dies wahrscheinlich zu Schäden. Daher ist der Analogieschluss zwischen Sehne, Retina und Aorta nicht so plausibel, wie er auf den ersten Blick erscheint. Es ist daher durchaus fraglich, ob sich die aktuell beschriebenen Veränderungen der Aorta in einer unabhängig durchgeführten Studie bestätigen lassen. Auch in diesem Fall heißt es also, zunächst einmal weitere Studien abzuwarten. |
Quelle
[1] Lee CC, et al. Risk of Aortic Dissection and Aortic Aneurysm in Patients Taking Oral Fluoroquinolone. JAMA Intern Med. 2015 Nov 1;175(11):1839-47
[2] Douros A, Grabowski K, Stahlmann R. Safety issues and drug-drug interactions with commonly used quinolones. Expert Opin Drug Metab Toxicol. 2015;11:25-39





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.