
- DAZ.online
- DAZ / AZ
- DAZ 47/2015
- Panobinostat ergänzt ...
Arzneimittel und Therapie
Panobinostat ergänzt Therapie bei multiplem Myelom
Erster Histon-Deacetylase-Inhibitor wird zusammen mit Bortezomib und Dexamethason eingesetzt
Das multiple Myelom ist eine maligne Erkrankung, die durch eine monoklonale Vermehrung von Plasmazellen im Knochenmark charakterisiert ist. Die Erkrankung wird den hämatologischen Neoplasien zugeordnet und tritt überwiegend bei älteren Patienten auf. In Deutschland werden jährlich knapp 6000 Neuerkrankungen diagnostiziert, die Fünf-Jahres-Überlebensrate nach Erstdiagnose liegt bei etwa 47%. Das multiple Myelom ist mit konventionellen Therapieverfahren nicht heilbar. Eine Behandlung richtet sich nach Symptomatik, Rezidivlage, Alter und Komorbidität des Patienten. Neben einer Hochdosis-Chemotherapie mit nachfolgender Blutstammzell-Transplantation, die nicht für alle Patienten infrage kommt, werden unter anderem klassische Zytostatika wie Melphalan und Cyclophosphamid jeweils in Kombination mit Prednison, bei älteren Patienten Kombinationen mit immunmodulierenden Wirkstoffen wie Thalidomid oder Lenalidomid (zusammen mit weiteren Wirkstoffen) eingesetzt. Da die meisten Patienten ein Rezidiv erleiden, wird nach neuen therapeutischen Möglichkeiten gesucht. Zu diesen zählen etwa Immunmodulatoren der dritten Generation (Pomalidomid), Antikörper (Elotuzumab; noch nicht zugelassen), neue Proteasom-Inhibitoren (Carfilozomib; Zulassungsantrag gestellt) und Inhibitoren der Histon-Deacetylase wie Panobinostat. Dieser ist in Kombination mit Bortezomib und Dexamethason indiziert für die Behandlung Erwachsener mit rezidiviertem und/oder refraktärem multiplem Myelom, die mindestens zwei Therapien, darunter Bortezomib und eine immunmodulatorische Substanz, erhalten haben.
Epigenetische Aktivität
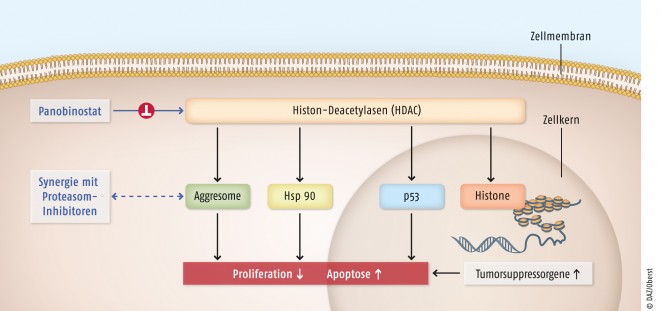
Panobinostat reduziert auf verschiedenen Wegen die Zellproliferation und steigert die Apoptoserate (siehe Abbildung). Als pan-Histon-Deacety-lase(HDAC)-Inhibitor hemmt Panobinostat verschiedene Histondeacetylasen, was sowohl die Modifikation von Histonen als auch von Nicht-Histon-Proteinen nach sich zieht. Über Histon-vermittelte Effekte verstärkt der Wirkstoff die Expression von Tumorsuppressorgenen. Darüber hinaus werden unter anderem Nicht-Histon-Proteine wie Hsp90 und P53 vermehrt acetyliert. Panobinostat blockiert ferner den Aggresom-vermittelten Proteinabbau, der über HDAC6 vermittelt wird. Bei diesem Vorgang lagern sich funktionsuntüchtige Proteine zusammen, um anschließend mithilfe von Autophagosomen und Phagolysosomen abgebaut zu werden. Bei der Hemmung dieses Abbaus wirkt Panobinostat synergistisch mit Bortezomib, das den Abbauweg über die proteasomale Protein-Degradierung blockiert. Zusätzlich scheinen Zellen unter dem Einfluss von HDAC-Inhibitoren sensitiver auf TNF-α-vermittelte Apoptose-Signale zu reagieren.
Progressionsfreies Überleben verlängert
Grundlage der EU-Zulassung für Panobinostat waren die Ergebnisse einer präspezifizierten Subgruppenanalyse der randomisierten, doppelblinden, multizentrischen und Placebo-kontrollierten Phase-III-Studie PANORAMA-1 (PANobinostat ORAl in Multiple MyelomA). Dabei wurden Wirksamkeit und Sicherheit von Panobinostat bei der Behandlung des rezidivierten oder rezidivierten und refraktären Multiplen Myeloms untersucht. Die 768 Studienteilnehmer erhielten entweder eine Dreier-Kombination aus Panobinostat, Bortezomib und Dexamethason oder eine Kombination aus Bortezomib und Dexamethason und Placebo. 147 der Patienten hatten mindestens zwei Vortherapien einschließlich Bortezomib und einem immunmodulatorischen Wirkstoff (Lenalidomid oder Thalidomid) erhalten. In dieser Subgruppe verlängerte sich das mediane progressionsfreie Überleben unter der Panobinostat-Kombination im Vergleich zur Bortezomib-Dexamethason-Gruppe um 7,8 Monate (12,5 Monate vs. 4,7 Monate; Hazard Ratio 0,47). Auch die Ansprechrate und die Rate kompletter oder nahezu kompletter Remissionen waren unter der Panobinostat-haltigen Therapie höher als im Vergleichsarm (59% vs. 39% bzw. 22% vs. 8%). Zum Gesamtüberleben liegen derzeit nur Zwischenergebnisse vor, die finale Auswertung steht noch aus.
Panobinostat ist der erste Vertreter der pan-HDAC-Inhibitoren, einer Wirkstoffgruppe, die alle Histon-Deacetylase-Klassen hemmt. Histon-Deacetylasen sind Gegenspieler der Histon-Acetyltransferasen. Werden die Acetyltransferasen ausgeschaltet, kommt es zu einer verstärkten Acetylierung unter anderem von Nicht-Histonproteinen wie Hsp 90 und p53. Zudem wird der Aggresom-vermittelte Proteinabbau gehemmt. Auch greifen HDAC-Inhibitoren direkt in die epigenetische Zellprogrammierung ein. Diese ist beim multiplen Myelom durch Einschränkung der Tumorsuppressorgen-Expression gestört. Panobinostat soll zu einer Aktivierung dieser Expression führen. Letztlich wird durch Panobinostat die Zellproliferation reduziert und die Apoptose gesteigert. Beim multiplen Myelom wird die synergistische Wirkung von Proteasom-Inhibitoren wie Bortezomib (Velcade®) und Histon-Deacetylase-Inhibitoren genutzt.
Unerwünschte Wirkungen
Die häufigsten nicht-hämatologischen unerwünschten Ereignisse (häufig und sehr häufig) betrafen Infektionen, endokrine Erkrankungen (Hypothyreose), Stoffwechsel- und Ernährungsstörungen mit Gewichtsverlust, Schlaflosigkeit, Erkrankungen des Nervensystems (u. a. Schwindel, Kopfschmerzen), Bindehautblutungen, Herzerkrankungen, Hypotonie, Husten, Dyspnö, respiratorische Insuffizienz, Erkrankungen des Gastrointestinaltraktes (Diarrhö, Übelkeit, Erbrechen, Blutungen, abdominale Schmerzen), Störungen der Leberfunktion, Hautveränderungen, Schwellung der Gelenke, nephrologische Beschwerden (Nierenversagen, Inkontinenz) und Fatigue. Zu den sehr häufig auftretenden hämatologischen Toxizitäten zählen Panzytopenie, Thrombozytopenie, Anämie, Neutropenie, Leukopenie und Lymphopenie.
Aufgrund möglicher schwerer Nebenwirkungen sieht die Fachinformation besondere Vorsichtsmaßnahmen für die Anwendung vor. Diese betreffen unter anderem die Überwachung hämatologischer Parameter, das Achten auf Anzeichnen einer Infektion und die Überprüfung kardialer Funktionen, da Panobinostat das QT-Intervall verlängern kann.
Wechselwirkungen und Interaktionen
Die Metabolisierung von Panobinostat erfolgt sowohl ohne als auch mit Beteiligung von CYP-Enzymen. Panobinostat ist ein P-gp-Substrat. Ungefähr 40% von Panobinostat werden durch CYP3A4 metabolisiert. Daher können Arzneimittel, die die Aktivität des CYP3A4-Enzyms beeinflussen, die Pharmakokinetik von Panobinostat verändern. Starke CYP3A4-Induktoren können die Wirksamkeit von Panobinostat verringern. Daher sollte eine gleichzeitige Anwendung von starken CYP3A4-Induktoren wie etwa Carbamazepin, Phenobarbital, Phenytoin, Rifabutin, Rifampicin und Johanniskraut vermieden werden. Die gleichzeitige Anwendung von Panobinostat mit starken CYP3A4-Hemmern wie Ketoconazol, Itraconazol, Voriconazol, Ritonavir, Saquinavir, Telithromycin, Posaconazol und Nefazodon erfordert eine Dosisanpassung von Panobinostat.
Aufgrund einer möglichen QT-Zeit-Verlängerung unter Panobinostat wird die gleichzeitige Anwendung von Antiarrhythmika und anderen Wirkstoffen, die das QT-Zeit-Intervall verlängern, nicht empfohlen.
Komplexes Dosierungsschema
Panobinostat wird in Kombination mit Bortezomib und Dexamethason angewendet. Die empfohlene Anfangsdosis von Panobinostat beträgt 20 mg oral einmal täglich an den Tagen 1, 3, 5, 8, 10 und 12 eines 21-tägigen Zyklus (siehe Tabelle). Die Patienten sollten zunächst acht Zyklen lang behandelt werden. Liegt ein klinischer Nutzen vor, wird die Behandlung weitere acht Zyklen lang fortgesetzt. Die Gesamtdauer der Behandlung beträgt bis zu 16 Zyklen (48 Wochen). Die Kapseln sollen unabhängig von den Mahlzeiten mit Wasser geschluckt werden und dürfen weder geöffnet, zerdrückt oder gekaut werden. Der Verzehr von Sternfrüchten, Grapefruit, Grapefruitsaft, Granatäpfeln und Granatapfelsaft ist zu meiden, da diese als CYP3A-Hemmer die Bioverfügbarkeit von Panobinostat erhöhen können.
|
Zyklen 1 bis 8
(dreiwöchige Zyklen)
|
Woche 1
Tage
|
Woche 2
Tage
|
Woche 3 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Panobinostat |
1 |
3 |
5 |
8 |
10 |
12 |
Ruhephase |
||||||||
Bortezomib |
1 |
4 |
8 |
11 |
Ruhephase |
||||||||||
Dexamethason |
1 |
2 |
4 |
5 |
8 |
9 |
11 |
12 |
Ruhephase |
||||||
|
Zyklen 9 bis 16
(dreiwöchige Zyklen)
|
Woche 1
Tage
|
Woche 2
Tage
|
Woche 3 |
||||||||||||
Panobinostat |
1 |
3 |
5 |
8 |
10 |
12 |
Ruhephase |
||||||||
Bortezomib |
1 |
8 |
Ruhephase |
||||||||||||
Dexamethason |
1 |
2 |
8 |
9 |
Ruhephase |
||||||||||
Beim Auslassen einer Dosis kann diese bis zu zwölf Stunden nach dem ursprünglich vorgesehenen Zeitpunkt eingenommen werden. Sollte sich der Patient erbrechen, ist keine zusätzliche Dosis einzunehmen, sondern erst wieder zum nächsten vorgesehenen Zeitpunkt.
Patienten und Angehörige sollten auf mögliche unerwünschte Wirkungen hingewiesen werden, so z. B. dass unter einer Therapie mit Panobinostat schwere gastrointestinale Beschwerden auftreten können. Beim ersten Anzeichen abdominaler Krämpfe, dünnem Stuhl oder dem Einsetzen von Durchfällen sollte der Patient ein Antidiarrhoikum (z. B. Loperamid) erhalten.
Beim Vorliegen einer Thrombozytopenie oder Neutropenie sowie bei gastrointestinalen oder hepatischen Störungen führt die Fachinformation detaillierte Dosisanpassungen auf. |
Quelle
Fachinformation Farydak®, Stand August 2015
Einsele H et al. Subgroup analysis by prior treatment among patients with relapsed or relapsed and refractory multiple myeloma in the panorama 1 study of panobinostat or placebo plus bortezomib and dexamethasone. EHA 2015, Abstract 3303 und Oral Presentation, www.myelomabeacon.com
San-Miguel JF et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: a multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014;15:1195-1206
Maes K et al. Epigenetic modulating agents as a new therapeutic approach in multiple myeloma. Cancers 2013;5:430-461
Goldschmidt H et al. Strategien beim rezidivierten/refraktären multiplen Myelom. Der Onkologe 2014;20:250-256
Leitlinie multiples Myelom. Empfehlungen der Fachgesellschaft zur Diagnostik und Therapie hämatologischer und onkologischer Erkrankungen. Stand: September 2013, www.onkopedia.com





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.