
- DAZ.online
- DAZ / AZ
- DAZ 46/2015
- Isotonisierung
Isotonisierung
Wie sich Hilfsstoffmengen berechnen lassen
Der Begriff Osmose (griech. osmos = Eindringen) bezeichnet die einseitige Diffusion von Lösungsmittelmolekülen durch eine semipermeable Membran, die zwei unterschiedlich stark konzentrierte Lösungen voneinander trennt. Semipermeabel bedeutet in diesem Fall, dass die Membran nur für die Moleküle des Lösungsmittels, nicht aber für die gelösten Stoffe selbst durchlässig ist. Bei der Osmose fließt das Lösungsmittel so lange in Richtung der höheren Konzentration an gelöster Substanz, bis ein Konzentrationsausgleich erreicht ist. Es kommt also zu einem Nettovolumentransport, der eine Volumenänderung auf beiden Seiten der Membran bewirkt. Wird der Volumenänderung auf der Seite der höheren Konzentration an gelöster Substanz nun durch starre Gefäßwände ein mechanischer Widerstand gesetzt, dann baut sich in dieser Lösung ein Druck auf, der als osmotischer Druck bezeichnet wird.
Treibende Kraft der Osmose
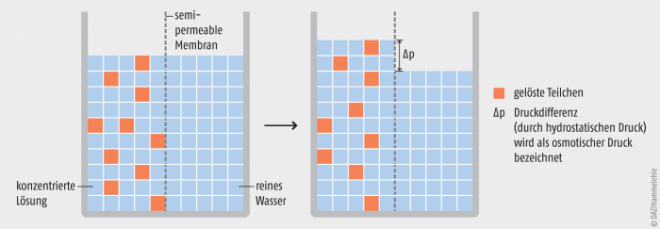
Aus der Betrachtung von Diffusionsvorgängen und deren Beschreibung durch das Fick‘sche Gesetz ist bekannt, dass die treibende Kraft der Diffusion ein Konzentrationsgradient ist. Betrachtet man ganz generell die Diffusion von Molekülen einer bestimmten Art, so diffundieren diese von einem Bereich hoher Konzentration zu einem Bereich niedriger Konzentration, bis ein Konzentrationsausgleich erreicht ist. Bei der Osmose ist das genauso, nur dass hier eben nicht Moleküle der gelösten Substanz diffundieren, sondern die Moleküle des Lösungsmittels. Das bedeutet allerdings im Umkehrschluss, dass es einen Konzentrationsgradienten für das Lösungsmittel, meist Wasser, geben muss. Der Konzentrationsgradient des Wassers ist in Wirklichkeit vielmehr ein Potenzialgefälle. In einer Lösung ist das Wasserpotenzial zur chemischen Aktivität des Wassers in dieser Lösung proportional. Die Aktivität selbst ist wiederum umgekehrt proportional zur Summe der im definierten Wasservolumen gelösten osmotisch aktiven Teilchen. Einfacher ausgedrückt: Je mehr osmotisch aktive Teilchen in der wässrigen Lösung vorhanden sind, desto geringer ist die Konzentration der Wassermoleküle in dieser Lösung, und das Wasserpotenzial dieser Lösung nimmt ab [1]. Siehe hierzu auch Abbildung 1.
Abb. 1: Treibende Kraft der Osmose Eine konzentrierte wässrige Lösung mit einem Volumen von insgesamt 50 Volumenelementen (VE) bestehend aus 40 VE Wasser und 10 VE gelösten Teilchen ist durch eine semipermeable Membran von Wasser mit einem Volumen von insgesamt 50 Volumenelementen getrennt (Bild a). Die Membran ist nur für die Lösungsmittelmoleküle, nicht aber für die gelösten Teilchen durchlässig. Es ergibt sich ein Konzentrationsgradient für Wasser von 50 VE rechts von der Membran zu 40 VE links von der Membran. Die Wassermoleküle folgen ihrem Konzentrationsgradienten und diffundieren durch die Membran bis zum Konzentrationsausgleich (Bild b). Das Gesamtvolumen hat sich auf der Seite der konzentrierten Lösung auf insgesamt 55 VE erhöht. Hierbei sind immer noch 10 VE gelöste Teilchen und nun 45 VE Wasser. Auf der rechten Seite der Membran ist das Volumen auf 45 VE Wasser gesunken. Auf beiden Seiten der Membran sind nun 45 VE Wasser. Durch die Höhendifferenz der Flüssigkeitsspiegel kommt es durch den hydrostatischen Druck zum Aufbau einer Druckdifferenz. Diese Druckdifferenz wird bei diesem Versuchsaufbau auch als osmotischer Druck bezeichnet.
Physiologischer Kontext
Osmose und osmotischer Druck spielen eine zentrale Rolle in der Regulation des Volumen- und Wasserhaushaltes von pflanzlichen und tierischen Zellen. Jede Zelle unterliegt einem bestimmten osmotischen Druck, da die Zellmembran im Allgemeinen für Wasser permeabel ist, einzelne gelöst vorliegende Stoffe hingegen keine (oder eventuell nur eine sehr geringe) Membranpermeabilität aufweisen. Der osmotische Druck hängt nur von der Anzahl, das heißt von der Konzentration der gelösten Teilchen ab, nicht aber von der Art der Teilchen. Er gehört damit zu den sogenannten kolligativen Eigenschaften, zu denen auch die Dampfdruckerhöhung, die Siedepunkterniedrigung und die Gefrierpunktserniedrigung gehören. Der osmotische Druck des Blutplasmas oder der Tränenflüssigkeit entspricht dem einer 0,9%igen Natriumchlorid-Lösung. Im physiologischen und pharmazeutischen Kontext werden Zubereitungen in Abhängigkeit ihres osmotischen Drucks in der Regel in drei Bereiche eingeteilt:
- isoton: Die Zubereitung hat den gleichen osmotischen Druck wie das Vergleichsmedium, hier zum Beispiel das Blut oder die Tränenflüssigkeit.
- hyperton: Die Zubereitung hat einen höheren osmotischen Druck als das Vergleichsmedium.
- hypoton: Die Zubereitung hat einen niedrigeren osmotischen Druck als das Vergleichsmedium.
Das bekannteste physiologische Beispiel ist wahrscheinlich die Beschreibung des Verhaltens der Erythrozyten in Abhängigkeit vom osmotischen Druck des Umgebungsmediums. Normalerweise befinden sich die Erythrozyten in einer isotonischen Umgebung, dem Blutplasma. Wird diese durch große Mengen einer hypertonen Lösung verdünnt, dann kommt es zum Nettotransport von Wasser aus den Erythrozyten in die umgebende Lösung. Den Erythrozyten wird Wasser entzogen und sie schrumpfen. Wird im Gegensatz dazu mit einer hypotonen Lösung verdünnt, dann wird das Wasser solange in die Erythrozyten gezogen, bis diese platzen. Hieran wird deutlich, wie wichtig die Einstellung der Tonizität von pharmazeutischen Formulierungen sein kann, die parenteral, an Auge, Nase oder Ohr verabreicht werden.
Osmolalität
Um den Gesamtbeitrag verschiedener gelöster Stoffe auf den osmotischen Druck in einer Lösung anzugeben, hat sich als praktische Größe die Berechnung der Osmolalität etabliert. Nach dem europäischen Arzneibuch kann die Osmolalität ξm nach der folgenden Formel berechnet werden [2]:
Hierbei steht b für die Molalität der gelösten Substanz, ν für die Gesamtzahl der vorhandenen oder durch Solvolyse aus einem Molekül des gelösten Stoffs gebildeten Ionen und ϕ für den molalen osmotischen Koeffizienten. Letzterer berücksichtigt die Wechselwirkungen zwischen Ionen entgegengesetzter Ladung in Lösung und ist abhängig von der Molalität der Lösung. Werte der Osmolalität werden meist in der Einheit Milliosmol je Kilogramm (mosmol × kg−1) angegeben. Eine 0,9%ige Natriumchlorid-Lösung hat eine reale Osmolalität von ungefähr 285 mosmol/kg. Die lokale physiologische Verträglichkeit in Abhängigkeit von der Tonizität ist in Tabelle 1 am Beispiel von Augentropfen dargestellt.
Parameter |
ideal |
reizarm |
schmerzfrei |
|---|---|---|---|
pH-Wert |
7,4 |
7,3 bis 9,7 |
5,6 bis 10,5 |
|
Tonizität
(mosmol/kg)
|
285
(0,9% NaCl)
|
222 bis 445
(0,7 bis 1,4% NaCl)
|
127 bis 475
(0,5 bis 1,5% NaCl)
|
sichtbare Partikel |
keine |
keine |
keine |
Gefrierpunktserniedrigung
Die Messung des osmotischen Drucks kann direkt unter Verwendung einer Pfeffer‘schen Zelle oder eines Stoye-Membran-Osmometers erfolgen. Beide Messverfahren sind allerdings recht aufwendig, so dass sich in der Praxis vor allem die indirekte Bestimmung über die Gefrierpunktserniedrigung etabliert hat. Wie erwähnt ist auch die Gefrierpunktserniedrigung eine kolligative Eigenschaft und unterliegt somit den gleichen Gesetzmäßigkeiten wie der osmotische Druck. Die Gefrierpunktserniedrigung ΔTf einer Lösung gegenüber dem reinen Lösungsmittel kann durch die folgende Beziehung beschrieben werden:
Kf ist die kryoskopische Konstante des Lösungsmittels und i der Van‘t Hoff‘sche Koeffizient, der später noch ausführlich erklärt wird. Die Gefrierpunktserniedrigung gibt an, um welche Temperatur in Kelvin sich der Gefrierpunkt (oder auch Schmelzpunkt) einer Lösung gegenüber dem reinen Lösungsmittel verringert, wenn 1 Mol einer nicht flüchtigen Substanz in 1 kg des reinen Lösungsmittels aufgelöst wird. Für Wasser hat die kryoskopische Konstante den Wert von 1,86 K × kg × mol−1.
Praktische Bestimmung der Gefrierpunktserniedrigung
Technisch erfolgt die Messung der Gefrierpunktserniedrigung einer pharmazeutischen Formulierung am besten unter Verwendung eines Gefrierpunkt-Osmometers, auch als Halbmikro-Osmometer bezeichnet. Alternativ kann auch das im DAC beschriebene Beckmann-Thermometer zur Bestimmung eingesetzt werden [2]. Nach der experimentellen Bestimmung der Gefrierpunktserniedrigung der zu untersuchenden Lösung gegenüber dem reinen Lösungsmittel kann die Osmolalität nun relativ einfach aus dem gemessenen Wert und der kryoskopischen Konstante Kf berechnet werden:
Für Routineuntersuchungen ermöglichen die meisten der auf dem Markt erhältlichen Geräte eine direkte Ausgabe der Osmolalität nach erfolgter Messung. Das erspart dem Bediener, selbst die Osmolalität aus der Gefrierpunktserniedrigung zu berechnen. Um diese Funktion nutzen zu können, muss das verwendete Osmometer allerdings zuerst kalibriert werden. In der Regel bieten die Geräte im Benutzermenü hierzu meist zwei Methoden an:
- die 2-Punkt-Kalibrierung mit destilliertem Wasser und einem Kalibrierstandard und
- die 3-Punkt-Kalibrierung mit destilliertem Wasser und zwei Kalibrierstandards.
Die möglichen Kalibrierstandards sind im europäischen Arzneibuch in Methode 2.2.35 detailliert aufgelistet [3]. Es handelt sich hierbei um Natriumchlorid-Lösungen unterschiedlicher Konzentration und somit auch unterschiedlicher Osmolalität und Gefrierpunktserniedrigung. Die Auswahl der Referenzlösungen für die Osmometer-Kalibrierung ist so zu wählen, dass der spätere Messwert der zu untersuchenden Arzneistoffformulierung zwischen zwei Werten der kalibrierten Skala liegt.
Theoretische Berechnung der Gefrierpunktserniedrigung
Durch eine Erweiterung von Gleichung 2 kann für einen bekannten Arzneistoff (oder auch Hilfsstoff) die Gefrierpunktserniedrigung aus der molalen Konzentration berechnet werden:
m ist hierbei die Masse des Arzneistoffs, für den die Gefrierpunktserniedrigung berechnet werden soll, und M seine molare Masse. i steht für den Van’t Hoff’schen Koeffizienten, der die besonderen Eigenschaften von Elektrolyten berücksichtigt. Bei Elektrolyten wird die Anzahl der osmotisch wirksamen Teilchen durch die Anzahl der Ionen bestimmt, in die der Elektrolyt dissoziiert. Je nachdem, ob es sich um einen starken Elektrolyten mit vollständiger Dissoziation oder um einen schwachen Elektrolyten mit unvollständiger Dissoziation handelt, ändert sich die Berechnung des Van’t Hoff’schen Koeffizienten gemäß der folgenden Gleichungen:
- starker Elektrolyt, vollständige Dissoziation (zum Beispiel NaCl): i = z × ϕ
- schwacher Elektrolyt, unvollständige Dissoziation (zum Beispiel Essigsäure): i = 1 + (z - 1) × α
z steht für die Anzahl der Ionen, in die der Elektrolyt dissoziiert, ϕ für den oben schon erwähnten molaren osmotischen Koeffizienten und α für den Dissoziationsgrad. In stark verdünnten Lösungen werden α = 1, ϕ = 1 und somit i = z. Im Gegensatz hierzu ist bei Nicht-Elektrolyten (zum Beispiel Glucose) α = 0, ϕ = 1 und damit i = 1 [4].
Praktisch kann diese Art der Berechnung zur Anwendung bei Elektrolyten aber lediglich zu einer Abschätzung der Gefrierpunktserniedrigung und Osmolalität verwendet werden. Dies liegt daran, dass die konzentrationsabhängigen intermolekularen Wechselwirkungen und der Dissoziationsgrad häufig nicht bekannt sind. Hier empfiehlt sich auf jeden Fall, eine experimentelle Bestimmung der Gefrierpunktserniedrigung mithilfe eines Osmometers durchzuführen. Zur Verdeutlichung zeigt Tabelle 2 nochmals beispielhaft die molalen osmotischen Koeffizienten für unterschiedlich stark konzentrierte NaCl-Lösungen und die sich hieraus ergebende reale Osmolalität im Vergleich zur idealen Osmolalität.
Gramm NaCl je Kilogramm Wasser |
reale Osmolalität(mosmol × kg-1) |
ideale Osmolalität(mosmol × kg-1) |
molaler osmotischer Koeffizient Φ |
Gefrierpunkts-erniedrigung (° C) |
|---|---|---|---|---|
3,087 |
100 |
105,67 |
0,9463 |
0,186 |
6,260 |
200 |
214,20 |
0,9337 |
0,372 |
9,463 |
300 |
323,83 |
0,9264 |
0,558 |
12,684 |
400 |
434,07 |
0,9215 |
0,744 |
15,916 |
500 |
544,66 |
0,9180 |
0,930 |
19,147 |
600 |
655,24 |
0,9157 |
1,116 |
22,380 |
700 |
765,86 |
0,9140 |
1,302 |
Quantitative Berechnung isotonisierender Zusätze
Wenn nun die Gefrierpunktserniedrigung oder die Osmolalität einer gegebenen pharmazeutischen Formulierung bestimmt wurden, bleibt nur noch, die Menge an Hilfsstoff zu berechnen, der eventuell noch zugesetzt werden muss, um eine isotone Zubereitung zu erhalten. In der pharmazeutischen Praxis haben sich hier vor allem folgende drei rechnerische Methoden etabliert. Daneben gibt es noch grafische Methoden, mit denen die Menge an Isotonisierungszusatz unter Verwendung von NaCl-Justierkurven oder Isotonisierungsnomogrammen ermittelt werden kann.
1. Ermittlung unter Verwendung der Gefrierpunktserniedrigung
mH = Masse des zur Isotonisierung zuzusetzenden Hilfsstoffs in Gramm
ΔTf = Gefrierpunktserniedrigung der zu isotonisierenden Wirkstofflösung
M = Molmasse des isotonisierenden Hilfsstoffs in g × mol‒1
mL = Masse des Lösungsmittels in g
Kf= kryoskopische Konstante (für Wasser gilt Kf = 1,86 K × kg × mol−1)
i = Van’t Hoff’scher Faktor (siehe oben)
Der Zahlenwert 0,52 ist die Gefrierpunktserniedrigung (in Kelvin) des Blutes bzw. der Tränenflüssigkeit gegenüber reinem Wasser. Ähnlich wie bei der Verwendung von Gleichung 4 findet sich auch in Gleichung 5 der Van’t Hoff’sche Koeffizient wieder. Es gelten somit die gleichen Gesetzmäßigkeiten wie im obigen Abschnitt.
2. Ermittlung unter Verwendung der DAC-Methode
Zur Ermittlung der zur Isotonisierung zuzusetzenden Menge an Hilfsstoff findet sich im DAC/Anlage B die folgende Vorgehensweise [3]:
n%H = Menge des zur Isotonisierung zuzusetzenden Hilfsstoffs in Prozent
n%W = Wirkstoffgehalt der Lösung in Prozent
ΔTfW1% = Gefrierpunktserniedrigung einer 1%igen Lösung des betreffenden Wirkstoffes gegenüber reinem Wasser
ΔTfH1% = Gefrierpunktserniedrigung einer 1%igen Lösung des betreffenden Hilfsstoffes gegenüber reinem Wasser
Die ΔT1%f -Werte für die gängigen, in der Rezeptur vorkommenden Wirk- und Hilfsstoffe sind im DAC/Anlage B in Tabellenform aufgeführt. Enthält eine Lösung mehrere Wirkstoffe, so sind die jeweiligen Werte für n%W × ΔTfW1% zu addieren.
Sollte eine Substanz nicht in der Tabelle des DAC/Anlage B aufgeführt sein, kann der Wert nach der folgenden Formel berechnet werden
Auch die Liso-Durchschnittswerte für verschiedene Elektrolyte sind im DAC/Anlage B aufgeführt und können für die Berechnung verwendet werden. Alternativ bleibt natürlich immer die experimentelle Bestimmung der Gefrierpunktserniedrigung der 1%igen Lösung des Wirkstoffs unter Verwendung eines Gefrierpunktosmometers.
Ein besseres Verständnis für den Umgang mit der DAC-Methode erhält man durch das in Kasten „Beispiel zur Verwendung der DAC-Methode“ gezeigte praktische Beispiel aus der pharmazeutischen Literatur [5].
Beispiel zur Verwendung der DAC-Methode
Fragestellung: 50 ml einer Lösung, die eine Wirkstoffmenge von 1 g Procain-HCl enthalten, sollen durch Zusatz von NaCl isotonisiert werden. Wie viel NaCl wird hierfür benötigt?
Die Konzentration der Wirkstofflösung berechnet sich zu 2%, da 2 g Procain-HCl in 100 ml gelöst sind. Im DAC/Anlage B findet man für Procain-HCl den Wert ΔTfW1% = 0,12 K und für NaCl den Wert ΔTfH1% = 0,58 K.
Das Ergebnis 0,48% entspricht einem isotonisierenden NaCl-Zusatz von 0,48 g pro 100 ml Lösung. Auf das Volumen von 50 ml bezogen müssen also 0,24 g NaCl zusätzlich gelöst werden, um eine isotone Formulierungslösung zu erhalten.
3. Ermittlung mit dem Natriumchlorid-Äquivalent
Das Natriumchlorid-Äquivalent E für einen Wirkstoff (oder auch Hilfsstoff) gibt die Natriumchlorid-Menge an, der 1 g des entsprechenden Wirk- oder Hilfsstoffes osmotisch äquivalent ist.
MNaCl = Molmasse von Natriumchlorid (MNaCl = 58,4 g/mol)
M = Molmasse des betrachteten Wirkstoffs
Liso (NaCl) = molare Gefrierpunktserniedrigung von NaCl (Liso (NaCl) = 3,4 K × l × mol‒1)
Liso = molare Gefrierpunktserniedrigung des Wirk- oder Hilfsstoffes
In verdünnten Lösungen kann anstatt der Molalität auch die Molarität, also die Stoffmengenkonzentration, verwendet werden. Der Liso-Wert ergibt sich somit aus der Gefrierpunktserniedrigung einer isotonen Lösung, die bekanntlich 0,52 K gegenüber reinem Wasser ist, und der Konzentration einer zu Blut oder Tränenflüssigkeit isotonen Lösung der betrachteten Substanz.
Durchnittswerte für verschiedene Elektrolyte sind ebenfalls im DAC/Anlage B oder in der Formelsammlung Pharmazie [6] zusammengestellt. Ist der Liso-Wert nicht bekannt, kann er durch Umstellen von Gleichung 7 und experimenteller Bestimmung der Gefrierpunktserniedrigung einer 1%igen Lösung des Wirkstoffes berechnet werden.
Ist das Natriumchlorid-Äquivalent des Wirkstoffs tabellarisch bekannt oder mittels Gleichung 8 berechnet, dann kann die zur Isotonisierung zuzusetzende NaCl-Menge ebenfalls einfach durch die folgende Gleichung berechnet werden:
V = Gesamtvolumen der Lösung (hier in Wert in ml einzusetzen)
EAS = Natriumchlorid-Äquivalent des Arzneistoffs
mAS = Masse des gelösten Arzneistoffs
Ein besseres Verständnis für den Umgang mit dem Natriumchlorid-Äquivalent erhält man durch ein praktisches Beispiel, wie in Kasten 2 „Beispiel zur Verwendung des Natriumchlorid-Äquivalents“ dargestellt [5].
Beispiel zur Verwendung des Natriumchlorid-Äquivalents
Fragestellung: 50 ml einer Lösung, die eine Wirkstoffmenge von 1 g Procain-HCl enthalten, sollen durch Zusatz von NaCl isotonisiert werden. Wie viel NaCl wird hierfür benötigt?
Es gibt nun verschiedene mehr oder minder aufwendige Vorgehensweisen:
a) Für den Fall, dass das Natriumchlorid-Äquivalent des Wirkstoffs bereits bekannt ist, kann es direkt für die Rechnung verwendet werden. Werte für das Natriumchlorid-Äquivalent gängiger Wirk- und Hilfsstoffe finden Sie zum Beispiel in der Formelsammlung Pharmazie [6].
Für Procain-HCl findet sich in der Literatur der folgende Wert:
EProcain-HCl = 0,21
Hiermit kann dann direkt die erforderliche Menge an NaCl, die zur Isotonisierung der Arzneistofflösung notwendig ist, berechnet werden:
Es sind also zusätzlich noch 0,24 g NaCl in der Formulierung zu lösen, um eine isotone Zubereitung zu erhalten.
b) Für den Fall, dass das NaCl-Äquivalent des Wirkstoffes nicht bekannt ist, kann dieses berechnet werden. Der Fall soll hier detailliert am Beispiel des Procain-HCl durchgegangen werden.
Der Liso-Wert für Procain-HCl wird durch die folgende Formel berechnet:
Die Gefrierpunktserniedrigung einer 1%igen Procain-HCl Lösung findet sich im DAC/Anhang B und hat den Zahlenwert 0,122 K. Wäre auch dieser Wert unbekannt, müsste er experimentell bestimmt werden. Die molare Masse von Procain-HCl ist 272,8 g/mol. Demnach berechnet sich der Liso-Wert des Procain-HCl zu
Das Natriumchlorid-Äquivalent berechnet sich somit zu
Dieses Ergebnis für das NaCl-Äquivalent des Procain-HCl bedeutet nichts anderes, als dass 1 g Procain-HCl osmotisch mit 0,21 g NaCl äquivalent sind.
Es ist bekannt, dass eine 0,9 %ige NaCl-Lösung, also eine Lösung mit 0,9 g NaCl in 100 ml, isotonisch ist. Deshalb berechnet sich die zuzusetzende Menge an Natriumchlorid nach
Das Ergebnis ist identisch mit dem in a) berechneten Ergebnis.
White-Vincent-Methode
Das Natriumchlorid-Äquivalent E eines Arzneistoffs kann auch zur Berechnung des für die Herstellung einer isotonischen Arzneistofflösung erforderlichen Wasservolumens verwendet werden. Danach wird mit Hilfsstofflösung auf das erforderliche Endvolumen aufgefüllt.
Viso = für die Herstellung einer isotonischen Lösung erforderliches Volumen
Viso1 g NaCI = Volumen einer isotonischen Lösung von 1 g NaCl
(Viso1 g NaCI = 111,1 ml × g-1)
Methodenauswahl
Prinzipiell kann jede der oben dargestellten Methoden für die Berechnung der Menge an Isotonisierungszusatz zur Herstellung einer isotonen Zubereitung verwendet werden. Bei der Auswahl der Methode kommt es in der Praxis meist aber darauf an, welche Daten zu den Formulierungsbestandteilen vorhanden sind und ob sich die für eine einfache Berechnung benötigten Werte in den oben genannten Tabellenwerken finden lassen. Falls nicht, ist die Bestimmung des zuzusetzenden Isotoniserungshilfsstoffes nicht unmöglich. Es erfordert lediglich ein wenig mehr Aufwand, sowohl experimentell durch die Messung der Gefrierpunktserniedrigung als auch bei der mathematischen Berechnung. |
Literatur
[1] Munk K. Taschenlehrbuch Biologie – Botanik. 1. Auflage 2009, Georg Thieme Verlag KG, Stuttgart
[2] Europäisches Arzneibuch. 2.2.35 Osmolalität. 8. Ausgabe, Grundwerk 2014:77–78
[3] Angaben zur Isotonisierung. DAC/NRF: DAC – Anlage B, Stand DAC 2006; Stand CD-Fassung 2013/2. Govi Verlag Pharmazeutischer Verlag GmbH, Eschborn
[4] Bauer KH, Frömming KH, Führer C. Pharmazeutische Technologie. 9. Auflage 2012, Deutscher Apotheker Verlag Stuttgart, 404
[5] Fahr A, Voigt R. Pharmazeutische Technologie für Studium und Beruf. 12. Auflage 2015. Deutscher Apotheker Verlag Stuttgart, 468
[6] Schiffter HA, Ziegler AS. Formelsammlung Pharmazie für Studium und Beruf. Wissenschaftliche Verlagsgesellschaft Stuttgart 2012
[7] Daniels R. Galenische Tricks zur Anwendung am Auge. Pharm Ztg 2003;19:21-29


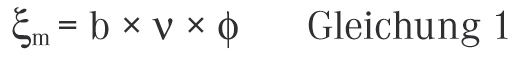
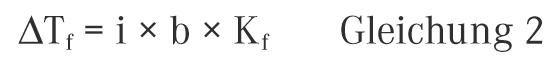
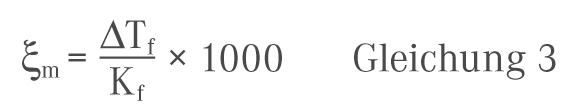
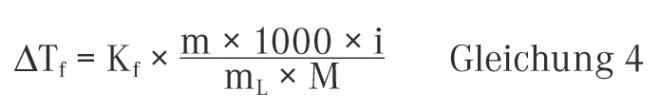
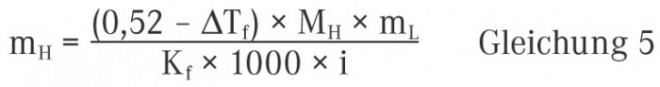
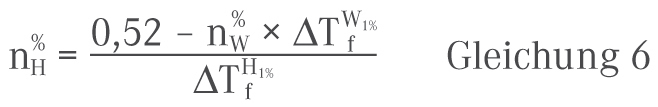
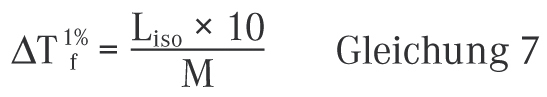
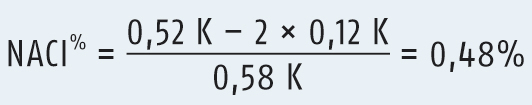
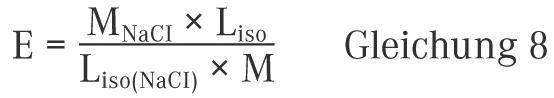
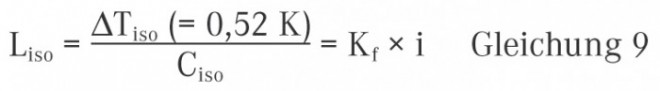
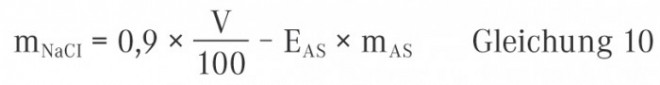

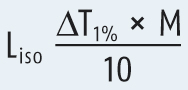
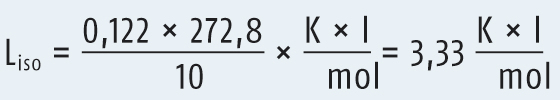
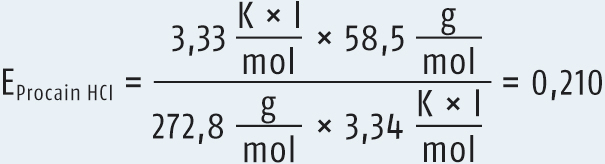

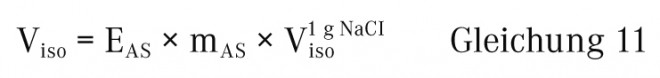





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.