
- DAZ.online
- DAZ / AZ
- DAZ 44/2015
- NIR-Spektroskopie
Schwerpunkt Labor
NIR-Spektroskopie
Möglichkeiten und Grenzen dieser Arzneibuchmethode im Apothekenlabor
Spektroskopie im Nahinfrarotbereich (NIR-Bereich) ist eine Arzneibuchmethode, die für die Identifizierung von Ausgangsstoffen nahezu ideal geeignet ist. Wegen der niedrigen Absorption liegt die Eindringtiefe von NIR-Strahlung in die Probe im mm-Bereich. Dadurch können neben Haufwerken wie Arzneistoffpulvern, halbfesten und festen Zubereitungen sogar Teedrogen spektroskopisch untersucht und dabei entscheidende Inhaltsstoffe wie ätherische Öle in tieferliegenden Blattkompartimenten ohne Probenvorbereitung mit erfasst werden. Das Anwendungsspektrum der NIR-Spektroskopie (NIRS) ist deshalb sehr breit und umfasst chemisch definierte organische Arznei- und Hilfsstoffe, deren Salze (z. B. Arzneistoff-Hydrochloride) und Solvate (z. B. Hydrate oder Estolate), viele Drogen, Lösungsmittel und mit Einschränkungen auch halbfertige Salbengrundlagen bzw. Rezepturkonzentrate, sowie weniger definierte organische Hilfsstoffe wie Cellulosederivate, Fette und Wachse. Während z. B. Pfefferminzblätter schnell und zerstörungsfrei eindeutig identifiziert werden können, ist die Unterscheidung zwischen Ammi Visnaga-Früchten, Anis und Kümmel schwierig. Sehr ähnliche Drogen werden nur als einer Substanzgruppe zugehörig identifiziert. Bei wirkstofffreien Salbengrundlagen ist die Notwendigkeit der Zusammenfassung zu Substanzgruppen sogar die Regel, daher ist NIRS eben nur nahezu ideal und kann nicht für alle Substanzen die alleinige Methode im Apothekenlabor werden. Allerdings kann durch zusätzlich Prüfungen häufig problemlos eine ausreichende Sicherheit der Identifizierung erreicht werden.
Vorteile
Speziell für die zeitlich zwischen andere pharmazeutische Tätigkeiten geradezu eingequetschte Analytik im Apothekenlabor ist von Vorteil, dass Proben direkt identifiziert werden können, ohne die zu prüfende Substanz z. B. vorher mit Kaliumbromid verreiben oder zeitlich praktisch nicht unterbrechbare chromatografische Operationen in den Apothekenalltag eintakten zu müssen. Gleichzeitig kann der Umgang mit Gefahrstoffen durch NIRS auf ein Minimum begrenzt werden und ist nur unverzichtbar, wenn eine eindeutige Identifizierung bei der Ausgangsstoffprüfung auch nicht durch Kombination von NIRS und Schmelzpunktbestimmung möglich ist. Anders als bei der Infrarotspektroskopie im mittleren IR-Bereich (MIR) werden die bandenarmen aber informationsreichen NIR-Spektren nicht visuell sondern durch statistische Methoden computergestützt, also chemometrisch, bewertet. Die chemischen und physikalischen Informationen werden dazu aus den experimentellen Messdaten von Vergleichsspektren extrahiert und zu einem chemometrischen Modell bzw. Identifizierungsmodul verarbeitet. Idealerweise werden dabei Proben aller Lieferanten berücksichtigt, von denen Ausgangsstoffe bezogen werden sollen. Auf diese Weise können Unterschiede z. B. in der Korngröße oder der Korngrößenverteilung berücksichtigt werden. Ob diese Unterschiede qualitätsbestimmend sind oder nicht, muss bei der Modellerstellung bekannt sein und bedacht werden. Der hohe Aufwand der Erstellung eines auf einer Spektrensammlung der gängigen Ausgangsstoffe und Drogen beruhenden Identifizierungsmoduls muss nicht von der anwendenden Apotheke bewältigt werden, sondern wird Geräte-spezifisch von den Herstellern der NIR-Geräte als Dienstleistung angeboten. Das ist sinnvoll, weil dadurch der Anwenderwert des NIR-Geräts deutlich steigt und weil die Kosten für die Beschaffung der benötigten Referenzsubstanzen und die chemometrische Modellerstellung so auf viele Nutzer baugleicher Geräte umgelegt werden können. Seit der achten Ausgabe des Europäischen Arzneibuchs wird in der Monographie 2.2.40 nicht mehr gefordert, dass der Anwender die mathematischen Grundlagen der verwendeten Methoden nachvollziehen können muss, und die Chemometrie läuft also unbemerkt im Hintergrund der Identifizierung. Mittlerweile sind die kommerziell lizensierbaren aus Vergleichsspektren generierten chemometrischen Auswertemodule sehr umfangreich und praxistauglich.
Geeignet für 80 Prozent der apothekenüblichen Ausgangsstoffe
Schätzungsweise können 80% der in der Apotheke üblichen Ausgangsstoffe mittels NIRS alleine oder in Kombination mit Zusatzprüfungen identifiziert werden. Auch wenn die Analytik grundsätzlich in der Apotheke ausgeführt werden muss, kann bei der Methodenerstellung Expertenwissen zur Unterstützung genutzt werden. Dies ist teilweise kontrovers diskutiert worden; andererseits werden seit Langem außerhalb der Apotheke aufgenommene Spektrenbibliotheken zur Arzneistoffidentifizierung eingesetzt. Da es aber eine Ermessensfrage ist, welche analytischen Vorarbeiten delegiert werden dürfen und welche nicht, ist eine konstruktive inhaltliche Auseinandersetzung mit regulatorischen Stellen ratsam. Ein einfacher Vergleich von Spektren mit einer Spektrensammlung oder einem einzelnen Spektrum einer Referenzsubstanz ohne chemometrische Verfahren und Datenvorbehandlung führt hingegen nur ausnahmsweise zum gewünschten Erfolg. Die Identifizierung von nicht-apothekenüblichen Ausgangsstoffen ist deshalb weder vorgesehen noch ohne weiteres möglich.
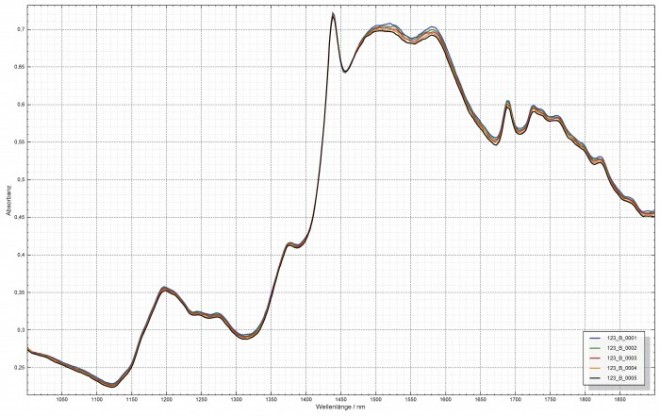
In der Apotheke steht die reibungslose Identifizierung der in der Rezeptur- und Defektur verwendeten Ausgangsstoffe im Vordergrund, deshalb ist es wichtig, viele Chargen handelsüblicher Proben für die Modellerstellung zu messen (Abbildung 1, fünf Spektren von chemisch identischen Zuckerkristallen). Eine irrtümliche Ablehnung bei einer Identitätsprüfung wird dadurch unwahrscheinlicher, weil die Unterschiede der ähnlichen Proben im Modell enthalten sind. Steht dagegen eine Abgrenzung z. B. verschiedener Kristallformen eines Wirkstoffs im Vordergrund, kann es sinnvoller sein, Spektren verschiedener polymorpher Formen derselben Substanz getrennt einer chemometrischen Auswertung zuzuführen und getrennt in einer Referenzdatenbank abzulegen. Diese Abgrenzung könnte dann erforderlich sein, wenn unterschiedliche handelsübliche Kristallformen sich in ihrer Löslichkeit unterscheiden und dies für die Herstellung oder die Wirkstoffaufnahme aus dem Arzneimittel relevant ist. Da polymorphe Formen von Arzneistoffen aufgrund der unterschiedlichen Kristallgitter auch unterschiedliche Schmelzbereiche aufweisen können, ist das Wissen, welche Kristallform vorliegt, auch für die zusätzliche Identitätsprüfung mittels Schmelzpunktanalyse von Bedeutung.
Abb. 1: Bandenarm aber Informationsreich: Fünf übereinandergelegte NIR-Spektren von Zuckerkristallen. Chemisch identische Saccharose-Kristalle ergeben bei leicht abweichender Packungsdichte leicht abweichende Spektren.
Zusatzprüfungen können erforderlich sein
Zur Verwendung marktüblicher NIR-Spektrometer ist keine spezielle technische Expertise wie bei der Bedienung eines NMR-Geräts noch experimentelles Geschick wie bei der nass-chemischen Analytik erforderlich. So wird die geeignete Aufnahmedauer und Anzahl der Scans für Ausgangsstoffe in der Regel voreingestellt und muss nicht vom Anwender gewählt werden. In der Apotheke muss nur darauf geachtet werden, dass der gleiche Messmodus angewendet wird, wie bei der Erstellung der Vergleichsdaten. In der Regel ist dieser Prozess Software-geführt oder automatisiert. Allerdings ist es notwendig, wissenschaftlich zu beurteilen, ob und welche Zusatzprüfungen erforderlich sind, um die Qualifizierung und Implementierung des NIR-Spektrometers in das Qualitätsmanagementsystem und die Validität der chemometrischen Identifizierung zu gewährleisten. Auch bei diesen Aufgaben leisten die Gerätehersteller zunehmend Hilfe und schlagen z. B. bereits Listen mit plausiblen und praktikablen Zusatzprüfungen vor und gestatten den Zugriff auf für die Bewertung der Validität wichtige Daten wie z. B. die Chargennummern der verwendeten Referenzsubstanzen.
Was die Spezifität aussagt
Um die ausreichende Qualität des Auswertemoduls als validiert angeben zu können, ist zu prüfen, ob für alle Substanzklassen chemometrische Modelle vorliegen, bei denen eine ausreichende Abstandsmatrix und keine falsch-positiven Ergebnisse erhalten werden. Außerdem müssen technische Details dokumentiert werden, mindestens Spektralbereich und Anzahl der Datenpunkte, Messtechnik und Datenvorbehandlung, Datenauswertung (PCA/Clusteranalyse), Akzeptanzgrenzen, Spezifität und Robustheit sowie die Archivierung der elektronischen Rohdaten. Insbesondere die Spezifität ist hier aussagekräftig, gemeint ist damit nicht die Spezifität wie bei einer ionenspezifischen Elektrode, sondern die Spezifität eines Klassifikators. Dies ist der Quotient aus richtig negativen Ergebnissen und der Summe aller richtig negativen und falsch positiven Ergebnisse. Mit anderen Worten: Unter allen mit falschem Namen vorgelegten Substanzen gibt die Spezifität den Anteil an, der auch als negativ erkannt („Entspricht nicht“) und abgelehnt wird. Wenn das Modell keine falsch positiven Ergebnisse produziert, wird die Spezifität („Richtig Negativ-Rate“) 100%, das Modell ist also geeignet. Diese Daten müssen vom Hersteller abgefragt werden.
Lastenheft für die Apotheke
- Verankerung der NIRS im Qualitätsmanagementsystem
- Möglichkeiten zur ergänzenden Prüfung müssen vorhanden sein
- Qualifizierung des Personals (wenig Aufwand)
- Nachweis der ausreichenden Qualität des Auswertemoduls (mehr Aufwand)
Beispiel: Ammi visnaga, Anis und Kümmel
Da die Abstandsmatrix zur Unterscheidung zwischen Ammi Visnaga-Früchten, Anis und Kümmel in diesem Beispiel nicht ausreicht, sind hier eindeutig zusätzliche Prüfungen notwendig. Die NIRS kann z. B. nicht so leicht zwischen Kümmel und zerstoßenem Kümmel differenzieren wie das menschliche Auge (Abbildung 2). Es ergeben sich aber noch weitere Möglichkeiten der organoleptischen Prüfung durch die erfolgte Zuordnung zu einer Substanzgruppe. Die Gefahr der Vergiftung bei organoleptischen Prüfungen ist minimal, da im Zusammenspiel mit der NIRS bereits sichergestellt ist, dass es sich in diesem Beispiel entweder um Ammi Visnaga-, Anis- oder Kümmel-Früchte handelt. Riechen an der Probe ist deshalb als ungefährlich einzustufen.
Abb. 2: Die abgebildete Probe ganzer Kümmel-Früchte muss durch eine Zusatzprüfung von zerstoßenem Kümmel, Anis- und Ammi Visnaga-Früchten unterschieden werden.
Unzureichend definierte Teedrogen, die Gemische verschiedener Pflanzen wechselnder Zusammensetzung sind, oder z. B. TCM-Drogen, die erst durch spezielle, nicht ausreichend reproduzierbare Zubereitungsverfahren erhalten werden und in ihrer Zusammensetzung chargenabhängig sehr stark schwanken, können nur als Charge im direkten Vergleich mit einem anderen Muster derselben Charge oder aus einem chemometrischen Modell, das auf vorgegebenen Chargen beruht, identifiziert werden.
Wo die NIRS in der Apotheke sinnvoll sein kann
In der Apotheke wird die NIRS für folgende Anwendungen aus dem Bereich Qualitative Analyse eingesetzt:
- Identifikation von Ausgangsstoffen (Arznei- und Hilfsstoffen) vor der Herstellung (in Rezeptur und Defektur)
- Identifikation von Ausgangsstoffen (Arznei- und Hilfsstoffen) während der Defektur
- Identifikation von Rezepturkonzentraten
- Identifikation von gepulverten Drogen
- Berührungslose und verlustfreie Identifizierung hochpotenter Wirkstoffe und BtM im Originalgefäß aus Glas (NIR-Strahlung durchdringt Glas)
- Identifikation von Defekturarzneimitteln (nach individueller Erstellung von Referenzdaten)
Neben der Identitätskontrolle von Ausgangsstoffen kann die NIRS auch bei der Qualitätskontrolle in der Rezeptur (qualitativ und quantitativ) und Defektur (qualitativ und quantitativ) eingesetzt werden. Eine Konzentration von mindestens 0,1% des Analyten muss in Zubereitungen vorhanden sein, um eine Bestimmung durchführen zu können. Die Kombination von NIRS mit chemometrischen Auswertemethoden ergibt eine sehr leistungsfähige Technik, bei der durch die Modellerstellung festgelegt werden kann, ob z. B. galenisch relevante Parameter wie Partikelgrößenverteilungen berücksichtigt werden sollen oder nicht.
Quantitative Analysen mit hinreichender Richtigkeit zu lösen ist aber noch schwieriger und hängt auch von dem konstruktiven Aufwand des verwendeten NIR-Spektrometers ab. Für die Apotheke sind konstruktiv weniger aufwändige NIR-Geräte aufgrund ihres Preis-Leistungs-Verhältnisses besonders interessant (siehe Abb. 3). Nach heutigem Stand sind diese für Apotheken vermarkteten Geräte nur für qualitative Fragestellungen optimal und können eher nur für halbquantitative Fragestellungen oder Abschätzungen der ordnungsgemäßen Ausführung von Rezeptur- und Defekturarbeitsgängen herangezogen werden. Leistungsfähigere industriell eingesetzte NIR-Geräte, mit denen sogar der Fettgehalt von Kondensmilch oder Hackfleisch gemessen werden kann, sind aber teuer und die Methodenentwicklung für individuelle Rezepturen stellt ein ungelöstes Problem dar.
Abb. 3: Ein NIRS-Gerät für das Apothekenlabor ist relativ kompakt und benötigt wenig Platz.
Defekturarzneimittel können grundsätzlich wie andere halbfeste oder feste Proben untersucht werden, häufig steht allerdings kein chemometrisches Modell zur Auswertung zur Verfügung. Für Rezeptur- und Defekturarzneimittel, bei denen eine exakte Gehaltsbestimmung aufgrund einer Risikoabschätzung als verzichtbar gelten kann, können Bereiche in NIR-Spektren herangezogen werden, in denen ein linearer Zusammenhang zwischen der gemessenen Absorbanz und dem Wirkstoffgehalt ablesbar ist, und analog einer Kalibriergeraden in der UV/Vis-Spektrometrie ausgewertet werden. Dies wäre z. B. bei einer halbfesten Zubereitung eines NSAID als Schmerzsalbe vorstellbar. Abhängig vom Risikoscore ist ein direkter Spektrenvergleich ausreichend, oder es muss ein entsprechendes individuelles Modell erstellt werden. In dem weiten Feld zwischen der Bestimmung einfacher Surrogatparameter und einer HPLC-Analytik kann die NIRS viele Bereiche abdecken. |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.