
- DAZ.online
- DAZ / AZ
- DAZ 43/2015
- Rezepturen konservieren
Rezepturen konservieren
Wann? Wie? Womit?
Konservierungsmittel werden nur für mikrobiell anfällige Zubereitungen benötigt. Werden sie eingesetzt, müssen neben der Kompatibilität mit allen weiteren Bestandteilen auch die pH-Optima der verwendeten Substanzen beachtet werden.
Mikrobielle Anfälligkeit von Rezepturen
Bei der Frage nach dem Einsatz eines Konservierungsmittels muss zunächst ermittelt werden, ob die Rezeptur ohne weitere Konservierung als mikrobiell anfällig einzustufen ist. Einen ersten Aufschluss gibt dabei die Art der Grundlage. Wasserfreie Grundlagen können generell als mikrobiell nicht anfällig eingestuft werden. Auch Grundlagen, die Wasser nur als innere Phase enthalten (lipophile Cremes oder Emulsionen, vor allem bei kleiner Tröpfchengröße durch industrielle Herstellung), zeigen nur ein geringes Kontaminationsrisiko. Hydrophile Cremes oder Hydrogele hingegen, bei denen Wasser in Mikroorganismen zugänglicher Form enthalten ist, sind als mikrobiell anfällig anzusehen.
Ein weiterer Blick gilt den in der Grundlage enthaltenen Wirk- und Hilfsstoffen. Eine Vielzahl von Wirkstoffen wirkt bereits in therapeutischer Konzentration ausreichend antimikrobiell und macht den weiteren Einsatz von Konservierungsmitteln unnötig. Ein Großteil dieser Substanzen ist in Tabelle 1 aufgeführt. Auch Hilfsstoffe wie Ethanol, Isopropanol oder Propylenglycol sind in genügend großer Konzentration antimikrobiell wirksam. Sie werden dennoch nicht im klassischen Sinne zu den Konservierungsmitteln gerechnet, da ihre Einsatzkonzentration vergleichsweise groß ist.
Aluminiumchlorid-Hexahydrat |
Ammoniumbituminosulfonat |
Benzoylperoxid |
Chinolinolsulfat |
Chlorhexidinsalze |
Eosin-Dinatrium bei pH 5 |
Ethacridinlactat-Monohydrat ab pH 5,5 und 0,5% |
Iod |
Kaliumpermanganat |
Methylrosaniliniumchlorid |
Natriumhypochlorit |
Octenidindihydrochlorid |
Polyhexanid |
Povidon-Iod |
Salicylsäure |
Schwefel |
Selendisulfid |
Silbernitrat |
Steinkohlenteer |
Tetracain |
Tosylchloramid-Natrium |
Trichloressigsäure |
Wasserstoffperoxid |
Zinkoxid |
Neben den ausreichend antimikrobiell wirksamen Wirkstoffen gibt es
jedoch auch einige Substanzen, bei denen man auf den ersten Blick davon
ausgehen könnte, dass sie ebenfalls zu dieser Gruppe gezählt werden
können. Tatsächlich ist die Wirksamkeit jedoch nicht in dem Umfang
gesichert, dass sie den zusätzlichen Einsatz eines Konservierungsmittels
in mikrobiell anfälligen Rezepturen überflüssig machen können. Diese
Substanzen sind in Tabelle 2 gelistet.
Weiterhin sei erwähnt, dass auch vorkonservierte Grundlagen bzw. Fertigarzneimittel als mikrobiell anfällig einzustufen sind, wenn bei der Weiterverarbeitung so viel Wasser zugesetzt wird, dass die Verdünnung zu stark ist. Dies gilt auch, wenn der pH-Wert derart verändert wird, dass ein enthaltenes Konservierungsmittel seine Wirksamkeit verliert.
Bacitracin |
Chloramphenicol |
Clindamycin |
Clioquinol |
Erythromycin |
Fusidinsäure, Natriumfusidat |
Gentamicinsulfat |
Harnstoff |
Neomycinsulfat |
Tannin |
Tetracyclinhydrochlorid |
Triclosan |
Abgabe unkonservierter mikrobiell anfälliger Zubereitungen
Es gibt Ausnahmesituationen, in denen auch mikrobiell anfällige Zubereitungen nicht konserviert werden sollen oder dürfen. Dies kann durch die Art der Anwendung bedingt (z. B. die Anwendung bei chirurgischen Eingriffen am Auge), kann aber auch auf Verlangen des Arztes der Fall sein. Der verschreibende Arzt hat jederzeit die Möglichkeit, die Anwendung von Konservierungsmitteln in der verschriebenen Rezeptur auszuschließen (sine conservata). Nur dann sollte die Apotheke auf die Konservierung mikrobiell anfälliger Zubereitungen verzichten. Diese Vorgehensweise wird auch unter den Ärzten so kommuniziert. Wird eine mikrobiell anfällige Rezeptur nun unkonserviert abgegeben, müssen besonders umfassende sonstige Hygienevorkehrungen für die Anwendung beim Patienten getroffen werden. Dazu gehört auch die Aufklärung des Patienten über Hygienemaßnahmen. Hierzu zählen bei der Abgabe von halbfesten Zubereitungen zur dermalen Anwendung:
- Entnahme der Zubereitung am besten nur mit Spatel (alternativ: frisch gewaschene Hände)
- Bei Drehdosierkruke (Topitec®): Entfernen überschüssiger Zubereitung an der Entnahmeöffnung
- richtige Anwendung der Unguator®-Direktkruke (nicht den „großen“ Deckel öffnen, sondern nur den „kleinen“ und die Zubereitung über den Hubboden aus der Öffnung schieben)
- Lagerung dicht verschlossen im Kühlschrank bzw. im Schlafzimmer (oder einem anderen nicht zu warmen Raum), nicht jedoch im Badezimmer oder auf der Fensterbank
Die Aufbrauchfrist ist je nach Art der Zubereitung, Primärpackmittel und Lagerung auf eine, zwei oder zum Teil auch vier Wochen zu begrenzen. Konkrete Empfehlungen hierzu sind beispielsweise den Tabellen für die Rezeptur des NRF zu entnehmen.
Verpackung und Lagerung dermaler Zubereitungen
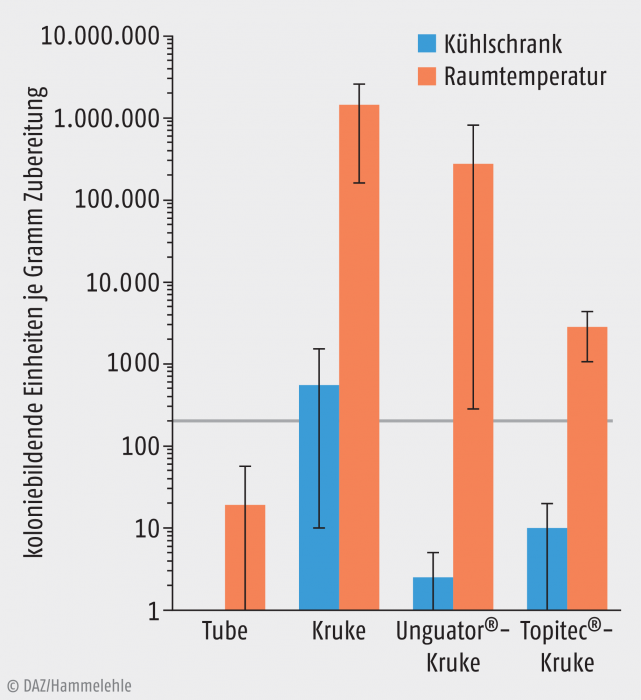
Welchen Einfluss die Art des Packmaterials und die Lagerungsbedingungen auf die mikrobielle Qualität einer Zubereitung haben, wird in Abbildung 1 dargestellt. Es handelt sich dabei um eine von der Autorin durchgeführte Untersuchung frisch hergestellter unkonservierter Unguentum emulsificans aquosum.
Abb. 1: Vergleich der mittleren Keimbelastung nach simulierter unhygienischer einwöchiger Anwendung von Unguentum emulsificans aquosum (unkonserviert), die unterschiedlich gelagert und verpackt wurde. Die Fehlerbalken geben die Spannweite der Einzelergebnisse von drei Doppelbestimmungen an. Der markierte Wert von 200 KBE je g Zubereitung ist das im Europäischen Arzneibuch zulässige Maximum der Keimbelastung für dermale Zubereitungen. Aus mikrobieller Sicht ist die Tube konkurrenzlos das hygienischste Packmittel. Die Kühllagerung schränkt mikrobielles Wachstum zudem deutlich ein.
Testparameter:
- Unguentum emulsificans aquosum, nicht konserviert
- einmal täglich Entnahme einer kleinen Menge Zubereitung
- Entnahme direkt aus dem Abgabegefäß mit ungewaschenen Händen
- Zeitraum: eine Woche
- drei getrennt hergestellte Zubereitungen
- jeweils Doppelbestimmung an einer Zubereitung
- Lagerung: Kühlschrank vs. Raumtemperatur
- Verpackungen: Alu-Tube, klassische Kruke, Topitec®-Kruke, Unguator®-Kruke
- Packmittel wurden vor Abfüllung mit Isopropanol 70% desinfiziert (keine Hersteller-Vorgabe)
- keine Bestimmung von Pilzen und Hefen
Dargestellt ist die Keimzahl (KBE = koloniebildende Einheiten) aerober Mikroorganismen je g der Zubereitung, nachdem über einen Zeitraum von einer Woche eine tägliche Anwendung mit ungewaschenen Händen simuliert wurde. Die Keimzahl am Tag nach der Herstellung wurde ebenfalls untersucht, wobei kein mikrobielles Wachstum zu beobachten war. Die in der Darstellung markierte Zahl von 200 KBE/g Zubereitung ist den Anforderungen des Europäischen Arzneibuchs (Kapitel 5.1.4) an Zubereitungen zur kutanen Anwendung entnommen. Es ist dabei die Aufgabe des Apothekers/der Apotheke, dafür zu sorgen, dass diese Qualitätsanforderung nicht nur bei der Abgabe, sondern auch während der Anwendung beim Patienten gewährleistet ist.
Die Ergebnisse zeigen deutlich, dass eine Lagerung der Zubereitung im Kühlschrank das mikrobielle Wachstum so hemmt, dass die mikrobielle Qualitätsanforderung in diesem Fall tatsächlich auch bei unvorsichtiger Anwendung durch den Patienten eingehalten werden konnte, sofern als Verpackung keine einfache Kruke gewählt wurde. Eine solche Lagerung ist allerdings nur dann möglich, wenn dadurch die Löslichkeit in der Zubereitung enthaltener Substanzen (z. B. Harnstoff) nicht zu stark herabgesetzt wird. Ist die Lagerung im Kühlschrank keine Option, so sollte wann immer möglich die Tube als Verpackung gewählt werden. Im Gegensatz zu den Spenderdosen war hier auch bei Lagerung bei Raumtemperatur kein unangemessen starker mikrobieller Befall zu beobachten. Daten zum Vergleich zwischen Tube und Spenderdose für einen Patienten, der sich hygienisch angemessener verhält als der hier simulierte Patient, liegen allerdings nicht vor. Ein Vergleich der beiden Spenderdosen ist anhand der vorliegenden Daten nicht möglich. Bei sachgemäßer Anwendung spricht nach derzeitigem Stand nichts dagegen, sie aus mikrobiologischer Hinsicht als ähnlich einzustufen.
Konservierung dermaler Zubereitungen
Ist nun eine Rezeptur ohne weitere Konservierung als mikrobiell anfällig einzustufen und spricht nichts gegen eine Konservierung, so ist es der Normalfall, die Zubereitung zu konservieren. Es stellt sich dann die Frage nach dem geeigneten Konservierungsmittel.
Werden vorkonservierte Grundlagen mit Wasser verdünnt, sollte wenn möglich das bereits enthaltene Konservierungsmittel auch weiterhin verwendet werden.
Handelt es sich um eine bisher unkonservierte Zubereitung, so muss die Auswahl des Konservierungsmittels im Hinblick auf Wirksamkeit und Stabilität bei dem pH der Rezeptur (der sich nach dem Wirkstoff richten muss) und Kompatibilität aller Substanzen sowie die Darreichungsform erfolgen. In den Tabellen für die Rezeptur findet man eine Übersicht über die rezepturtypischen Konservierungsmittel. Dort sind Informationen zur Einsatzkonzentration, zum pH-Bereich, weiteren Besonderheiten und zu möglichen Darreichungsformen angegeben. Zu beachten ist, dass die Einsatzkonzentration (außer bei Ethanol, Propylenglycol und Pentylenglycol) ungeachtet der in der Zubereitung enthaltenen Wassermenge immer in Bezug auf die Gesamtmenge der Zubereitung angegeben wird.
Es finden sich dort (unter Vernachlässigung verschiedener Salze bzw. Reste) 15 Konservierungsmittel. Von diesen 15 werden vorrangig drei Konservierungsmittel von der Deutschen Gesellschaft für Dermopharmazie für den Einsatz in der Rezeptur vorgeschlagen. Es handelt sich dabei um die Parabene, Sorbinsäure/Kaliumsorbat und Propylenglycol. Daher werden an dieser Stelle auch die drei genannten Substanzen am ausführlichsten besprochen.
Sorbinsäure/Kaliumsorbat: Die antimikrobiell wirksame Sorbinsäure kann entweder direkt verarbeitet werden oder aus dem besser wasserlöslichen Kaliumsorbat (das selbst nicht antimikrobiell wirksam ist) durch Ansäuern in der Rezeptur freigesetzt werden. Daraus ergibt sich auch der rezeptierbare pH-Bereich von 3,5 bis 5,5. Sorbinsäure wird in einer Konzentration von 0,05% bis 0,2% eingesetzt, was 0,067% bis 0,268% Kaliumsorbat entspricht. In den meisten standardisierten Rezepturen des NRF, in denen Kaliumsorbat eingesetzt wird, dient Citronensäure (in halber Menge des Kaliumsorbats) zum Freisetzen der Säure. Die benötigte Menge Zitronensäure hängt jedoch vom pH-Wert der Zubereitung ab und sollte daher bei nicht standardisierten Rezepturen nicht ohne pH-Kontrolle gewählt werden. Sofern die Sorbinsäure nicht bereits Bestandteil von Halbfertigware ist, müssen bei der Konservierung von Rezepturen noch einige Aspekte praktisch berücksichtigt werden: Sorbinsäure hat mit 0,16 g/100 ml eine geringe Wasserlöslichkeit. Daher ist in den Rezepturen ein Mindestwassergehalt von 62,5% nötig, wenn die Sorbinsäure-Konzentration 0,1% betragen soll. Um während der Herstellung aus Einzelbestandteilen die Sorbinsäure zu lösen, muss die wässrige Phase erhitzt werden. Da dies bei der Herstellung von Cremes sowieso der Fall ist, kann hierfür Sorbinsäure ohne den Umweg über Kaliumsorbat gut verwendet werden. Da Sorbinsäure allerdings auch eine gewisse Wasserdampfflüchtigkeit zeigt, sollte das Erhitzen nur so lange durchgeführt werden, wie zum Lösen nötig ist. Es kann außerdem sinnvoll sein, das Gefäß beispielsweise mit einem Uhrglas abzudecken.
Für die Herstellung von Gelen, die üblicherweise ohne Erhitzen erfolgt, ist es entsprechend sinnvoll, zunächst Kaliumsorbat einzusetzen, das am Ende der Herstellung durch Ansäuern die Sorbinsäure freisetzt.
Sorbinsäure ist oxidationsanfällig, die Oxidation wird durch Schwermetalle beschleunigt. Auch der Kontakt mit Packmitteln kann zu Aktivitätsverlusten führen. Sie ist nicht sensibilisierend.
Parabene: Die Parabene sind auch bekannt als p-Hydroxybenzoesäureester (PHB-Ester). In der Rezeptur werden dabei Methyl-4-Hydroxybenzoat (MHB) und Propyl-4-Hydroxybenzoat (PHB, auch als Nipagin und Nipasol geläufig) im Konzentrationsbereich von 0,05% bis 0,1% eingesetzt. Bezogen auf die Einzelsubstanzen beträgt die Einsatzkonzentration 0,05% bis 0,2% für MHB und 0,01% bis 0,03% für PHB. Bei den Parabenen handelt es sich um phenolische Substanzen, sodass eine Inkompatibilität mit Substanzen, die Ether-Sauerstoffe enthalten, nicht ausgeschlossen werden kann. Es sollte daher vermieden werden, Zubereitungen, die beispielsweise Celluloseether oder PEG-haltige Substanzen (viele nicht-ionische hydrophile Tenside haben einen PEG-Rest) enthalten, mit Parabenen zu konservieren. Beide Substanzen haben eine (sehr) schlechte Wasserlöslichkeit (MHB: 0,25% bei 25 °C; PHB: 0,04% bei 20 °C), die mit sinkender Temperatur weiter abnimmt. Eine Aufbewahrung parabenhaltiger Rezepturen im Kühlschrank sollte unter anderem deswegen unbedingt vermieden werden. Zudem haben die Parabene einen vergleichsweise hohen Verteilungskoeffizienten, was bedeutet, dass sie sich in mehrphasigen Systemen bevorzugt in der Fettphase anreichern. „Kritische“ Fette sind dabei vor allem flüssige Wachse, Fettalkohole und Triglyceride, wohingegen die Anreicherung in Paraffinkohlenwasserstoffen kaum ins Gewicht fällt. Die gewisse Lipophilie ist allerdings für die antimikrobielle Wirksamkeit vonnöten.
Die Parabene können in einem vergleichsweise großen Bereich von pH 2 bis pH 8 zur Konservierung verwendet werden. Sie sind in einem Verhältnis von 3 + 1 (MHB + PHB) mit einer Gesamtkonzentration von 0,1% im Konservierten Wasser DAC enthalten.
Auf normaler Haut wirken sie nicht reizend, auf geschädigter Haut können sie allerdings sensibilisierend wirken. Ihr Einsatz sollte daher nicht unkritisch erfolgen. Für die kosmetische Anwendung stuft das Bundesinstitut für Risikobewertung Methylparaben in Konzentrationen bis 0,4% als sicher ein. Die Konzentration von Propylparaben wird auf 0,19% beschränkt.
Propylenglycol: Aufgrund seiner hohen Einsatzkonzentration von 20% bezogen auf die Wasserphase ist Propylenglycol eigentlich nicht als Konservierungsmittel zu bezeichnen. Da die Abgrenzung im Sprachgebrauch jedoch immer mehr verschwimmt, soll auch Propylenglycol an dieser Stelle behandelt werden. Es wirkt pH-unabhängig und ist daher das präferierte Konservierungsmittel für Erythromycin-haltige Rezepturen, deren pH-Optimum bei 8 bis 8,5 liegt. Bei Propylenglycol handelt es sich um eine farblose Flüssigkeit, die in Wasser sehr leicht löslich ist. In Konzentrationen über 20% hat Propylenglycol ein erhöhtes allergenes Potenzial. Außerdem kann Propylenglycol die Aufnahme von Wirkstoffen beschleunigen. Mittlerweile kann auch beispielsweise Unguentum emulsificans aquosum cum propylenglycolum als Halbfertigware bezogen werden, sodass eine Eigenherstellung der „konservierten“ Grundlage aus Einzelbestandteilen nicht nötig ist.
Konservierte Rezepturen sollen generell nicht im Kühlschrank gelagert werden, da hierdurch nicht nur Löslichkeitsprobleme auftreten können, sondern auch die Aktivität von Konservierungsmitteln deutlich herabgesetzt werden kann.
Konservierung von Augentropfen
Augentropfen in Mehrdosenbehältnissen müssen grundsätzlich konserviert werden, sofern sie nicht schon einen antimikrobiell wirksamen Stoff enthalten. Eine sehr gute Hilfestellung bietet dabei die Anlage A im DAC/NRF. Dort wird für 30 wirksame Bestandteile von Augentropfen angegeben, welches das geeignete Konservierungsmittel ist. Die Palette der angegebenen Konservierungsmittel beschränkt sich dabei auf Benzalkoniumchlorid (evtl. mit Zusatz von Na-EDTA), Chlorhexidindiacetat, verschiedene Phenylquecksilbersalze und Thiomersal. Gerade bei den Augentropfen sollte jedoch möglichst immer auf standardisierte Rezepturen zurückgegriffen werden, da hier neben pH und Konservierung auch immer die Tonizität der Zubereitung beachtet werden muss. Auch zur Auswahl des geeigneten isotonisierenden Zusatzes finden sich jedoch Hinweise in der genannten Anlage.
Neben den erwähnten Dermatika und Augentropfen gibt es natürlich in der Apothekenrezeptur weitere Darreichungsformen, die zum Teil konserviert werden müssen. Auch hier lassen sich die wichtigsten Hinweise im DAC/NRF und den Tabellen für die Rezeptur finden. An dieser Stelle würden sie jedoch den Rahmen sprengen.
Fazit
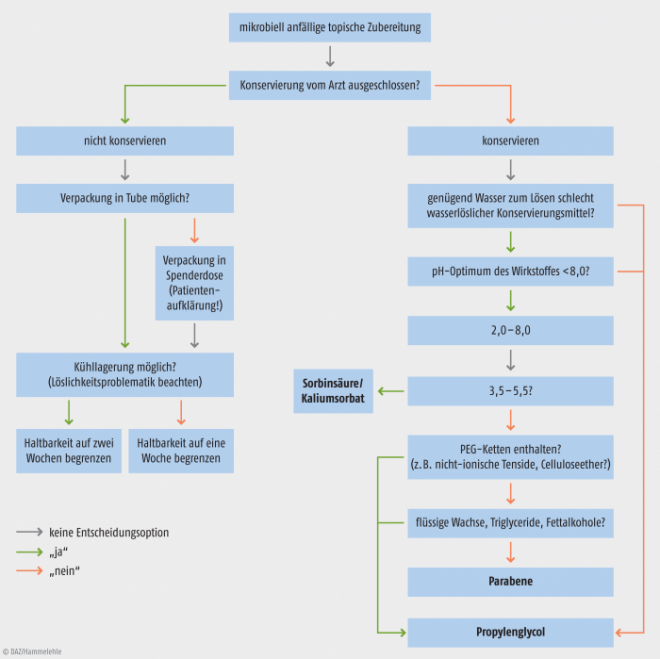
Als Fazit bleibt: Die Konservierung einer Rezeptur muss in jedem Einzelfall individuell entschieden werden; Verpackung, Verwendbarkeitsfrist und Lagerungsbedingungen müssen dabei unbedingt an die jeweilige Situation angepasst werden. Als Entscheidungshilfe für den Konservierungsmitteleinsatz in mikrobiell anfälligen topischen Zubereitungen kann die Abbildung 2 herangezogen werden.
Abb. 2: Entscheidungsbaum (stark vereinfacht), um die Vorgehensweise für eine mikrobiell anfällige Rezeptur zu veranschaulichen. Es ist natürlich auch möglich, andere Konservierungsmittel als die hier dargestellten zu verwenden.
Es ist wichtig, die bei vielen Patienten und Kunden vorhandene Skepsis gegenüber Konservierungsmitteln ernst zu nehmen. Dabei sollten jedoch auch die Argumente für eine Anwendung der Konservierungsmittel nicht außer Acht gelassen werden. |
Literatur
DAC/NRF inkl. erstem Nachtrag 2015
Europäisches Arzneibuch 8 und Nachträge
Ziegler AS. Hilfsstoffe in der Rezeptur – aporello, Deutscher Apotheker Verlag 2014
Dermatologische Rezepturen. Leitlinie der Gesellschaft für Dermopharmazie, Stand 1. April 2003
Ziegler AS. Plausibilitäts-Check Rezeptur. 3. Auflage, Deutscher Apotheker Verlag 2015.
Rezepturhinweise: Konservierung wasserhaltiger Grundlagen. Neues Rezeptur-Formularium, ABDA – Bundesvereinigung Deutscher Apothekerverbände, Pharmazeutisches Laboratorium, Govi-Verlag Pharmazeutischer Verlag GmbH, Stand 1. Juli 2014
Rezepturhinweise: Aufbewahrung von Rezepturen im Kühlschrank. Neues Rezeptur-Formularium, ABDA – Bundesvereinigung Deutscher Apothekerverbände, Pharmazeutisches Laboratorium, Govi-Verlag Pharmazeutischer Verlag GmbH, Stand 1. Juli 2014
Rezepturhinweise: PHB-Ester. Neues Rezeptur-Formularium, ABDA – Bundesvereinigung Deutscher Apothekerverbände, Pharmazeutisches Laboratorium, Govi-Verlag Pharmazeutischer Verlag GmbH, Stand 1. Juli 2014
Rezepturhinweise: Propylenglycol. Neues Rezeptur-Formularium, ABDA – Bundesvereinigung Deutscher Apothekerverbände, Pharmazeutisches Laboratorium, Govi-Verlag Pharmazeutischer Verlag GmbH, Stand 29. November 2006
Wolf G. Rezepturen – Probleme erkennen, lösen, vermeiden. 4. Auflage, Deutscher Apotheker Verlag 2013
Tabellen für die Rezeptur – Plausibilitätsprüfung in der Apotheke. 8. Auflage 2015 Verwendung von Parabenen in kosmetischen Mitteln. Stellungnahme Nr. 009/2011 des Bundesinstitut für Risikobewertung (BfR) vom 28. Januar 2011
Wirkstoffdossiers für externe dermatologische Rezepturen. Gesellschaft für Dermopharmazie, Stand 19. November 2009
Danksagung
Vielen Dank an Frau Regina Krehl für die großartige Unterstützung bei der Durchführung der Keimzahlbestimmungen.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.