
- DAZ.online
- DAZ / AZ
- DAZ 42/2015
- Falsch kopiert, sofort ...
Wissenschaft
Falsch kopiert, sofort korrigiert
Chemie-Nobelpreis für die Erforschung der Fehlerkorrektur im Erbgut

Kopieren und variieren
Alles könnte so einfach sein, denn die Basis allen Lebens liegt im Kopieren. Im Abschreiben also, das, wenn sorgfältig durchgeführt, zumindest theoretisch fehlerlos möglich sein sollte. Und dennoch passieren Fehler. Dies lässt sich leicht zeigen, wenn man in einem Experiment einer Schar von Menschen nacheinander einen Text zum Kopieren vorlegt, um dann staunend festzustellen, wie sich bereits nach wenigen Runden der Text zu verändern beginnt. Aber wer kopiert schon noch per Hand? So ist ein vielleicht realistischeres Beispiel in der heutigen Zeit ein Warnhinweis auf dem Bildschirm eines Computers, der andeutet, dass bei der Verifizierung eines Kopiervorgangs ein Fehler entdeckt wurde. Somit erweist sich also nicht nur der Mensch als unpräziser Kopierer. Auch ausgeklügelte Maschinen machen Fehler. Ja selbst die im Laufe der Evolution immer weiter perfektionierte Biologie ist nicht fehlerfrei. Und wäre das nicht schon Problem genug, ist es auch möglich, Fehler in der Replikationsmaschinerie geradezu heraufzubeschwören. Das passiert dann, wenn wir uns leichtfertig toxischen Agenzien gegenüber exponieren, die chemischer wie physikalischer Natur sein können und unsere DNA so verändern, dass in der nächsten Kopierrunde ein Fehler unvermeidbar ist.
Preiswürdige Reparaturen
Paradoxerweise kann das auch sein Gutes haben. Denn durch eine evolutionäre Brille betrachtet, sind Mutationen die Treiber für biologische Vielfalt. Aus der Sicht des Individuums hingegen sind Mutationen die Katastrophen schlechthin, mit denen der Organismus unglücklicherweise tagtäglich zig Mal konfrontiert ist. Zum Glück gibt es da so etwas wie ein „Lektorat“, das nicht nur ständig den Informationsgehalt in einer Zelle nach Fehlern absucht, sondern das auch darauf spezialisiert ist, diese zu korrigieren. Diese Mechanismen, genauer die „base excision repair“, die „nucleotide excision repair“ und die „mismatch repair“ wurden maßgeblich von den drei Nobel-Laureaten aufgeklärt, ein Wissen, das heute weit in die moderne Medizin hineinreicht.
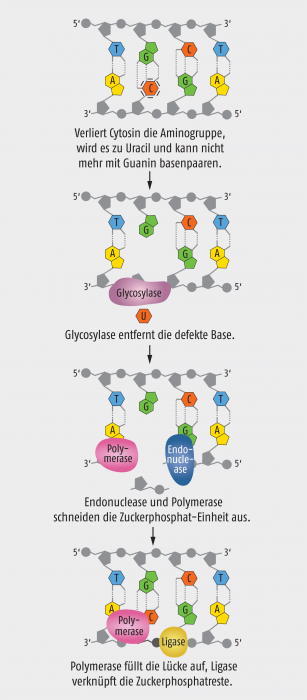
Abb. 1: Schema der Basenexzisions-Reparatur am Beispiel eines desaminierten Cytosins (mod. nach The Royal Swedish Academy of Sciences).
Basenexzisions-Reparatur
Der Schwede Tomas Lindahl suchte in Bakterienkulturen nach DNA-Reparaturmechanismen. Ihm gelang es, ein Reparatursystem zu charakterisieren, das ständig die DNA nach kleinen Fehlern in den Nucleobasen, beispielsweise ein desaminiertes Cytosin, absucht. Wird dieses System fündig, induziert es einen Mechanismus, den Lindahl „Basenexzisions-Reparatur“ (base excision repair, BER) taufte. Dieser beruht auf Enzymen, den sogenannten DNA-Glycosylasen, die die fehlerhafte Base von dem Desoxyribose-Rest trennen und somit eine Markierung setzen, um die nun sehr auffällige Fehlerstelle zu korrigieren. Allerdings verfügen nicht nur Bakterien über diese Art Reparatursystem, sondern auch Säugetiere. Zudem kommen Glycosylasen vor, die neben desaminiertem Cytosin (= Uracil) auch andere Basen aus der DNA schneiden können. Ist die fehlerhafte Base entfernt, bleibt das Enzym noch an der DNA gebunden, bis sich die Apurin-/Apyrimidin-Endonuclease einfindet und das DNA-Rückgrat öffnet (Abb. 1). Sobald die Endonuclease ihren Job erledigt hat, kann die DNA-Polymerase aktiv werden, die einerseits die basenlose Zuckerphosphat-Einheit ausschneidet und andererseits ein neues, richtiges Nucleotid einfügt. Zum Schluss schließt eine DNA-Ligase wieder den DNA-Strang.
Mismatch-Reparatur
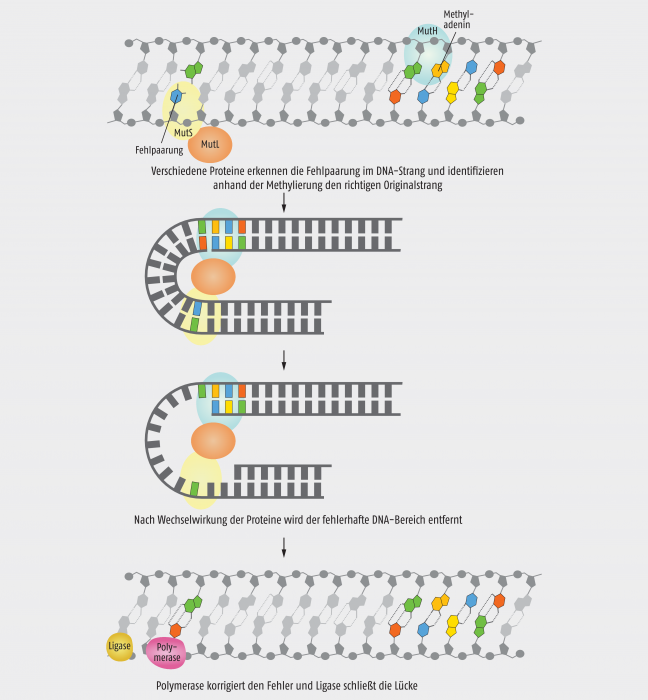
Während der Replikation kommt es immer wieder zum Einbau falscher Nucleotide. Zwar kontrolliert die DNA-Polymerase eigentlich ihre eigene Arbeit, aber in seltenen Fällen bleibt doch ein falsches Nucleotid im neu synthetisierten Strang zurück. Natürlich kann die Base dann mit ihrem Gegenüber nicht die korrekten Wasserstoffbrücken ausbilden. Diesen „Mismatch“ erkennen und reparieren verschiedene Enzyme, die der Amerikaner Paul Modrich zunächst in Escherichia coli identifiziert und später auch analog in Säugetierzellen fand. In Bakterien sind die Enzyme mit den Kürzeln MutS, MutL und MutH daran beteiligt, einerseits die fehlerhafte Basenpaarung im DNA-Doppelstrang zu entdecken und andererseits den Matrizenstrang anhand der Basenmethylierung zu identifizieren. Durch die Interaktion der drei Proteine wird die MutH-Endonuclease aktiviert und schneidet den neusynthetisierten Strang (Abb. 2). Mithilfe einer Helicase werden die beiden Stränge bis zur Bindestelle von MutS getrennt und das fehlerhafte Stück ausgeschnitten. Erneut kommt eine Polymerase sowie eine Ligase ins Spiel, um den DNA-Strang korrekt fertigzustellen.
Abb. 2: Schema der Mismatch-Reparatur [mod. nach The Royal Swedish Academy of Sciences].
Nucleotidexzisions-Reparatur
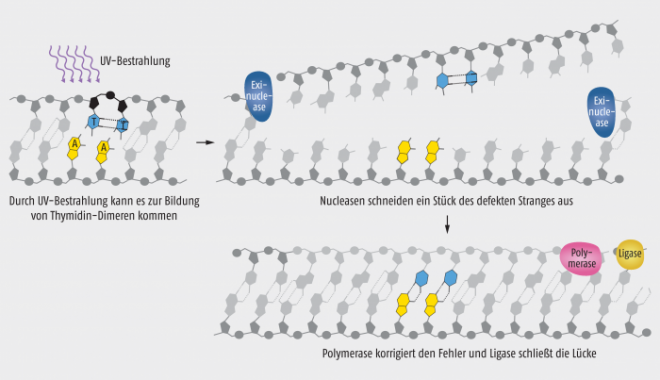
Ein ähnlich klingender und doch etwas anders verlaufender Reparaturmechanismus ist die „Nucleotidexzisions-Reparatur (nucleotide excision repair, NER)“, für die der in der Türkei geborene Aziz Sancar geehrt wurde. Auch diese Reaktion wurde zunächst in Bakterien untersucht, aber später ebenfalls in Säugetieren gefunden. Dieser Reparaturmechanismus übernimmt die wichtige Aufgabe, die durch UV-Licht induzierten Thymidin-Dimere zu eliminieren. Die Mutation ändert – falls sie nicht repariert wird – die räumliche Struktur des DNA und würde Transkription und Replikation stören. Deshalb ist die Reparatur dieser Stelle extrem wichtig. In den verschiedenen Organismen sind sehr unterschiedliche Enzyme beteiligt. Das Prinzip blieb jedoch im Laufe der Evolution erhalten: Nach dem Erkennen der veränderten DNA-Struktur am Thymidin-Dimer schneiden Nucleasen 12 bis 13 Nukleotide des mutierten DNA-Strangs aus (Abb. 3). Auch bei diesem Mechanismus wird eine Polymerase zum Wiederauffüllen der entstandenen Lücke benötigt sowie eine Ligase, die final das Zuckerphosphat-Rückgrat schließt.
Abb. 3: Schema der Nucleotidexzisions-Reparatur [mod. nach The Royal Swedish Academy of Sciences].
Ein Nobelpreis für DNA-Reparaturmechanismen
Drei Wissenschaftler wurden für ihre Leistungen bei der Aufklärung wichtiger DNA-Reparaturmechanismen mit dem Nobelpreis geehrt. Nur drei Wissenschaftler können den Preis erhalten – das geben die Vergabestatuten so vor. Sicherlich war die Auswahl dieser Preisträger nicht leicht, denn wie schon allein aus der wissenschaftlichen Begleitinformation der königlich-schwedischen Akademien der Wissenschaften herauszulesen ist, waren noch etliche andere Forscher ebenfalls an der Aufklärung dieser Mechanismen beteiligt.
Pharmazie im Fokus
Die diesjährigen Nobelpreise für Medizin und Chemie wurden wenig überraschend für sehr unterschiedliche Leistungen vergeben. Im Fokus des Nobelpreises für Medizin stand eine sehr praxisrelevante Naturstoffforschung, und der Nobelpreis für Medizin ging an Wissenschaftler, die sich mit den Grundlagen der biochemischen Fehlerkorrektur befasst haben. Beide Gebiete sind jedoch auch von maßgeblicher pharmazeutischer Relevanz, da sie zum einen die Basis für lebensrettende Medikamente, zum anderen für wichtige Strategien in der Behandlung bestimmter Erbkrankheiten und fast aller Tumore bilden. |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.