
- DAZ.online
- DAZ / AZ
- DAZ 42/2015
- Das unterschätzte ...
Medizin
Das unterschätzte Stolpern
Vorhofflimmern ist keine harmlose Störung
Vorhofflimmern ist mit rund einer Million Patienten allein in Deutschland die mit Abstand häufigste Herzrhythmusstörung. Mit steigendem Alter erhöht sich die Wahrscheinlichkeit, an dieser Form einer supraventrikulären Tachyarrhythmie zu erkranken (Definition s. Kasten „Herzrhythmusstörungen“). Von den über 60-Jährigen sind zwei bis fünf Prozent betroffen, von den über 75-Jährigen bereits etwa 15 Prozent. Da die Menschen zunehmend ein höheres Lebensalter erreichen, wird die Häufigkeit des Vorhofflimmerns mitsamt seinen Komplikationen in den nächsten Jahren zunehmen.
Herzrhythmusstörungen: Woher? Wie schnell? Wie gefährlich?
Vor allem beim ersten Auftreten einer Herzrhythmusstörung ist schnellstmöglich zu prüfen, ob auch eine Kreislaufinstabilität besteht oder droht. Ansonsten werden Herzrhythmusstörungen für eine erste Orientierung in der Regel nach zwei Kriterien unterteilt:
- Geschwindigkeit: bradykarde (Puls unter 60/min) oder tachykarde Rhythmusstörung (Puls über 100/min)
- Entstehungsort: Vorhof (Atrium), Kammer (Ventrikel), Ort der Erregungsbildung (Sinusknoten) oder Erregungsleitungssystem (atrioventrikulärer Knoten, AV-Knoten)
Eine tachykarde arrhythmische Herzaktion, die nicht von den Kammern, sondern von den Vorhöfen ausgeht, bezeichnet man als supraventrikuläre Tachyarrhythmie, weil die Vorhöfe über den Kammern liegen. Zu den supraventrikulären Tachyarrhythmien wird auch das Vorhofflimmern gezählt, obwohl dieses auch einmal mit einem bradykarden Puls einhergehen kann.
Beim Vorhofflimmern „dimmt“ der AV-Knoten meistens die zu schnelle Vorhoferregung (300 – 600/min) zu einem langsameren tachykarden Kammerrhythmus (100 – 150/min), sodass die Kontraktionen noch hämodynamisch wirksam sind.
Dagegen ist das Kammerflimmern mit ungeordneten Flimmerwellen (300 – 800/min) akut lebensbedrohlich, weil die Pumpleistung des Herzmuskels abrupt auf null sinkt, was klinisch einem Kreislaufstillstand entspricht.
Tachyarrhythmia absoluta
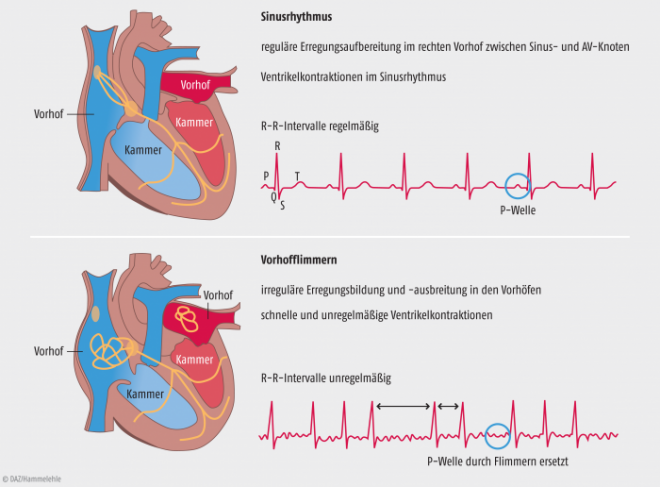
Beim Vorhofflimmern besteht kein normaler Sinusrhythmus mehr, vielmehr ziehen sich die beiden Vorhöfe (Atrien) des Herzens nur noch unkoordiniert mit einer Frequenz von 300 bis 600 Schlägen pro Minute zusammen. Aufgrund der Filterfunktion des AV-Knotens, der die Herzerregung von den Vorhöfen auf die Kammern (Ventrikel) überleitet, kommt dort nur ein Teil dieser elektrischen Impulse an – allerdings fast immer in unregelmäßigen Abständen. Resultat ist ein entsprechend unregelmäßiger ventrikulärer Herzschlag zwischen 100 und 150 Schlägen, bei jüngeren Patienten auch einmal bis zu 200 Schlägen pro Minute. Klinisch spricht man bei Vorhofflimmern von einer absoluten Arrhythmie oder einer Tachyarrhythmia absoluta. Im EKG zeigt sich die absolute Arrhythmie in einem unregelmäßigen R-R-Intervall (s. Abb. 1).
Abb. 1: Sinusrhythmus und Vorhofflimmern im EKG. Statt der P-Wellen, die im Sinusrhythmus eine normale Vorhofaktion anzeigen (oben), sieht man beim Vorhofflimmern Flimmerwellen mit erheblichen Schwankungen der Frequenz, Amplitude und Morphologie. Die daraus resultierenden unregelmäßigen (arrhythmischen) Ventrikelkontraktionen erkennt man an den unregelmäßigen Abständen der QRS-Komplexe („Kammerkomplexe“) bzw. an den unregelmäßigen R-R-Intervallen.
Kreisende Erregung
Das Vorhofflimmern selbst entsteht durch eine ungeordnet kreisende elektrische Erregung (Reentry). Die Störung geht hierbei nicht vom Sinusknoten aus, sondern liegt in Vorhofarealen (nicht selten im Mündungsbereich der Pulmonalvenen), in denen es zu ektopen irregulären Schrittmacheraktivitäten kommen kann. Ein solches Aktionspotenzial kann ein angrenzendes Areal nicht aktivieren, solange sich dessen Zellen noch in der sogenannten Refraktärperiode befinden. Nimmt es jedoch einen anderen Weg und trifft dadurch auf elektrisch bereits wieder erregbares Gewebe, wird dieses noch vor dem Eintreffen des regulären Sinusknotenimpulses vorzeitig, also „fälschlich“ aktiviert. Durch die abnorme Weiterleitung von Aktionspotenzialen zwischen verschiedenen Vorhofarealen entsteht eine kreisende Erregung, im ungünstigen Fall bestehen sogar mehrere instabile Reentry-Kreisläufe („multiple wavelet“) gleichzeitig.
Triggerfaktoren
Für die Pathogenese des Vorhofflimmerns sind nicht nur verschiedene, den regulären Herzrhythmus beeinträchtigende Triggerfaktoren von Bedeutung, sondern auch das Vorhofgewebe selbst, indem es strukturell zur Aufrechterhaltung der Störung beiträgt. Als auslösende Trigger kommen infrage:
- Vorhofstimulation durch Sympathikus oder Parasympathikus,
- bradykarder oder tachykarder Herzrhythmus, Extrasystolen,
- akzessorische (irreguläre) Leitungsbahnen für die Herzerregung,
- Dehnung des Vorhofgewebes,
- sogenannte ektope Foci („unerwünschte“ arrhythmogene Punkte im Vorhof).
Diese auslösenden Mechanismen können vor allem durch kardiovaskuläre Erkrankungen begünstigt werden, etwa durch arterielle Hypertonie, koronare Herzkrankheit, Myokardinfarkt, Myokarditis und Klappenvitien (bei einer Mitralstenose ca. achtfach erhöhtes Risiko).
Extrakardial zu berücksichtigen sind eine Hyperthyreose, Alkoholabusus („holiday heart syndrome“), diagnostische Eingriffe wie eine Bronchoskopie und schließlich Substanzen mit arrhythmogenem Potenzial, z. B. Thyroxin, Theophyllin, Sildenafil, Fluoxetin, Betasympathomimetika). Ausdauersportler wie Marathonläufer oder Radrennfahrer haben ein etwa zwei- bis dreifach erhöhtes Risiko, an einem Vorhofflimmern zu erkranken.
Allerdings können insbesondere jüngere Patienten auch ohne nachweisbare Ätiologie von einer „lone atrial fibrillation“ betroffen sein. Diese idiopathische Form betrifft mindestens 20 bis 25 Prozent aller Fälle mit Vorhofflimmern, gelegentlich lässt sich eine familiäre Disposition nachweisen.
Beschwerden individuell unterschiedlich
Nach den aktuellen Leitlinien kann Vorhofflimmern nach zwei Kriterien klassifiziert werden, zum einen nach seiner Dauer und zum anderen nach der ausgelösten klinischen Symptomatik. Die erstgenannte Einteilung ergänzt das bisherige Schema paroxysmal – persistierend – permanent um zwei neue Entitäten (s. Tab. 1). Hintergrund ist der Anspruch, mit neuen therapeutischen Optionen auch ein schwer therapierbares „lange anhaltendes persistierendes Vorhofflimmern“ zumindest für einige Zeit erfolgreich rhythmuserhaltend behandeln zu können.
Typ |
Auftreten und Dauer |
|---|---|
erstmalig diagnostiziertes Vorhofflimmern |
erste wahrgenommene und/oder diagnostizierte Episode; kann der Beginn jeder der nachfolgend genannten Formen sein, die dann oft schwierig voneinander abzugrenzen sind |
paroxysmales Vorhofflimmern |
binnen 48 Stunden bis maximal 7 Tagen selbst limitierendes Vorhofflimmern; wird am ehesten als „Anfall“ wahrgenommen |
persistierendes Vorhofflimmern |
anhaltendes, nicht selbstlimitierendes Vorhofflimmern, das (in einer gemeinsamen Entscheidung von Arzt und Patient) therapeutisch in einen normalen Sinusrhythmus überführt sowie rhythmuserhaltend behandelt werden soll |
lange anhaltendes persistierendes Vorhofflimmern |
länger als 1 Jahr kontinuierlich bestehendes Vorhofflimmern, das jetzt dennoch (erneut?) therapeutisch angegangen werden soll |
permanentes Vorhofflimmern |
therapieresistentes akzeptiertes Vorhofflimmern, dessen Fortbestehen nicht mehr verhindert werden soll |
Nicht immer gelingt eine zuverlässige klinische Einschätzung des Vorhofflimmerns, da die individuell wahrgenommenen Beschwerden eine große Variabilität aufweisen können. Typische durch Vorhofflimmern ausgelöste Symptome sind Palpitationen („Herzklopfen“), thorakaler Schmerz oder „Organgefühl“, Atemnot, Schwindel, Müdigkeit, eingeschränkte Belastbarkeit und Angst. Im Einzelfall kann die Lebensqualität des Betroffenen stark vermindert sein. Gibt der Betroffene Beschwerden an, sollte in jedem Fall nach ihrer Häufigkeit gefragt werden, nämlich
- selten (weniger als einmal im Monat),
- intermediär (zwischen einmal monatlich und beinahe täglich),
- häufig (mindestens täglich auftretend).
Analog zur bekannten Einteilung der Herzinsuffizienz nach NYHA (New York Heart Association) kann für Vorhofflimmern orientierend das einfache Schema der European Heart Rhythm Association angewandt werden (EHRA-Score):
- EHRA I: Der Patient nimmt keine Beschwerden wahr.
- EHRA II: Der Patient hat milde Beschwerden, ist in seiner normalen täglichen Aktivität jedoch nicht eingeschränkt.
- EHRA III: Der Patient gibt schwere Beschwerden an, die seine normale tägliche Aktivität einschränken.
- EHRA IV: Der Patient wird durch massive Beschwerden derart behindert, dass eine normale tägliche Aktivität unmöglich ist.
Atriales Remodelling
Vorhofflimmern ist eine progrediente Erkrankung. 20 Jahre nach der Erstdiagnose leiden rund 90 Prozent der Betroffenen an einem permanenten Vorhofflimmern. Ausgehend von rezidivierenden Flimmerepisoden vollziehen sich im Laufe der Zeit im Vorhofgewebe funktionelle und strukturelle Veränderungen. Dieses „atriale Remodelling“ wiederum erhöht die Anzahl der Flimmerepisoden und verlängert deren Dauer, sodass sich mehr und mehr ein permanentes Vorhofflimmern ausbildet.
Bei rezidivierend hohen Frequenzen steigt der Calciumgehalt der atrialen Myokardzellen (Vorhofzellen) deutlich an, mittelfristig kommt es daher zu einer verminderten Calciumaufnahme der Zellen. Dadurch verkürzen sich die Aktionspotenziale der Erregungsleitung einschließlich der zellulären Refraktärzeiten. Die schnellere Erregbarkeit der betroffenen Vorhofzellen wiederum fördert die Entstehung und Aufrechterhaltung von Reentry-Kreisläufen.
Weiterhin verringert die gestörte Calciumhomöostase die Kontraktilität der Myofilamente der Vorhofzellen. Folge ist eine verminderte bis aufgehobene Vorhofkontraktion, die den Blutfluss erheblich verlangsamt oder sogar sistieren lässt. Einerseits steigt hierdurch das Risiko für die Ausbildung kardialer Thromben, insbesondere im linken Herzohr, andererseits induziert die Hypokontraktilität eine Fibrosierung des Vorhofgewebes mit den typischen histologischen Veränderungen.
Drohende Herzinsuffizienz
Hämodynamisch wirkt sich bei einer absoluten Arrhythmie nicht nur die eingeschränkte oder aufgehobene synchrone Vorhofaktivität auf die kardiale Auswurfleistung aus, sondern auch die oft inadäquat hohe Kammerfrequenz:
Bei ansonsten Herzgesunden ist das Herzzeitvolumen bei Vorhofflimmern um zehn bis 15 Prozent vermindert, was von den Betroffenen meist nicht oder kaum bemerkt wird. Demgegenüber kann der „cardiac output“ bei Patienten mit bereits bestehender Linksherzinsuffizienz um bis zu 40 Prozent zurückgehen, was meist zu einer deutlichen Verschlechterung der Belastbarkeit führt.
Durch den schnellen und irregulären ventrikulären Rhythmus verkürzt sich vor allem die Diastole. Da sich die Koronararterien hauptsächlich in der Diastole füllen, reduziert eine verkürzte Diastole die koronare Sauerstoffversorgung des Myokards.
Ständig erhöhte Kammerfrequenzen über 130/min sind für das Herz auf Dauer nicht ökonomisch, da der myokardiale Sauerstoffverbrauch hierdurch inadäquat steigt. Als Folge kann sich eine Tachykardiomyopathie entwickeln. Echokardiografisch einer dilatativen Kardiomyopathie ähnlich, vergrößert sich dabei vor allem der linke Ventrikel, ohne dass es zu einer Dickenzunahme des Herzmuskels kommt. Die systolische Auswurfleistung sinkt weiterhin, längerfristig droht eine dekompensierte Herzinsuffizienz.
Erhöhtes Schlaganfallrisiko
Durch die Neigung zur Thrombenbildung in den Vorhöfen bzw. im linken Herzohr haben Patienten mit Vorhofflimmern ein deutlich erhöhtes Risiko, einen kardiogenen thromboembolischen Schlaganfall zu erleiden. Das Schlaganfallrisiko steigt bereits, wenn das Vorhofflimmern länger als 48 Stunden besteht. Man geht davon aus, dass in Deutschland etwa 20 Prozent aller Schlaganfälle auf Vorhofflimmern zurückgeführt werden können. In seltenen Fällen kann es auch zu einem Mesenterialinfarkt durch Verschluss eines Darmgefäßes kommen. Besonders hoch ist das Embolierisiko bei permanentem Vorhofflimmern, vor allem wenn zusätzliche Risikofaktoren bestehen.
Eine orale Antikoagulation kann nach derzeitiger Datenlage etwa zwei Drittel dieser ischämischen Schlaganfälle verhindern; im Vergleich dazu erweist sich die antithrombotische Wirksamkeit von Acetylsalicylsäure als deutlich schwächer. Um das individuelle Schlaganfallrisiko abzuschätzen und die Entscheidung zur Antikoagulation zu untermauern, wird empfohlen, den CHADS2 - oder CHA2DS2 -VASc-Score anzuwenden, in dem sechs bis acht leicht erfassbare Risikofaktoren berücksichtigt werden (Tab. 2). Nach den Empfehlungen der European Society of Cardiology (ESC) sollen alle Patienten mit einem CHA2DS2 -VASc-Score von 2 oder mehr eine orale Antikoagulation erhalten.
Risikofaktor |
CHADS2-Score
|
CHA2DS2VASc-Score
|
|---|---|---|
C chronische Herzinsuffizienz oder linksventrikuläre Dysfunktion |
1 |
1 |
H Hypertonie |
1 |
1 |
|
A / A2 Alter 65 – 74 Jahre
Alter ≥ 75 Jahre |
0
1
|
1
2
|
D Diabetes mellitus |
1 |
1 |
|
S2 Zustand nach Thromboembolie, Schlaganfall oder transitorischer ischämischer Attacke (TIA)
|
2 |
2 |
V vaskuläre Vorerkrankung |
0 |
1 |
Sc weibliches Geschlecht |
0 |
1 |
Summe: maximale Punktzahl |
6 |
9 |
Antikoagulation versus Blutungsgefahr
Zur Auswahl stehen aufgrund verfügbarer klinischer Langzeitdaten erwartungsgemäß zunächst die „klassischen“ Vitamin-K-Antagonisten vom Cumarintyp, deren Dosierung an einen INR-Bereich zwischen 2,0 und 3,0 angepasst sein soll. Allerdings sollte vor Therapiebeginn ein mögliches Blutungsrisiko abgeklärt werden. Hierfür dient ein neuer benutzerfreundlicher Risikoscore, der HAS-BLED-Score (s. Tab. 3), mit dessen Hilfe nicht zuletzt eventuell reversible Blutungsrisikofaktoren korrigiert werden können. Bei Patienten mit einem HAS-BLED-Score von ≥ 3 werden sowohl eine vorsichtige Antikoagulation als auch eine regelmäßige Neubewertung der klinischen Situation empfohlen.
Risikofaktor |
Punktzahl |
|---|---|
H arterielle Hypertonie |
1 |
A abnormale Leberfunktion (Gerinnungsstörung!) und/oder dialysepflichtige Einschränkung der Nierenfunktion |
1
1
|
S Zustand nach Schlaganfall |
1 |
B vorherige Blutung |
1 |
L labile INR (falls Therapie mit Vitamin-K-Antagonisten) |
1 |
E Alter („elderly“) |
1 |
D Drogen, Medikamente (v. a. ASS und nichtsteroidale Antiphlogistika) und/oder Alkoholabusus |
1
1
|
Summe: maximale Punktzahl |
9 |
Neue orale Antikoagulanzien
In verschiedenen Studien (z. B. der RELY-Studie) zeigte sich, dass die sogenannten neuen oralen Antikoagulanzien den Vitamin-K-Antagonisten nicht unterlegen, teilweise (allerdings in höherer Dosierung) sogar überlegen waren, was eine niedrigere Schlaganfallrate bei Patienten mit Vorhofflimmern betraf. Daher werden die folgenden Substanzen für Patienten mit einem CHA2DS2-VASc-Score ≥ 2 in den Leitlinien ebenfalls empfohlen:
- der direkte Thrombininhibitor Dabigatran in einer Dosierung von 2 × 150 mg täglich,
- orale Faktor-Xa-Inhibitoren wie Apixaban oder Rivaroxaban, Letzterer in einer Dosierung von 1 × 20 mg pro Tag.
Bei einem HAS-BLED-Score ≥ 3, moderater Niereninsuffizienz und bei hohem Lebensalter über 80 Jahren sollten allerdings niedrigere Dosierungen gewählt werden. In Bezug auf unerwünschte Blutungskomplikationen bei beiden Substanzgruppen gibt es derzeit noch keine eindeutigen Studien- oder Falldaten, geschweige Langzeitdaten. Aktuell wurde eine Studie veröffentlicht, in der der Antikörper Idarucizumab die gerinnungshemmende Wirkung von Dabigatran innerhalb von Minuten aufhob – allerdings war mangels einer Kontrollgruppe der klinische Nutzen dieses Antidoteffekts noch nicht abschätzbar.
Medikamentöse Frequenzkontrolle
Für die Behandlung der tachyarrhythmischen Situation bei Vorhofflimmern stehen zwei Strategien zur Verfügung:
- Frequenzkontrolle: medikamentöse Normalisierung oder zumindest Reduzierung der Kammerfrequenz,
- Rhythmuskontrolle: medikamentöse oder Elektrokardioversion mit dem Ziel, wieder einen regulären Sinusrhythmus zu erreichen.
Zur akuten wie langfristigen Frequenzkontrolle können bei ansonsten stabilen Patienten Betarezeptorenblocker oder Calciumantagonisten vom Nicht-Dihydropyridin-Typ (Verapamil, Diltiazem) verabreicht werden – wegen der Gefahr eines AV-Blocks allerdings nie kombiniert. Als Ziel sollte zunächst eine Kammerfrequenz in Ruhe unter 110/min angestrebt werden. Bei persistierenden klinischen Symptomen sollte dann eine striktere Kontrolle verfolgt werden, nämlich unter 80/min in Ruhe und unter 110/min bei moderater Belastung. In einer aktuellen amerikanischen Studie erreichten nach 30 Minuten unter Diltiazem 95,8 Prozent der Patienten mit Vorhofflimmern die Zielfrequenz unter 100/min, unter Metoprolol waren es nur 46,4 Prozent. Für herzinsuffiziente Patienten werden als Alternativen Amiodaron oder Digitalispräparate empfohlen, Letztere bei paroxysmalem Vorhofflimmern allerdings nicht zur Monotherapie.
Konversion in den Sinusrhythmus
Vieles spricht dafür, dass die medikamentöse Kardioversion am effektivsten ist, wenn sie innerhalb von sieben Tagen nach Auftreten der Tachyarrhythmia absoluta begonnen wird. Dann stehen die Chancen relativ gut, denn bei 50 bis 70 Prozent der Patienten kann ein regulärer Sinusrhythmus wiederhergestellt werden. Voraussetzung für diese Therapieoption ist, dass der Patient hämodynamisch stabil ist.
Welches Antiarrhythmikum (s. Tab. 4) intravenös zum Einsatz kommen soll, hängt in erster Linie davon ab, ob eine kardiale Grunderkrankung vorliegt, etwa eine Herzinsuffizienz oder koronare Herzkrankheit:
- keine strukturelle Herzerkrankung: Flecainid, Propafenon, Vernakalant,
- moderate Herzerkrankung: Vernakalant,
- schwere Herzerkrankung: Amiodaron.
Arzneistoff |
Dosierung |
Risiken; Kontraindikationen |
|---|---|---|
Flecainid |
2 mg/kg KG i. v. über 10 min
alternativ: 200 – 300 mg p. o.
|
Hypotonie; nicht bei Herzinsuffizienz, KHK und Myokardinfarkt |
Propafenon |
2 mg/kg KG i. v. über 10 min
alternativ: 450 – 600 mg p. o.
|
Hypotonie; nicht bei Herzinsuffizienz, KHK und Myokardinfarkt |
Vernakalant |
3 mg/kg KG i. v. über 10 min, nach 15 min 2. Infusion mit 2 mg/kg KG i. v. über 10 min |
nicht bei Hypotonie und Herzinsuffizienz NYHA III oder IV, Vorsicht bei Herzinsuffizienz NYHA I und II |
Amiodaron |
5 mg/kg KG i. v. über 1 Std., anschließend 50 mg/Std. |
Hypotonie und Bradykardie, schwere (z. B. pulmonale) Nebenwirkungen. Applikation wegen komplexer Wirkungsweise und langer Halbwertszeit nur unter stationärer Kontrolle |
Sehr rasch scheint Vernakalant zu wirken. In einer Studie mit 254 Patienten mit symptomatischem Vorhofflimmern, darunter viele mit struktureller Herzerkrankung, wurden Amiodaron und Vernakalant direkt miteinander verglichen. Das Studienziel, eine Konversion in den Sinusrhythmus nach 90 Minuten, erreichten 51,7 Prozent der Patienten unter Vernakalant, aber nur 5,2 Prozent unter Amiodaron.
Elektrische Kardioversion
Wenn das verabreichte Medikament die erhöhte Kammerfrequenz nicht rasch senkt, sollte eine sofortige elektrische Kardioversion durchgeführt werden. Eine weitere Indikation besteht in neu aufgetretenem Vorhofflimmern, das mit einer hämodynamischen Instabilität einhergeht und im Einzelfall eine kardiale Notfallsituation bedeuten kann.
Bei der elektrischen Kardioversion wird mittels eines Stromstoßes, der durch zwei Elektroden abgegeben wird, die Aktivität der Herzmuskelzellen synchronisiert. Dies verhindert eine weitere unkontrollierte Erregungsbildung und ermöglicht die Wiederaufnahme eines geordneten, vom Sinusknoten ausgehenden Herzrhythmus. Unter intravenöser Kurznarkose (Propofol) wird in der Regel mit einem 200-Joule-Schock begonnen, wobei die antero-posteriore Elektrodenposition wirksamer ist als die antero-laterale. Im Gegensatz zur Defibrillation wird der Schock EKG-getriggert ausgelöst, d. h. der Impuls der noch synchron arbeitenden Herzmuskelzellen wird erkannt, was das Risiko für das Auftreten von Kammerflimmern reduziert.
Verschiedene Daten erlauben den Schluss, dass eine Vorbehandlung mit Flecainid, Propafenon oder Amiodaron die Effektivität der elektrischen Kardioversion erhöht und die Häufigkeit von Vorhofflimmerrezidiven senkt.
Rhythmuserhaltende Maßnahmen
Die Rezidivrate nach elektrischer Kardioversion beträgt etwa 30 Prozent nach einer Woche und bis zu 75 Prozent nach einem Jahr. Daher sollte eine medikamentöse Rezidivprophylaxe durchgeführt werden. Allerdings spricht die klinische Erfahrung dafür, dass die Wirksamkeit von Antiarrhythmika zum Erhalt des Sinusrhythmus eher moderat ist und eher zu einer Reduktion als zu einer vollständigen Vermeidung von Vorhofflimmerepisoden führt. Bei Patienten ohne strukturelle Herzerkrankung sind Dronedaron, Flecainid, Propafenon und Sotalol die Antiarrhythmika der ersten Wahl. Amiodaron ist zur rhythmuserhaltenden Behandlung zwar effektiver als die genannten Substanzen, sollte aber aufgrund der höheren Toxizität nur als Alternative bei Therapieversagen eingesetzt werden. Demgegenüber wird Amiodaron zur Rezidivprophylaxe bei Patienten mit Herzinsuffizienz ausdrücklich empfohlen.
Eine Alternative ist die interventionelle Katheterablation, deren Zahl in den letzten Jahren in Europa und den USA deutlich zunahm. Durch diesen Eingriff – mittels Radiofrequenzstrom oder als Kryotherapie – sollen vor allem an den Ostien der Pulmonalvenen diejenigen atrialen Zellstrukturen zerstört werden, die für die Entstehung des Vorhofflimmerns verantwortlich gemacht werden. Es ist noch strittig, inwieweit sich mit der Katheterablation die Morbidität und Mortalität oder auch die Schlaganfallrate senken lassen.
Derzeit wird die Katheterablation in erster Linie für Patienten empfohlen, die an einem paroxysmalen Vorhofflimmern ohne strukturelle Herzerkrankung leiden und bei denen die medikamentösen rhythmuserhaltenden Maßnahmen keinen dauerhaften Erfolg zeigten. |
Literatur
[1] Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e. V. Leitlinien für das Management von Vorhofflimmern. Update 2012
[2] Kirchhof P, et al. Kommentar zu den Leitlinien der ESC zum Vorhofflimmern. Kardiologe 2012;6:12-27
[3] Rienstra M, et al. Symptoms and Functional Status of Patients With Atrial Fibrillation. Circulation 2012;125:2933-2943
[4] Vorhofflimmern. In: Herold G, et al. Innere Medizin, 2014:287-290
[5] www.vhf-portal.de/VHF-Portal/Vorhofflimmern
[6] Trappe HJ. Vorhofflimmern – Gesichertes und Neues. Dtsch Arztebl 2012;109(1-2):1-7
[7] Fromm C, et al. Diltiazem vs. metoprolol in the management of atrial fibrillation or flutter with rapid ventricular rate in the emergency department. J Emergency Med 2015;49:175–182
[8] Camm AJ, et al. A randomized active-controlled study comparing the efficacy and safety of vernakalant to amiodarone in recent-onset atrial fibrillation. J Am Coll Cardiol 2011;57(3):313-321






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.