
- DAZ.online
- DAZ / AZ
- DAZ 36/2015
- Systematisch gegen Fä...
Arzneimittelsicherheit
Systematisch gegen Fälschungen
Das deutsche SecurPharm-Projekt
Auf einer Infotagung in Frankfurt/M. Ende Juli zeigten sich alle Beteiligten am deutschen Anti-Fälschungssystem SecurPharm sehr zufrieden mit dem Stand des deutschen Projekts: „SecurPharm funktioniert unter Marktbedingungen“, jubelte beispielsweise SecurPharm-Geschäftsführer Martin Bergen, und auch der Vertreter des Bundesgesundheitsministeriums (BMG) Dr. Oliver Onusseit sah Deutschland in der Umsetzung „an der europäischen Spitze“. Zwar sagte auch der Sprecher des SecurPharm-Vorstands Dr. Reinhard Hoferichter, dass man bisher nur von wenigen Fälschungen in der legalen Vertriebskette weiß – die Zahl der Fälle sei aber in den vergangenen Jahren rapide angestiegen. Vor allem aber, gab Hoferichter zu bedenken, hätte das in Deutschland vorgesehene SecurPharm-System alle diese Fälle zuverlässig verhindert.
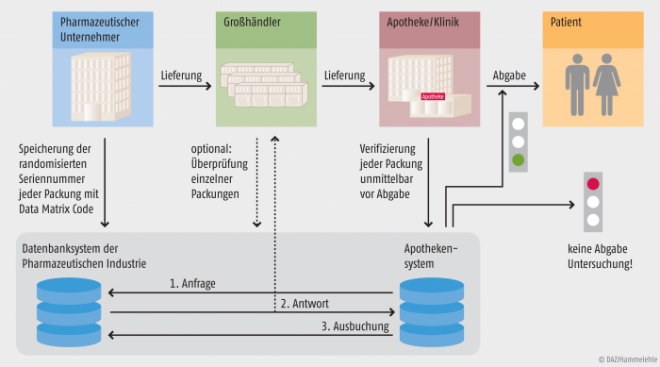
Was versteckt sich hinter dem Begriff SecurPharm? Laut der Website securpharm.de „eine Initiative zum Schutz des deutschen Arzneimittelvertriebs vor dem Eindringen gefälschter Arzneimittel“, mit dem Ziel, „den Arzneimittelvertrieb noch sicherer zu machen“. Bei dem „Fälschungsabwehrsystem“ Securpharm handelt es sich dabei um ein sogenanntes End-to-End-Verifikationssystem für verschreibungspflichtige Arzneimittel. Das bedeutet, dass jede Packung beim Hersteller eine individuelle Seriennummer („Serialisierung“) erhält, die diese Packung eindeutig identifiziert („Unique Identifier“). Diese Nummer wird vom Hersteller in eine Hersteller-übergreifende Datenbank (Repository) eingespielt. Das ist sozusagen das eine Ende der Kette. Am anderen Ende steht die Abgabe des Arzneimittels an den Patienten. In diesem Moment wird die Packung vom Apotheker gescannt und ihre Authentizität überprüft (s. Abb. 1).
Abb. 1: Der Weg eines Arzneimittels durch das SecurPharm-System Der Hersteller speichert die Seriennummern in der Datenbank, der Apotheker fragt die Echtheit der Nummer bei der Abgabe der Packung ab. Der Großhändler muss nur bestimmte Packungen prüfen, die als besonders risikobehaftet gelten. [Quelle: SecurPharm]
Für diese Verifikation wird die Nummer der Packung in der Datenbank abgefragt. Wurde die Nummer vom Hersteller gar nicht vergeben oder wurde diese Nummer bereits von einer anderen Apotheke „ausgebucht“, so ist die fragliche Packung möglicherweise gefälscht und darf vom Apotheker nicht abgegeben werden. (Natürlich kann es auch andere Gründe für eine Warnung geben als eine Fälschung, z. B. könnte der Hersteller die Nummern nicht korrekt hochgeladen haben o. ä.). Die Anfrage der Apotheke in der Hersteller-Datenbank wird von einer sogenannten Clearing-Stelle anonymisiert, so dass der Hersteller nicht erfährt, welche seiner Packungen in welcher Apotheke gelandet ist. Nur in einem konkreten Verdachtsfall wird diese Anonymisierung aufgehoben, um dem Fälschungsverdacht nachgehen zu können. Diese Clearingstelle, auch „Apothekensystem“ genannt, wird von der Werbe- und Vertriebsgesellschaft Deutscher Apotheker (WuV) betrieben, befindet sich also in Apothekerhand.
Die Verifikation der Seriennummer und die Überprüfung, dass das zukünftig ebenfalls vorgeschriebene Unversehrtheits-Siegel (Anti-tempering device, s. unten), unbeschädigt ist, muss zum Zeitpunkt der Abgabe des Arzneimittels geschehen. Das bedeutet aber nicht, dass die Apotheke die Packung nicht auch beim Wareneingang scannen und prüfen kann.
Europäische Anbindung und EMVO
Da der Arzneimittelmarkt in Europa inzwischen ein länderübergreifender ist, muss das deutsche SecurPharm-System mit den Systemen anderer Länder kommunizieren können. Die Europäische Kommission spricht von einer „Interoperabilität“, die gewährleistet sein muss. Arzneimittel, die in anderen Ländern hergestellt wurden, müssen in die nationale Datenbank eingespeist werden, genauso wie in Deutschland hergestellte Arzneimittel, die ins Ausland exportiert werden, dort in die nationalen Repositories aufgenommen werden müssen.
Dazu gibt es einen sogenannten European Hub, der von der European Medicines Verification Organisation (EMVO) betrieben wird und der die Kommunikation zwischen den Repositories der nationalen Systeme/Organisationen übernimmt. Die EMVO wird auch ein „Blue-Print“-System entwickeln, das die Mitgliedstaaten übernehmen können, die kein eigenes System entwickeln möchten. In diesem Fall betreibt die EMVO das System, das aber trotzdem in nationaler Verantwortung liegt.
Getragen wird die EMVO ebenfalls von den Stakeholdern, in diesem Fall von fünf europäischen Verbänden der pharmazeutischen Hersteller, Großhändler und der Apotheker: der European Federation of Pharmaceutical Industries and Associations (EFPIA), der European Generic and Biosimilar Medicines Association (EGA), der Pharmaceutical Group of the European Union (PGEU), der European Association of Pharmaceutical Full-line Wholesalers (GIRP) und der European Association of Euro-Pharmaceutical Companies (EAEPC).
Die EMVO hat festgelegt, dass für den Aufbau der nationalen Datenbanken drei Anbieter zur Verfügung stehen: Arvato Systems, die zum Bertelsmann-Konzern gehört und den Zuschlag für das SecurPharm-Repository erhalten hat, sowie die Firmen Aegate und Solidsoft Reply.
Wann prüft der Großhändler?
Auch der pharmazeutische Großhandel ist in das SecurPharm-System eingebunden. Allerdings werden die Großhändler nicht flächendeckend alle Packungen erfassen und verifizieren müssen. Nach dem Entwurf des delegierten Rechtsakts müssen Großhändler jedoch mindestens die Packungen überprüfen, die an sie zurückgegeben werden oder die sie nicht direkt vom Hersteller (oder einem von diesem direkt beauftragten Dienstleister) beziehen. Außerdem müssen Großhändler alle Packungen scannen und aus dem System ausbuchen, die aus irgendeinem Grund die Vertriebskette innerhalb der EU verlassen, beispielsweise wenn (retournierte) Ware nicht mehr weiterverkauft werden kann oder wenn Packungen in ein Land außerhalb der EU exportiert werden.
In der Hand der Beteiligten
SecurPharm ist ein sogenanntes Stakeholder-System, weil es von den relevanten Akteuren („Stakeholder“) des Arzneimittelvertriebs entwickelt und betrieben wird und nicht etwa von einer Aufsichtsbehörde. Diese Stakeholder sind die Hersteller, vertreten durch ihre Verbände Bundesverband der Arzneimittel-Hersteller (BAH), Bundesverband der Pharmazeutischen Industrie (BPI) und Verband forschender Pharma-Unternehmen (vfa) (ProGenerika hat die Initiative bereits kurz nach ihrem Start wieder verlassen), der pharmazeutische Großhandel mit seinem Verband Phagro sowie die Apotheken, vertreten durch die ABDA.
Kein „Track & Trace“
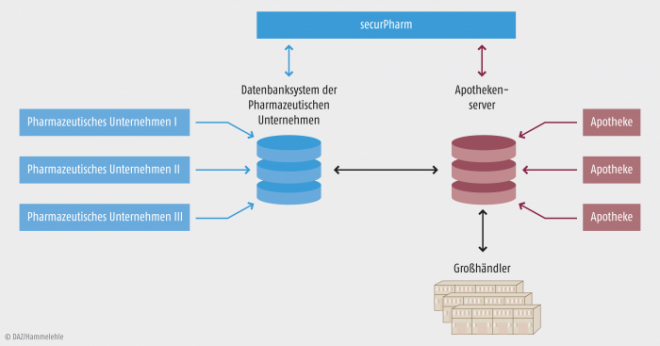
Bei SecurPharm sind die Daten, die der Hersteller bereitstellt, einsehen und verändern kann (Datenbanksystem der Hersteller) streng vom Apothekensystem getrennt (s. Abb. 2). Das bedeutet, dass die Hersteller nicht nachverfolgen können, über welche Zwischenstationen „ihre“ Produkte an welche Apotheke geliefert und wann sie dort abgegeben werden. Ein solches „Track & Trace“, wie man es heute beispielsweise von Paketdiensten kennt, wo man jederzeit nachverfolgen kann, wo sich das Päckchen aktuell befindet und wo es vorher war, wird es bei SecurPharm nicht geben: die Hersteller erhalten weder Informationen über die abgebende Apotheke noch über den Patienten.
Abb. 2: Keine (Rück-)Verfolgbarkeit Das Datenbanksystem der Hersteller (Repository) ist vom Apothekensystem getrennt. Der Weg einer Packung kann nicht über die Handelsstufen hinweg nachvollzogen werden. [Quelle: SecurPharm]
Die Abfrage von der Apotheke funktioniert über das von der WuV betriebene Apothekensystem, welches wiederum anonymisiert die Authentizität der Seriennummer in der Hersteller-Datenbank überprüft. Erst wenn hier eine fehlende Kongruenz auftaucht – sei es weil die Nummer in der Hersteller-Datenbank unbekannt ist, sei es weil bereits eine andere Packung mit derselben Nummer abgegeben wurde – werden die Daten der beiden Systeme zusammengeführt, um dem Fälschungsverdacht nachgehen zu können.
Der Data Matrix Code
Der Begriff SecurPharm ist inzwischen untrennbar mit dem Begriff „Data Matrix Code“ verbunden. Dabei handelt es sich um einen 2D-Barcode (ähnlich dem QR-Code), wie er beispielsweise von Online-Tickets bekannt ist. Er kann größere Datenmengen verschlüsseln als die Strichcodes, die heute auf Arzneimittelpackungen die PZN kodieren. So werden die neuen 2D-Codes neben den bisher schon in der PZN enthaltenen Informationen Name des Präparats, Wirkstärke und Packungsgröße auch noch die Chargenbezeichnung sowie das Verfalldatum beinhalten. Und natürlich die neue individuelle Seriennummer.
Bei SecurPharm werden Data Matrix Codes nach zwei unterschiedlichen Schemata verwendet: Nach dem IFA-und nach dem GS1-Standard. Die IFA, die Informationsstelle für Arzneispezialitäten, vergibt die PZN. Der IFA-Data Matrix Code enthält die PZN in Form der neuen Pharmacy Product Number. Beim Standard von GS1, die die heute auf annähernd allen Waren zu findenden EAN-Codes vergibt, wird die PZN in eine sogenannte NTIN (National Trade Item Number) umgewandelt. Beide Code-Systeme können von den Herstellern gleichberechtigt eingesetzt werden, für die Apotheke ist es völlig unerheblich, nach welchem Standard der Data Matrix Code erstellt wurde.
Das „Anti-Tempering Device“
Neben der Seriennummer muss jedes verschreibungspflichtige Arzneimittel als zweites Sicherheitsmerkmal zukünftig ein Siegel tragen, das die Unversehrtheit der Packung gewährleistet (Anti-Tempering Device). Anders als bei der Serialisierung schreibt jedoch weder die Richtlinie noch der delegierte Rechtsakt vor, wie dieses Siegel aussehen oder technisch beschaffen sein muss. Die einzige Vorgabe ist, dass eindeutig erkennbar sein muss, wenn die Packung schon einmal geöffnet wurde.
Bisher völlig unklar ist, wie damit umgegangen wird, dass in der Apotheke manchmal Packungen geöffnet werden müssen, beispielsweise zur Fertigarzneimittelprüfung oder um einem Patienten die Tabletten zeigen zu können. Allerdings ist die Authentizität des Arzneimittels gewährleistet, wenn die Packung mit unbeschädigtem Siegel in der Apotheke eintrifft und erst dort geöffnet wird. Es bleibt jedoch die Schwierigkeit, dem Patienten das beschädigte Siegel erklären zu müssen.
Der delegierte Rechtsakt und der Zeitplan
2011 wurde die europäische Richtlinie 2011/62/EU, meist einfach Fälschungsschutzrichtlinie oder sogar nur Fälschungsrichtlinie genannt, verabschiedet, die auf das bereits 2008 beschlossene „Pharmapaket“ des damaligen EU-Industriekommissars Günther Verheugen zurückgeht.
Die Richtlinie legt fest, dass die technischen Ausführungsdetails in einem delegierten Rechtsakt festgelegt werden. Dieser wird als Verordnung von der EU-Kommission erlassen, anschließend haben das Europäische Parlament und der EU-Ministerrat maximal vier Monate Zeit, diese Verordnung anzunehmen oder abzulehnen – Änderungen am Text sind nicht möglich. Europäische Verordnungen treten unmittelbar in allen Mitgliedstaaten in Kraft, anders als Richtlinien, die erst in nationale Gesetze übernommen werden müssen.
Nach Verabschiedung des delegierten Rechtsakts zur Fälschungsrichtlinie gibt es eine dreijährige Übergangsfrist, in der die Mitgliedstaaten ein nationales Fälschungssicherheitssystem aufbauen müssen. Für Italien, Griechenland und Belgien gilt eine Übergangsfrist von sechs Jahren, weil diese Länder bereits heute jede Arzneimittelpackung individuell nummeriert haben.
Die Veröffentlichung des delegierten Rechtsakts war eigentlich für diesen Juni erwartet worden. Nach Aussagen der EU-Kommission verzögerte sich die Verordnung aber, vor allem weil sich die rechtliche Prüfung des Dokuments in die Länge gezogen hat. Inzwischen hat die Kommission Mitte August den Entwurf der Verordnung veröffentlicht, Beobachter rechnen damit, dass die EU-Kommission die Verordnung noch im September beschließt. Anschließend könnten Parlament und Rat ihre Prüfung des Papiers beginnen. Die Verordnung würde dann wohl im Februar 2016 in Kraft treten. Anschließend beginnt die dreijährige Übergangsfrist, so dass die nationalen Fälschungsschutzsysteme wie SecurPharm wohl bis zum ersten Quartal 2019 europaweit eingeführt sein müssen.
Weiße und schwarze Ausnahmen
Die Fälschungsrichtlinie bestimmt, dass zukünftig grundsätzlich alle verschreibungspflichtigen Arzneimittel in Europa die beiden Sicherheitsmerkmale Seriennummer und Siegel tragen müssen. Nicht-verschreibungspflichtige Arzneimittel dürfen diese Sicherheitsmerkmale nach dem Wortlaut der Richtlinie nicht tragen. Allerdings gibt es Ausnahmelisten: eine „schwarze Liste“ für diejenigen nicht-verschreibungspflichtigen Arzneimittel, die die Sicherheitsmerkmale doch tragen müssen, und eine „weiße Liste“ mit rezeptpflichtigen Arzneimitteln, die von der Pflicht ausgenommen sind.
Die Hoffnung vor allem der Generika-Anbieter auf großzügige Ausnahmen oder gar sogenannte Gebietsausnahmen – „alle Generika sind von der Verpflichtung ausgenommen“ – haben sich nicht erfüllt. Das war nach ziemlich eindeutigen Aussagen von mit der Ausarbeitung der Verordnung betrauten Beamten auch nicht mehr erwartet worden. „Ausnahmen werden die Ausnahme sein“, machte beispielsweise der bei der Kommission für die Fälschungsrichtlinie verantwortliche Abteilungsleiter Stefano Soro bereits im Juni unmissverständlich klar.
Der Anhang 1 des nun veröffentlichten Entwurfs führt 14 verschreibungspflichtige „medizinischen Produkte“ auf, die die Sicherheitsmerkmale nicht tragen werden („weiße Liste“). Dabei handelt es sich u. a. um homöopathische Arzneimittel, Radionuklide, Kontrastmittel, medizinische Gase sowie bestimmte Infusionslösungen. Der Anhang 2 mit der „schwarzen Liste“ enthält sogar nur einen Wirkstoff. Wie allgemein erwartet, müssen Omeprazol-Hartkapseln mit 20 und 40 mg Wirkstoff zukünftig die Sicherheitsmerkmale tragen.
Nach dem Wortlaut der Richtlinie dürfen nicht verschreibungspflichtige Arzneimittel die Sicherheitsmerkmale überhaupt nicht tragen. Soro betonte aber, dass die nationale Gesetzgebung die Richtlinie in diesem Punkt „überstimmen“ kann. Das BMG deutete bereits an, dass in Deutschland gesetzlich geregelt werde, dass auch OTC-Packungen mit dem Anti-Tempering-Siegel „zugeklebt“ werden dürfen. Bei der Serialisierung der Packungen sieht das BMG dafür aber keine Möglichkeit: individuelle Seriennummern dürften tatsächlich nur auf Rx-Packungen aufgebracht werden – die Richtlinie sei hier eindeutig.
Wie läuft es in der Apotheke?
Apotheker, die das SecurPharm-System in ihrer Apotheke erproben, geben übereinstimmend Entwarnung: Abgesehen von einigen bisher ungeklärten Einzelheiten funktioniere das System reibungslos und lasse sich ohne großen Aufwand in den Arbeitsalltag integrieren. Der Vorsitzende des Bayerischen Apothekerverbands Dr. Peter Hubmann, rechnet sogar mit erheblichen Zeiteinsparungen, wenn der Data Matrix Code flächendeckend eingeführt ist und beim Wareneingang Chargennummern und Verfalldaten automatisch miterfasst werden. Im heutigen Testbetrieb sei noch ein kleiner Aufwand, dass die Testpackungen zweimal gescannt werden müssen: Neben dem neuen Data Matrix Code muss weiterhin der „alte“ Strichcode gescannt werden. Doch das wird mit der Einführung von SecurPharm im „Echtbetrieb“ nicht mehr nötig sein.
Das Argument, dass die Apotheken für viel Geld neue Scanner anschaffen müssen, lässt Hubmann nicht gelten. Schon seit mindestens zwei Jahren seien alle neu ausgelieferten Geräte in der Lage, auch die 2D-Codes zu erfassen, dazu sei ein signifikanter Preisverfall zu beobachten.
Einzig das Problem der Rücknahme einer einmal als abgegeben gemeldeten Packung sieht Hubmann als bisher ungelöst an. SecurPharm erlaube bisher eine „Rückbuchung“ nur innerhalb von fünf Minuten nach Abgabe. Das sei aber beispielsweise beim Botendienst nicht praktikabel, wenn der Fahrer den Patienten nicht angetroffen habe.
Dr. Patrizia Tosetti von der EU-Kommission sieht in dieser Frage vor allem auf Versandapotheken Probleme zukommen. Es müsse ein Kompromiss zwischen den Bedürfnissen der Versender und der Arzneimittelsicherheit gefunden werden, sagte sie. Klar sei aber, dass sich beispielsweise das Recht auf Rückgabe bestellter Waren dem Lex specialis der Arzneimittelgesetzgebung unterzuordnen habe.
Weitere bisher ungeklärte Fragen betreffen vor allem die Abgabe außerhalb der öffentlichen Apotheke, zum Beispiel wann im Krankenhaus eine Packung als „abgegeben“ aus dem System ausgebucht wird: Beim Verlassen der Apotheke, bei der Übergabe an die Station oder bei der Abgabe an einen Patienten auf der Station?
Auswirkungen auf Importeure und Hersteller
In den vergangenen Monaten sind die allermeisten gefälschten Arzneimittel im Parallelvertrieb, also bei Reimporteuren, aufgetaucht. Dabei handelte es sich in der Regel nicht um Fälschungen in dem Sinne, dass Arzneimittel „kopiert“ worden wären, sondern um gestohlene Original-Arzneimittel, die auf verschlungenen Wegen letzten Endes bei deutschen Reimporteuren gelandet sind (Fälschung der Herkunft; s. Kasten „Was ist eine Arzneimittelfälschung?“).
Was ist eine Arzneimittelfälschung?
Als gefälscht definiert die Fälschungsrichtlinie „jedes Arzneimittel, bei dem Folgendes gefälscht wurde:
a) seine Identität, einschließlich seiner Verpackung und Kennzeichnung, seines Namens oder seiner Zusammensetzung in Bezug auf jegliche Inhaltsstoffe, einschließlich der Arzneiträgerstoffe und des Gehalts dieser Inhaltsstoffe;
b) seine Herkunft, einschließlich Hersteller, Herstellungsland, Herkunftsland und Inhaber der Genehmigung für das Inverkehrbringen; oder
c) seine Herkunft, einschließlich der Aufzeichnungen und Dokumente in Zusammenhang mit den genutzten Vertriebswegen.“
Diese Definition gilt ausdrücklich nicht für „unbeabsichtigte Qualitätsmängel und lässt auch Verstöße gegen die Rechte des geistigen Eigentums unberührt.“
Der Vertreter des Bundesgesundheitsministeriums Dr. Oliver Onusseit sagte zu diesem Themenkomplex auf der SecurPharm-Infotagung, dass der Importeur zukünftig jede von ihm erworbene Packung im entsprechenden Fälschungsschutzsystem des Herkunftslandes überprüfen und ausbuchen muss. Anschließend wird die Packung mit einer neuen Seriennummer versehen und im System des Importlandes, also in Deutschland bei SecurPharm, eingetragen. Denn arzneimittelrechtlich ist der Importeur der pharmazeutische Unternehmer, gilt also als „Hersteller“ des Arzneimittels.
Onusseit gab aber auch zu, dass bei ausreichend großer krimineller Energie der Beteiligten ein auf die Erkennung von Fälschungen ausgelegtes System wie SecurPharm bei dem „in Mode gekommenen Weg“ des Wiedereinschleusens von Arzneimitteldiebstählen in die legale Lieferkette eine Schwachstelle habe. Vor 2011 habe man sich schlicht nicht vorstellen können, welche Ausmaße das Problem in den letzten Jahren angenommen hat.
Auf die Hersteller verschreibungspflichtiger Arzneimittel wird die Umsetzung der Fälschungsschutzrichtlinie weitreichende Auswirkungen haben. Experten gehen davon aus, dass weltweit fast alle Verpackungsanlagen von den neuen Anforderungen betroffen sind. Die SecurPharm-Verantwortlichen rufen die Hersteller deswegen dazu auf, sich frühzeitig mit den neuen Anforderungen auseinanderzusetzen: „Drei Jahre sind bei solchen Projekten eine verdammt kurze Zeit“, warnt beispielsweise SecurPharm-Geschäftsführer Bergen. In den Firmen seien nahezu alle Abteilungen von Prozessumstellungen betroffen. Dazu könnten Engpässe bei IT-Dienstleistern und Hardware-Lieferanten kommen, vor allem wenn die obligatorische Einführung näher rückt.
An einem jedenfalls lassen weder Vertreter der EU-Kommission noch des BMG Zweifel aufkommen: Ab dem Stichtag, an dem die Übergangsfrist endet, darf in der gesamten EU kein verschreibungspflichtiges Arzneimittel ohne die Sicherheitsmerkmale mehr in den Verkehr gebracht werden! |























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.