
- DAZ.online
- DAZ / AZ
- DAZ 35/2015
- Pufferung von Rezepturen
Pufferung von Rezepturen
Wann ist sie nötig? Wann ist sie sinnvoll?
Bedeutung eines stabilen pH-Wertes
Der pH-Wert einer Rezeptur hat Einfluss auf die enthaltenen Wirk- und Hilfsstoffe. Manchmal können sich pH-Wertänderungen negativ auswirken. Beeinflusst werden vor allem die Löslichkeit der Stoffe und deren Stabilität. Von der Löslichkeit kann auch die Wirksamkeit abhängen. So liegt Clioquinol nur bei etwa pH 5 undissoziiert vor und ist dadurch ausreichend lipophil und wirksam [8]. Das bekannteste Beispiel für pH-abhängige Stabilität ist sicher Erythromycin, welches sich im sauren Bereich innerhalb von Stunden zersetzt. Das Wirkoptimum der Substanz liegt bei pH 8 bis 8,5. Eine ausreichende Stabilität ist im Bereich von pH 7 bis 9 gegeben [8]. Ähnliche Phänomene sind auch für Hilfsstoffe bekannt, erwähnt seien hier nur die Ester der para-Hydroxybenzoesäure (pHB-Ester), deren Wirkoptimum zwischen pH 4 und pH 7 liegt. Bei pH-Werten über acht tritt eine Hydrolyse der Ester ein. Für jede pH-abhängig reagierende Substanz, egal ob Wirk- oder Hilfsstoff gibt es ein pH-Optimum für Löslichkeit, Wirksamkeit und Stabilität. Der letztendlich eingestellte pH-Wert einer Rezeptur bildet immer einen Kompromiss zwischen den idealen Werten der vorhandenen Substanzen. Wenn die optimalen pH-Werte für die verschiedenen Stoffe keine Überschneidungen zeigen, ist die Anfertigung von zwei Rezepturen zu bevorzugen. Im Prinzip gilt dies für alle Rezepturen. Praktische Relevanz hat die pH-Wert-Einstellung jedoch nur bei protischen Lösungsmitteln in der Grundlage, also in wasserhaltigen Rezepturen.
Bisher unberücksichtigt geblieben ist der Einfluss des pH-Wertes auf die Verträglichkeit der Rezeptur. Liegt der optimale Wert für die Rezeptur außerhalb des physiologischen Bereichs, kann die Anwendung schmerzhaft oder sogar schädlich für den Patienten sein. Folglich muss immer auch in die Überlegungen mit einbezogen werden, ob die perfekt stabile und wirksame Lösung auch für den Patienten angenehm ist. So gelten Augentropfenlösungen mit pH-Werten von 7,3 bis 9,7 als reizfrei [2].
Eine Übersicht über Wirkstoffe, die einen sehr eng eingestellten pH-Wert benötigen, zeigt die Tabelle 1.
Wirkstoff |
pH-Angabe |
Unverträglichkeiten |
|---|---|---|
Erythromycin [5, 9] |
pH 8 bis 9 optimale Wirksamkeit tolerierbar zum Teil pH 7 bis 10, dann ist allerdings die Stabilität beeinträchtigt
|
vor allem saure Wirk- und Hilfsstoffe (Sorbinsäure!) |
Chloramphenicol [6] |
pH 2 bis 7, beste Stabilität bei pH 6 |
alkalisch und sauer reagierende Stoffe |
Metronidazol [5, 9] |
pH 3 bis 8 Optimum pH 4 bis 6
|
vor allem basisch reagierende Stoffe |
Harnstoff [5, 9] |
pH 1 bis 12, beste Stabilität bei pH 6,2 |
Stoffe, deren optimale Stabilität im stark sauren oder im basischen Bereich liegt |
Clotrimazol [5, 9] |
pH 3,5 bis 10 |
saure Stoffe (Hydrolyse) |
Einstellung von pH-Werten bei Rezepturen
Bei der Einstellung von pH-Werten ist immer zu beachten: Jede Korrektur eines pH-Wertes kann zu Löslichkeitsänderungen (Ausfällungen oder Salzbildungen) bei Wirk- und Hilfsstoffen führen. Diese können gewollt sein (Löslichkeitserhöhung von Ketoconazol durch Salzbildung mit Milchsäure) oder Probleme bereiten (Umwandlung von Sorbinsäure in unwirksames Kaliumsorbat durch Erhöhung des pH-Wertes). Die Verwendung von pH-Korrigenzien, die selbst keine arzneiliche Wirkung haben, ist aber nichts desto trotz auch dann erlaubt, wenn diese nicht auf der Verordnung stehen (§ 7 ApBetrO).
Einstellung des pH-Wertes durch Zugabe von geringen Mengen Säure bzw. Base
Die Anpassung eines pH-Wertes kann durch die Zugabe von kleinen Mengen Säure oder Base erfolgen. Vorteil dieser Methode gegenüber der Pufferung ist, dass bei der Applikation unphysiologische pH-Werte der Rezeptur schnell an die Werte des Körpers angepasst werden können. So sind auch unphysiologische pH-Werte bei Zubereitungen, die nur in kleinen Mengen appliziert werden, manchmal tolerierbar (z. B.Augentropfen; i. v.-Injektionen). Diese schnelle Anpassung an äußere Einflüsse stellt auch gleichzeitig den Nachteil der Methode dar. Änderungen des pH-Werts durch instabile Stoffe (Harnstoff) in der Rezeptur oder äußere Einflüsse (Kohlenstoffdioxid) ändern den pH-Wert der Rezeptur sehr stark. Deshalb ist in vielen Fällen auch die Einstellung des pH-Wertes einer Rezeptur mithilfe eines Puffersystems erforderlich.
Einstellung des pH-Wertes durch Pufferung
Die Vor- und Nachteile dieser Methode lassen sich aus dem vorhergehenden Absatz ableiten. Durch die Zugabe eines Puffers werden relativ konstante pH-Werte über die gesamte Lagerzeit der Rezeptur erzielt. Dadurch ergibt sich aber auch eine schlechte Anpassung unphysiologischer pH-Werte, die z. B. für die Stabilität nötig sind, an die physiologischen Gegebenheiten bei der Applikation. Für den Patienten kann dies bedeuten, dass Schmerzen bei der Applikation auftreten oder Gewebeschädigungen möglich sind. Ferner ist zu beachten, dass durch die Zugabe eines Puffers auch immer zusätzliche Ionen in die Rezeptur gelangen. Die Elektrolytmenge ist also erhöht und es besteht die Gefahr neuer Inkompatibilitäten, welche im Rahmen der Plausibilitätsprüfung berücksichtigt werden müssen.
Puffer
Puffer sind Lösungen, die eine schwache bis mittelstarke Säure (Base) und das Salz von deren korrespondierender Base (Säure) in ungefähr gleicher Konzentration enthalten. Normalerweise werden die beiden Pufferbestandteile im Verhältnis 1:1 gemischt, da sich so die optimale Pufferwirkung ergibt. Abweichungen von diesem Verhältnis sind möglich. Man sollte aber beachten, dass die Pufferwirkung stark nachlässt, wenn der Bereich pKs ± 1 verlassen wird. Nach der Henderson-Hasselbalch-Gleichung: pH = pKs + lg (c(A-)/c(HA)), bedeutet dies, dass das Verhältnis der beiden Pufferbestandteile 10 : 1 bzw. 1 : 10 nicht überschreiten darf. Wird dieses Konzentrationsverhältnis überschritten, so sinkt die Pufferkapazität drastisch ab.
Unter der Pufferkapazität versteht man die Stoffmenge an Oxonium- oder Hydroxid-Ionen, die benötigt wird, bis sich der pH-Wert der Lösung um eine Einheit geändert hat. Sie hängt vom gewünschten pH-Wert des gewählten Puffers und von der Menge des Puffers ab. Da bei Rezepturen die zugesetzte Menge an Puffer so gering wie möglich gewählt werden sollte, bedeutet dies gleichzeitig, dass der pKs-Wert des verwendeten Puffersystems möglichst nahe am benötigten pH-Wert liegen sollte. Die optimale Pufferwirkung liegt im Bereich pH = pKs ± 1 vor.
Tabelle 2 zeigt einige gebräuchliche Puffer mit ihren pH-Werten. Auffällig ist, dass für den schwach sauren Bereich eine große Auswahl an Substanzen vorliegt, während im basischen Bereich praktisch nur Phosphat- oder Carbonat-Puffer verwendet werden. Bei beiden ist der pH-Wert abhängig von den jeweils verwendeten Salzen. Bei Carbonat- oder Hydrogencarbonat-Puffern kann es durch Abgabe oder Aufnahmen von Kohlenstoffdioxid aus der Luft zu pH-Verschiebungen kommen.
2 H+ + CO32- ↔ H+ + HCO3- ↔ H2CO3 ↔ H20 + CO2
Schon erwähnt wurde der Aspekt, dass Puffersysteme immer Ionen enthalten. Dies kann zu ionischen Wechselwirkungen führen, welche bei der Auswahl des Puffers berücksichtigt werden müssen. Die einwertigen Kationen der Salze sind hierbei kaum problematisch, da sie nur selten schwerlösliche Salze bilden. Mehr Aufmerksamkeit sollte bei der Plausibilitätsprüfung den Säurerest-Anionen geschenkt werden, die mit kationischen Wirk- und Hilfsstoffen reagieren könnten. Eine Auflistung von Wirkstoffen nach Stoffklassen (Anion; Kation, neutral) findet sich in den Tabellen für die Rezeptur des DAC/NRF.
Substanz |
pKs-Werte |
pH |
Anmerkungen |
|---|---|---|---|
Citronensäure/Natriumcitrat |
3,13; 4,76; 6,40 |
pH 4,2 |
NRF 11.37.; NRF S 37 |
Essigsäure/Natriumacetat |
4,74 |
pH 4,7 |
|
Milchsäure/Natriumlactat |
3,86; 4,14 |
pH 4,2 |
NRF 11.71.; NRF 11.72.; NRF 11.74.; NRF 11.129. |
Kohlensäure und ihre Salze |
6,35; 10,33 |
abhängig vom Carbonat-/Hydrogencarbonat-Verhältnis |
Achtung: pH-Wertverschiebungen durch CO 2
|
Phosphorsäure und ihre Salze |
2,1; 7,1; 12,3 |
verschiedene pH-Bereiche, je nach (Mengen-) Kombination der Salze |
|
Natriumedetat |
Edetinsäure 2,0; 2,67; 6,16; 10,26 |
etwa pH 5 |
Puffer durch die Struktur |
Glycin |
2,34; 9,6 |
pHiso 5,97 |
Puffer durch die Struktur |
Sorbinsäure/Kaliumsorbat (entstanden aus Citronensäure/Kaliumsorbat) |
4,76 |
pH 4,5 |
Konzentration 0,05 bis 0,2% (Sorbinsäure) |
Kaliumsorbat und Sorbinsäure als Puffer?
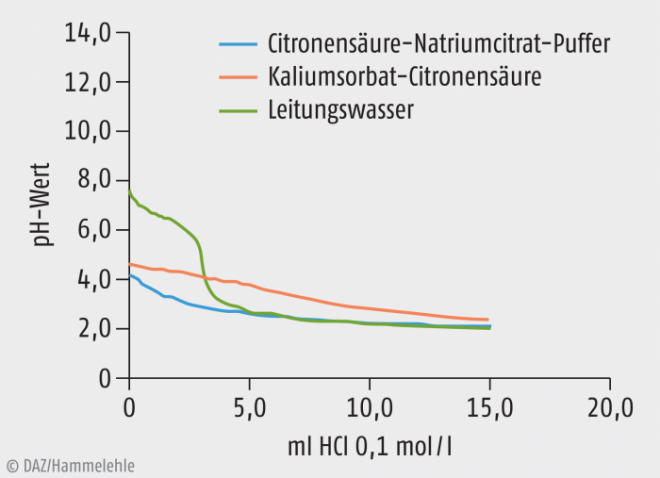
Bei Betrachtung dieser Puffer stellt sich die Frage, ob es sich bei der Mischung von Kaliumsorbat und Sorbinsäure, die zur Konservierung von mikrobiell anfälligen, wässrigen Rezepturen verwendet wird, nicht auch um eine Stoffkombination mit Pufferwirkung handelt. Schließlich liegt auch hier eine etwa äquivalente Mischung aus einer schwachen Säure (Sorbinsäure) und deren Alkali-Salz, dem Kaliumsorbat vor. Um diese Überlegung zu überprüfen, wurden einige Titrationen durchgeführt. Grundlage war eine Mischung aus Kaliumsorbat und Citronensäure, die auch in den Rezepturen des NRF häufig verwendet wird, um bei der Herstellung das Problem der relativ schlechten Löslichkeit der Sorbinsäure zu umgehen. Die gelösten Mengen betrugen 0,14 g Kaliumsorbat und 0,07 g Citronensäure in 100 ml Lösung. Das entspricht der gängigen Menge in 100 g Rezeptur. Wobei die Konzentration in Rezepturen häufig höher ist, da die Wassermenge nur einen Teil der Gesamtmenge ausmacht. Als Vergleichslösungen dienten zum einen Citronensäure-Natriumcitrat-Puffer (jeweils 0,025 g in 100 ml, entsprechend 5 g einer Lösung von je 0,5% Citronensäure und Natriumcitrat in Wasser, die für eine Rezepturmenge von 100 g nötig sind) und Leitungswasser. Die Feststoffe wurden also in rezepturüblichen Konzentrationen in gereinigtem Wasser gelöst. Das Leitungswasser wurde anstelle von gereinigtem Wasser verwendet, um die pH-Elektrode (Hanna®Instruments, water proof Family, pH-Meter mit 0,1 pH Messgenauigkeit), nicht zu beschädigen. In der Titrationskurve des Leitungswassers mit Salzsäure zeigt sich ein Pufferbereich durch den relativ hohen Kalkgehalt des Wassers (Kohlensäure-Hydrogencarbonat-Puffer).
Abb. 1: Titrationskurve einer Citronensäure-Natriumcitrat-Lösung, Kaliumsorbat-Citronensäure-Lösung und Leitungswasser mit 0,1 molarer Salzsäure.
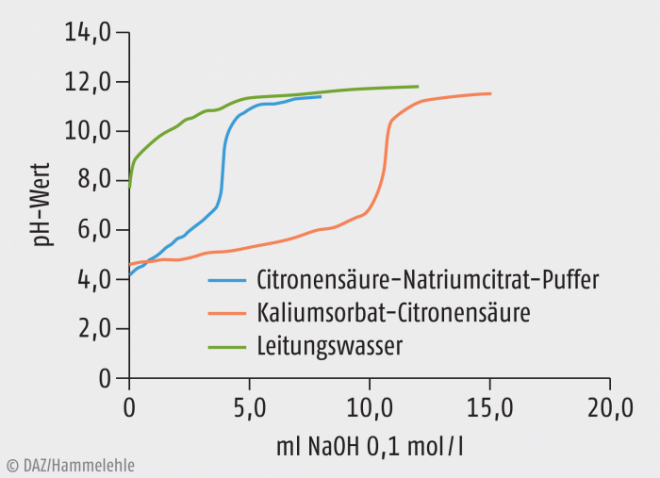
Titriert wurden immer 100 ml der jeweiligen Lösung mit Salzsäure 0,1 mol/l bzw. Natriumhydroxid-Lösung 0,1 mol/l. Die Abbildungen 1 und 2 zeigen die entsprechenden Titrationskurven. Daraus lassen sich die Verbrauchswerte für Salzsäure bzw. Natronlauge der Konzentration 0,1 mol/l bis zu einer pH-Wert-Änderung von einer Einheit gegenüber dem Ausgangswert ableiten (Tabelle 3). Das entspricht dem normalen Pufferbereich, der nicht überschritten werden sollte. Erstaunlicherweise waren die hierfür benötigten Mengen bei der für gewöhnlich eingesetzten Pufferkombination Citronensäure-Natriumcitrat geringer als bei der eigentlich als Konservierung verwendeten Kaliumsorbat-Citronensäure-Kombination. Die Konservierung zeigte also eine bessere Pufferwirkung als der eigentliche Puffer. Für die Praxis könnte das bedeuten, dass mit Kaliumsorbat-Citronensäure konservierte Zubereitungen, die dann etwa einen pH-Wert von 4,6 haben, keine zusätzliche Pufferung benötigen, da das Konservierungsmittel selbst in der Lage ist, den pH-Wert konstant zu halten.
Abb. 2: Titrationskurve einer Citronensäure-Natriumcitrat-Lösung, Kaliumsorbat-Citronensäure-Lösung und Leitungswasser mit 0,1 molarer Natronlauge.
Nicht geklärt ist allerdings, ob diese in rein wässriger Lösung gewonnenen Erkenntnisse sich auch auf unterschiedliche Rezepturen übertragen lassen oder ob die konservierende Wirkung unter der Veränderung der Mengenverhältnisse während des Puffervorgangs leidet. Ein weiteres Problem könnte sich bei sehr starker Belastung des Kaliumsorbat-Sorbinsäure-Puffers mit Säure ergeben, da die durch die Gleichgewichtsverschiebung entstehende Sorbinsäure nur eine begrenzte Wasserlöslichkeit von 1,06 g in 1000 g Lösung bzw. Wasseranteil hat.
Puffersystem bzw. Leitungswasser |
Verbrauch HCl 0,1 mol/l in ml |
Verbrauch NaOH 0,1 mol/l in ml |
|---|---|---|
Leitungswasser |
0,5 |
0,25 |
Citronensäure-Natriumcitrat |
2,05 |
1,4 |
Kaliumsorbat-Citronensäure |
5,5 |
6,5 |
Welcher Puffer für welche Rezeptur?
Hier ist die Datenlage in der Literatur leider eher schlecht. Es gibt (noch) keine ausführlichen Auflistungen, aus denen eindeutige Zuordnungen hervorgehen. Anhaltspunkt für die Verwendung von Pufferlösungen sollten immer standardisierte Rezepturen sein. Beachtet werden muss dabei aber immer, das der Puffer in der speziellen Rezeptur eingesetzt wird und nicht nur für den Wirkstoff. Eine Änderung der Grundlage kann also eine Verschiebung des pH-Bereichs bedeuten und damit eine andere Art der pH-Wert-Einstellung oder -Stabilisierung erfordern. Folglich ist jede Rezeptur wieder ein neuer Kompromiss zwischen den verschiedenen pH-Optima der enthaltenen Stoffe und der physiologischen Verträglichkeit und damit auch wieder eine neue Herausforderung an den Herstellenden. |
Quelle
[1] DAC-NRF, Govi-Verlag Pharmazeutischer Verlag GmbH Eschborn
[2] Herstellung der Zubereitungen zur Anwendung am Auge, Arbeitshilfen der Bundesapothekerkammer (BAK), 14. November 2006
[3] Caelo Rezepturforum
[4] DAC/NRF, Govi-Verlag Pharmazeutischer Verlag GmbH Eschborn
[5] DAC/NRF, Tabellen für die Rezeptur, Plausibilitätsprüfung in der Apotheke, 8. überarb. Aufl., Govi-Verlag Pharmazeutischer Verlag GmbH, Eschborn, 2015
[6] Fischer U, Schüler K. Rezeptur Qualität in 7 Schritten, 1. Auflage, Deutscher Apotheker Verlag Stuttgart 2013
[7] Garbe C, Reimann H. Dermatologische Rezepturen, 2. Auflage, Georg Thieme Verlag, Stuttgart 2005
[8] Wirkstoffdosiers für externe dermatologische Rezepturen, GD Gesellschaft für Dermopharmazie, 30. August 2013
[9] Ziegler AS. Plausibilitäts-Check Rezeptur gemäß § 7 ApBetrO, 3. Auflage. Deutscher Apotheker Verlag, Stuttgart 2015






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.