
- DAZ.online
- DAZ / AZ
- DAZ 34/2015
- Fertigarzneimittel versus...
Arzneimittel und Therapie
Fertigarzneimittel versus Eigenherstellung
Erste Ciclosporin-Augentropfen bei trockenem Auge zugelassen
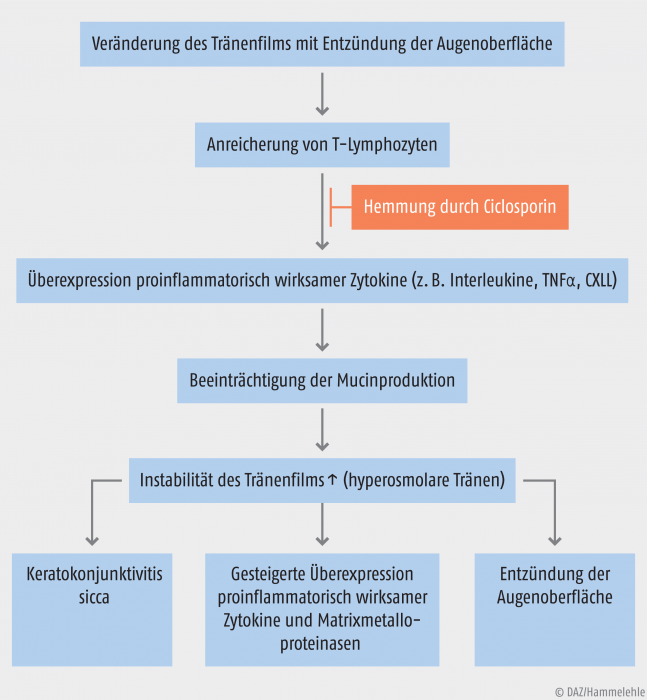
Das „trockene Auge“ (syn.: Keratokonjunktivitis sicca) stellt eine Augenerkrankung dar, die viele Faktoren als Ursache haben kann und inzwischen zu einem der häufigsten Gründe zählt, weshalb Patienten einen Augenarzt aufsuchen. Die chronische Form zeichnet sich durch eine nachhaltige Veränderung des Tränenfilms aus, die mit einer Entzündung auf der Augenoberfläche einhergeht. In diesem Zusammenhang kommt es zu einer Anreicherung von T-Lymphozyten und einer vermehrten Ausschüttung an proinflammatorisch wirksamen Zytokinen, die wiederum die Mucin-Produktion beeinträchtigen und damit die Instabilität des Tränenfilms vorantreiben.
Unter diesen Vorzeichen ist es nachvollziehbar, wenn künstliche Tränenersatzmittel bei chronischen Formen der Keratokonjunktivitis sicca oft nur begrenzt hilfreich sind. Mit dem Calcineurin-Inhibitor Ciclosporin werden die T-Zellproliferation und -signaltransduktion gebremst und die Ausschüttung der genannten Entzündungsmediatoren reduziert. Schon 2003 war von der FDA mit dem Präparat Restasis® eine topisch anwendbare, Ciclosporin-haltige Darreichungsform (Endkonz.: 0,05%) zugelassen worden, jedoch waren die klinischen Studienergebnisse in Verbindung mit Restasis® teilweise inkonsistent, so dass das Zulassungsverfahren bei der EMA nicht erfolgreich war.
Somit bestand in Deutschland seit über 15 Jahren das Dilemma, den Pathomechanismus des chronisch trockenen Auges zwar zu kennen, jedoch kein zugelassenes Präparat zur Verfügung zu haben. Die Kostenerstattung von importiertem Restasis® gestaltete sich erfahrungsgemäß auf der Basis des SGB V schwierig.
Über viele Jahre behalf man sich notgedrungen mit der NRF-Rezeptur „ölige Ciclosporin AT 2%“, wohl wissend, dass die Konzentration und galenische Formulierung für die Behandlung des trockenen Auges einer Überarbeitung bedurfte. Teilweise wurden patentierte Modifikationen (z. B. Nanoemulsion) auf den Weg gebracht, die aber nicht nach industriellen Maßstäben hergestellt wurden und u. a. Fragen zur Chargenkonformität aufwarfen. Ein wichtiger Schritt war die rezepturmäßige Weiterentwicklung „wässrige Ciclosporin-Augentropfen 0,05%“, da hierdurch mehrere Aspekte vorangebracht wurden:
- ein standardisiertes Vorgehen ohne patentrechtliche Hürden,
- eine hohe Chargenkonformität,
- eine deutlich bessere Verträglichkeit gegenüber öligen AT und
- die Wahl einer möglichst niedrigen, effektiven Ciclosporin-Konzentration auf der Basis mehrerer klinischer Studienergebnisse.
Vor Kurzem bestätigten Wan et al. in ihrer Metaanalyse die klinische Wirksamkeit topischer Ciclosporin-Augentropfen 0,05% – zweimal täglich appliziert – beim chronisch trockenen Auge, gaben in diesem Zusammenhang allerdings zu bedenken, dass es gegenüber Placebo häufiger zu unerwünschten Begleiterscheinungen unter Ciclosporin 0,05% (Restasis®) kam, was einmal mehr die besondere Bedeutung der galenischen Formulierung hervorhebt.
Pathogenese der chronischen Keratokonjunktivitis sicca. Ciclosporin unterbindet das entzündliche Geschehen [modifiziert nach Schmidt V, Deuter C, Lipp H-P].
Kationische O/W-Emulsion als Grundlage
Mit Ikervis® ist nun vor Kurzem von der EMA erstmals ein Ciclosporin-haltiges Ophthalmikum mit einer Ciclosporin-Endkonzentration von 0,1% zugelassen worden. Es steht als Einzeldosis (EDO) zur Verfügung und wird einmal täglich verabreicht (z. B. vor dem Schlafengehen ein Tropfen in das betroffene Auge). Der pharmazeutische Hersteller hat in der Ciclosporin-haltigen Formulierung seinen patentgeschützten Tränenersatz Cationorm® auf der Basis der Novasorb®-Technologie (kationische O/W-Emulsion) verwendet, was in Verbindung mit Ciclosporin von Vorteil sein dürfte. Die positiv geladenen Nanoteilchen werden von der konstitutiv negativ geladenen Augenoberfläche „angezogen“, so dass eine Penetration von Cationorm® mit und ohne Ciclosporin in tiefere Schichten zu erwarten ist.
Da sich im Rahmen der SANSIKA-Studie signifikante Vorteile durch den topischen Einsatz des Calcineurin-Inhibitors Ciclosporin gegenüber Cationorm® ohne Ciclosporin ergaben, wurde von der EMA schließlich die Zulassung erteilt, wobei die Anwendung bisher auf schwere Keratitiden bei vorbehandelten Erwachsenen beschränkt ist. Nach den Kriterien des SGB V ist von einer Kostenerstattung auszugehen, wenn die vorgegebenen Anwendungsgebiete eingehalten werden, während leichte und moderate Formen der Keratokonjunktivitis sicca weiterhin zunächst mit Tränenersatzmitteln zu behandeln sind. Da Ciclosporin ein seit Langem verwendeter Arzneistoff ist, wird Ikervis® nicht den AMNOG-Prozess durchlaufen, so dass der festgelegte AVK bis auf Weiteres bestehen bleibt.
Steckbrief: Ciclosporin-Augentropfen
Handelsname: Ikervis®
Zulassungsinhaber: Santen OY, Finnland
Einführungsdatum: 8. Juli 2015
Zusammensetzung: eine Pipette (0,3 ml Lsg.) enthält: Ciclosporin 0,3 mg;
sonstige Bestandteile: mittelkettige Triglyceride,Cetalkoniumchlorid 0,015 mg, Glycerol, Tyloxapol, Poloxamer 188, Natronlauge zur pH-Wert-Einstellung, Wasser für Injektionszwecke
Packungsgröße, Preis und PZN:
30 Einzeldosispipetten à 0,3 ml; 109,60 Euro, PZN 11130763
Stoffklasse: andere Ophthalmika,ATC-Code: S01XA18
Indikation: Zur Behandlung schwerer Keratitis bei Erwachsenen mit trockenen Augen, bei denen trotz Behandlung mit Tränenersatzmitteln keine Besserung eingetreten ist.
Erwachsene träufeln einen Tropfen in das betroffene Auge bzw. in die betroffenen Augen einmal täglich vor dem Schlafengehen ein. Dosisanpassungen für Ältere oder Patienten mit Leber- oder Niereninsuffizienz sind nicht erforderlich. Das Ansprechen auf die Behandlung sollte mindestens alle 6 Monate überprüft werden.
Hinweise zur Anwendung: Vor der Anwendung sollte das Einzeldosisbehältnis vorsichtig geschüttelt werden. Jedes Einzeldosisbehältnis reicht zur Behandlung beider Augen. Nicht verwendete Emulsion ist unmittelbar zu entsorgen. Um die systemische Absorption zu reduzieren, sollen nach dem Einträufeln die Augenlider für zwei Minuten geschlossen werden (nasolakrimaler Verschluss).
Wenn mehr als ein topisches Augenarzneimittel angewendet wird, muss zwischen der Anwendung der Arzneimittel ein Abstand von mindestens 15 Minuten liegen. Ciclosporin-Augentropfen sollten als letztes angewendet werden.
Gegenanzeigen: Bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile sowie akuten oder vermuteten okularen oder periokularen Infektionen darf das Arzneimittel nicht angewendet werden.
Nebenwirkungen: Häufigste Nebenwirkung sind Schmerzen an der Verabreichungsstelle (≥ 10%). Häufig kommt es zu Erythem des Augenlids und der Verabreichungsstelle sowie zu Reizung, Schmerzen und verstärkter Produktion von Tränenflüssigkeit. Auch über okulare Hyperämie, verschwommenes Sehen, Augenlidödem und konjunktivale Hyperämie wurde berichtet. Generell besteht bei Patienten, die mit Immunsuppressiva behandelt werden, einschließlich Ciclosporin, ein erhöhtes Infektionsrisiko. Es können sowohl generalisierte als auch lokale Infektionen auftreten. Bereits bestehende Infektionen können ebenfalls verstärkt werden.
Wechselwirkungen: Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Die gleichzeitige Anwendung von Ikervis® und Augentropfen, die Corticosteroide enthalten, könnte die Wirkungen von Ciclosporin auf das Immunsystem verstärken.
Warnhinweise und Vorsichtsmaßnahmen: Bei Patienten, die Augenherpes in ihrer Vorgeschichte hatten, sollte die Anwendung mit Vorsicht erfolgen, da das Präparat hier nicht getestet wurde.
Zur Behandlung von Patienten mit Glaukom liegen nur begrenzte Erfahrungen vor. Bei der gleichzeitigen Behandlung mit Ikervis® und anderen Mitteln ist Vorsicht geboten. Insbesondere gilt dies für Betablocker, von denen bekannt ist, dass sie die Tränensekretion verringern.
Das Konservierungsmittel Cetalkoniumchlorid kann Augenreizungen verursachen.
Fertilität, Schwangerschaft und Stillzeit:
Die Anwendung bei Frauen im gebärfähigen Alter, die nicht wirksam ver-
hüten, wird nicht empfohlen.
Die Anwendung des Arzneimittels während der Schwangerschaft wird nicht empfohlen, es sei denn, der potenzielle Nutzen für die Mutter überwiegt das potenzielle Risiko für den Fötus. Bisher liegen keine Erfahrungen mit der Anwendung bei Schwangeren vor.
Bei therapeutischen Dosen von Ciclosporin in Augentropfen ist es unwahrscheinlich, dass in der Muttermilch Mengen vorliegen, die einen Effekt auf das gestillte Kind haben. Bei der Entscheidung, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit diesem Arzneimittel verzichtet werden soll, sollen sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Ist nun die Eigenherstellung hinfällig?
Es ist davon auszugehen, dass es individuelle Präferenzen der betroffenen Patienten geben wird, z. B. Mehrdosisbehältnis vs. Einzeldosis, Cationorm® vs. Natriumhyaluronat als Basis, einmalige Gabe zur Nacht vs. Zweimal-Gabe, Rezepturpreis vs. AVK, so dass es zu begrüßen ist, wenn Patienten mit chronischer Keratokonjunktivitis sicca Auswahlmöglichkeiten zur Verfügung stehen. Zu beachten ist in diesem Zusammenhang, dass es sich bei der Symptomlinderung mit Ciclosporin um kein schnell eintretendes Ereignis handelt. Es ist deshalb nachvollziehbar, dass die EMA dem Hersteller von Ikervis® die Durchführung einer Phase-IV-Studie empfohlen hat, um die langfristigen Auswirkungen der Ikervis®-Behandlung auf Symptome und Krankheitskomplikationen noch genauer zu untersuchen. Ein direkter Vergleich – doppelblind, prospektiv, randomisiert multizentrisch – mit rezepturmäßig hergestellten Ciclosporin-Augentropfen würde zwar mehr Klarheit zu möglichen klinischen Unterschieden der Formulierungen bringen, ob aber ein investigator-initiated trial hierzu auf den Weg gebracht wird, darf bezweifelt werden.
Da bei den wässrigen Ciclosporin-Augentropfen 0,05% eine andere Endkonzentration und galenische Formulierung im Vergleich zu Ikervis® vorliegen, sind keine zulassungsrelevanten „Kollisionen“ mit Ikervis® derzeit Gegenstand der Diskussion, da es sich um kein systematisches „Nachbauen“ des Fertigarzneimittels handelt (Urteil VG Köln, 14.10.2014).
Eigenherstellung langfristig günstiger
Abschließend darf darauf hingewiesen werden, dass die Herstellung der Ciclosporin-Augentropfen 0,05% im 5 ml-Mehrdosisbehältnis als Rezeptur in der Apotheke auch in der langfristigen Behandlung für die Kostenträger deutlich preiswerter ist als das Fertigarzneimittel Ikervis®, wobei bei Letzterem objektiv dem Kostenaufwand für die Durchführung entsprechender klinischer Studien und für die Herstellung von EDO Rechnung zu tragen ist.
Eine signifikante Kostenersparnis durch die Herstellung von Rezepturen in der Apotheke ist auch dann möglich, wenn das derzeit bestehende, leider nicht auskömmliche Vergütungsmodell für die relativ arbeitsaufwändige Herstellung von Augentropfen in Apotheken durch ein faires, den Aufwand deckendes, Vergütungsmodell ersetzt wird. |
Weiterführende Literatur:
EMA 2015: Assessment report Ikervis
Rüfer F, Brewitt H. Das trockene Auge ; Klin Monatsbl Augenheilkd 2004; 221:851-70
Schmidt V, Deuter C, Lipp H-P. ScRezept gegen trockene Augen – topische Ciclosporin-A-haltige Formulierungen bei chronisch-entzündlichen Keratoconjunctivitiden; DAZ 2013; 153:4528-35
Wan KH, Chen LJ, Young AL.Efficacy and Safety of Topical 0,05% Cyclosporine Eye Drops in the Treatment of Dry Eye Syndrome: A Systematic Review and Meta-analysis
The Ocular Surface 2015; 13:213-25






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.