
- DAZ.online
- DAZ / AZ
- DAZ 32/2015
- Lang erwartetes Comeback
Arzneimittel und Therapie
Lang erwartetes Comeback
MCP-Lösung ist wieder erhältlich
Bereits im Jahre 2010 hatte es ein Review der EU-Mitgliedstaaten zur Anwendung MCP-haltiger Präparate bei Kindern gegeben. Im Zuge dieses Reviews war ein Risiko neurologischer Nebenwirkungen identifiziert und Maßnahmen zur Risikominimierung empfohlen worden. Die französische Aufsichtsbehörde L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) hatte dann im folgenden Jahr (2011) die Situation auf nationaler Ebene erneut analysiert. In Frankreich waren über die Jahre hinweg verschiedene Maßnahmen implementiert worden, um die Sicherheit der Anwendung zu erhöhen. So hatte die französische Behörde bereits 2007 vor neurologischen Nebenwirkungen verursacht durch Überdosierungen bei Kindern gewarnt. 2010 waren das Dosiersystem der in Frankreich erhältlichen MCP-Kindertropfen (Primpéran®) aus Sicherheitsgründen umgestellt worden. Während zuvor nach Tropfen mit einer Pipette dosiert worden war, gab es ab diesem Zeitpunkt eine Pipette, auf deren Skala direkt das Gewicht des Kindes angegeben war. Das Umrechnen und damit eine mögliche Fehlerquelle entfielen also. Bei der erneuten Untersuchung kam man aber zu dem Ergebnis, dass trotz der verschiedenen Maßnahmen immer wieder über Nebenwirkungen berichtet wurde. Daher wurde der Humanarzneimittelaussschuss der EMA (CHMP) beauftragt, das Nutzen-Risiko-Verhältnis MCP-haltiger Zubereitungen zu bewerten und zwar für alle Altersgruppen, insbesondere aber für Ältere und Kinder. Darüber hinaus wurde in Frankreich im Februar 2012 die Anwendung von MCP auf Erwachsene beschränkt.
Im Juli 2013 veröffentlichte der CHMP dann das Ergebnis des Risikobewertungsverfahrens. Die Neubewertung habe, so der CHMP, das bereits bekannte Risiko für extrapyramidal-motorische Störungen bestätigt, wobei das Risiko für akute neurologische Störungen bei Kindern höher ist, Spätdyskinesien hingegen treten eher bei älteren Patienten auf. Das Risiko steigt mit der Dauer der Anwendung und der Dosis. Es gebe Anhaltspunkte dafür, dass bei Langzeitanwendung der Schaden den Nutzen überwiegt. Zudem habe es seltene Fälle von schweren kardiovaskulären Nebenwirkungen gegeben, insbesondere nach MCP-Injektion. Basierend auf diesen Ergebnissen hatte der Ausschuss dann folgende Beschränkungen empfohlen:
Die Anwendung von MCP soll auf fünf Tage beschränkt werden. Für den Benefit einer Langzeitanwendung gibt es keine überzeugenden Daten.
Bei Kindern unter einem Jahr sollte von der Anwendung abgesehen werden. Bei älteren Kindern ist MCP lediglich Mittel der zweiten Wahl bei postoperativem oder verzögertem Chemotherapie-induziertem Erbrechen.
Die Indikationsgebiete für Erwachsene
sollen auf Prophylaxe und Therapie von Übelkeit und Erbrechen in Zusammenhang mit Operationen, Bestrahlung, verzögerte Übelkeit und Erbrechen nach Chemotherapie sowie symptomatische Behandlung von Übelkeit und Erbrechen auch im Zusammenhang mit Migräne beschränkt werden. Zur Behandlung von Motilitätsstörungen, die zu Sodbrennen oder Refluxösophagitis führen, soll MCP nicht mehr indiziert sein, da auch hier der Nutzen fraglich ist.
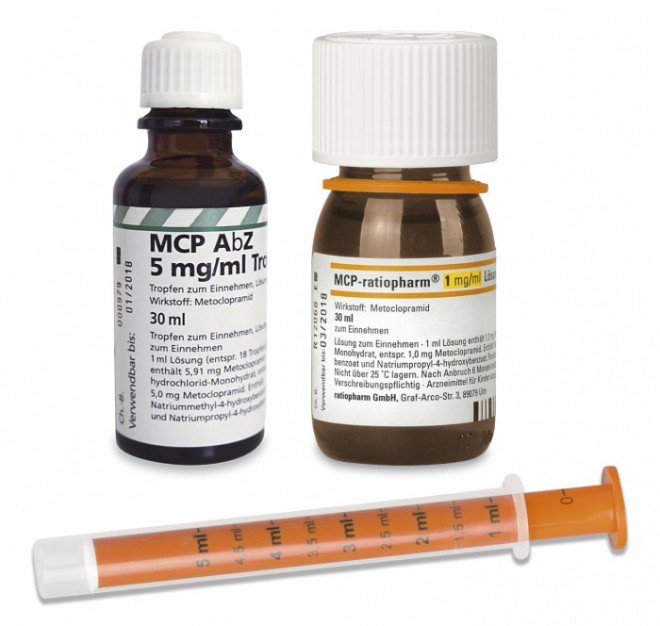
Alt (links) und neu: MCP-Tropfen sind in niedrigerer Dosierung wieder erhältlich. Dosiert wird nicht anhand der Tropfenzahl sondern mit einer graduierten Spritze.
Spritze statt Tropfer
Die Tageshöchstdosis soll auf 0,5 mg/kg Körpergewicht beschränkt werden. Die Standardeinzeldosis für Erwachsene beträgt seitdem dreimal 10 mg pro Tag (zuvor viermal 10 mg). Bei Kindern 0,1 bis 0,15 mg/kg Körpergewicht. Da es vor allem bei flüssigen Formulierungen bei Kindern zu Überdosierungen gekommen war, soll allen Präparaten mit einer Dosierung höher als 1 mg/ml die Zulassung entzogen werden. Die Verbleibenden sollen künftig mit einer graduierten Spritze verabreicht werden, um Dosiergenauigkeit zu gewährleisten.
Intravenösen Formulierungen mit einer Konzentration über 5 mg/ml sowie Zäpfchen mit über 20 mg pro Einzeldosis soll ebenfalls die Zulassungen entzogen werden.
Auf Antrag der Zulassungsinhaber wurden diese Empfehlungen noch einmal überprüft. So hatten die Firmen beispielsweise den Wunsch geäußert, die hoch dosierten oralen Liquida im Handel zu belassen und lediglich die Anwendung zu beschränken. Der CHMP erachtete dies aber nicht als ausreichend, um das Risiko für Überdosierungen bei Kindern zu reduzieren. Auch in der Tatsache, dass künftig für die Erwachsenendosis viele Tropfen zu verabreichen sind, sah der CHMP kein Problem. Seinen Empfehlungen zufolge soll künftig ohnehin mit einer Spritze nach Volumen und nicht mehr nach Tropfen dosiert werden.
Im Oktober 2013 wurden die Empfehlungen dann schließlich noch einmal bestätigt und zur endgültigen Beschlussfassung an die Europäische Kommission weitergeleitet. Am 20. Dezember 2013 wurden die Neuregelungen für MCP-haltige Fertigarzneimittel von der Europäischen Kommission verabschiedet und somit für Europa rechtsverbindlich.
Am 9. April 2014 versendete das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) einen Bescheid über die „Umsetzung des Durchführungsbeschlusses der EU-Kommission“ an die Zulassungsinghaber, in dem diese über den Widerruf der Zulassungen sowie der geänderten Anwendung informiert wurden. Am 15. April wurde dann der Rückruf aller Metoclopramid-Tropfen mit einem Wirkstoffgehalt von mehr als 1 mg/ml veranlasst.
In der Diskussion auf DAZ.online wurde neben der entstandenen therapeutischen Lücke vor allem die schlechte Informationspolitik bemängelt, aber auch die Untätigkeit der Industrie, rechtzeitig für einen Ersatz in der erlaubten Dosierung zu sorgen. Nach dem Widerruf der Zulassung war es nicht mehr möglich, MCP-Liquida mit einer Konzentration von maximal 1 mg/ml zeitnah auf den Markt zu bringen, da in einem langwierigen Verfahren Neuzulassungen beantragt werden mussten.
Hersteller waren überrascht
Seitens der Zulassungsinhaber hatte man sich von dem sofortigen Widerruf der Zulassung überrascht gezeigt. Dass der Widerruf der Zulassung als Resultat des europäischen Risikobewertungsverfahrens angeordnet werden würde, hatte man erwartet, so der Bundesverband der Arzneimittel-Hersteller (BAH). Aber man habe aufgrund der Marktsituation in Deutschland mit angemessenen Übergangsregelungen gerechnet. Da aber durch das BfArM Sofortvollzug angeordnet wurde und damit alle Präparate plötzlich nicht mehr verkehrsfähig waren, gestaltete es sich auch für die Hersteller schwer, umgehend zu reagieren, hieß es von der Seite der Zulassungsinhaber.
Auf der Suche nach Alternativen
Obwohl er eigentlich absehbar war, hat der Rückruf große Verunsicherung verursacht und gleichzeitig die Frage nach Therapiealternativen zur Behandlung von Übelkeit und Erbrechen aufgeworfen. So waren MCP-Tabletten, -Zäpfchen und -Injektionslösungen zwar weiterhin verfügbar und unter Beachtung der zugelassenen Indikation verordnungsfähig, eine individuelle orale Dosierung war so allerdings nicht mehr möglich. Eine Alternative zu MCP ist Domperidon. Die Substanz steht neben Tabletten auch als Lösung zur Verfügung. Allerdings wurde auch hier die Anwendung beschränkt – wegen kardialer Nebenwirkungen wie QT-Strecken-Verlängerung. Domperidon darf demnach nur noch bei Übelkeit und Erbrechen, aber nicht mehr bei Blähungen oder Sodbrennen zum Einsatz kommen. Außerdem wurde auch die Anwendungsdauer von Domperidon beschränkt – auf eine Woche.
Um die Lücke zu schließen, wurde vom DAC/NRF kurzfristig ein MCP-Rezepturhinweis zur Verfügung gestellt – jedoch mit der Anmerkung, dass es sich dabei um eine nicht geprüfte Rezeptur handele. In der aktuellen Ergänzungslieferung des DAC/NRF ist jetzt eine geprüfte Vorschrift zur Herstellung von MCP-Tropfen enthalten.
Ende Juli 2015 kam dann die von vielen lang ersehnte Nachricht: MCP-Tropfen kommen zurück. Seit 1. August sind mit MCP ratiopharm und MCP AbZ die ersten beiden oralen MCP-Liquida mit einer Dosierung von 1 mg/ml in Deutschland in zwei Packungsgrößen (30 ml und 100 ml) verfügbar. Sie wurden in einem dezentralen Verfahren zugelassen. Weitere werden folgen, beim BfArM sind noch mehrere Zulassungsverfahren anhängig.
Welchen Stellenwert MCP künftig haben wird, bleibt abzuwarten. Ein etwas weniger sorgloser Umgang, als es in der Vergangenheit zumindest vereinzelt der Fall war, wäre aber wünschenswert. |
Quellen:
Information importante sur le bon usage de primperan; 10/2010; http://ansm.sante.fr/
Point d’information sur les dossiers discutés en commission d’AMM; Séance du jeudi 13 octobre 2011; http://ansm.sante.fr/
European Medicines Agency recommends changes to the use of metoclopramide; Pressemitteilung der EMA vom 26.07.2013
Assessment report: Metoclopramide only containing medicinal products; 20.12.2013; http://www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/Metoclopramide_31/WC500160356.pdf
Bescheid des BfArM an die Zulassungsinhaber vom 09.04.2014; http://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Risikoinformationen/RisikoBewVerf/m-r/metoclopramid_zusammenfassung.pdf?__blob=publicationFile&v=3
Presseinformation der Teva GmbH vom 29.07.2015




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.