
- DAZ.online
- DAZ / AZ
- DAZ 30/2015
- Cannabis als Arznei
Cannabis
Cannabis als Arznei
Vergleich der therapeutischen Anwendung in Deutschland und der Schweiz

Geschichte
Bis zur Mitte des 19. Jahrhunderts war Cannabis sativa in Europa vor allem als Faserpflanze bekannt. Die medizinische Verwendung dieser Pflanze beschränkte sich fast ausschließlich auf die Verwendung von Hanfsamen und das daraus gewonnene Hanfsamenöl. Einen erweiterten Blickwinkel hatte bereits Samuel Hahnemann im Jahr 1797:
„Obgleich bisher blos die Samen im Gebrauche gewesen sind, so scheinen doch andre Theile der Pflanze wirksamer zu seyn und höhere Aufmerksamkeit zu verdienen.“ [1]
Im Jahr 1839 veröffentlichte der in Kalkutta stationierte irische Arzt William Brooke O‘Shaugnessy eine umfassende Studie mit dem Titel „On the Preparations of the Indian Hemp or Gunjah“. Ihr ist es hauptsächlich zu verdanken, dass sich der Hanf in der europäischen Schulmedizin etablieren konnte. Zusammenfassend urteilte O’Shaugnessy aufgrund seiner Erfahrungen: „Ich glaube, dass dieses Heilmittel ein Antikonvulsivum von größtem Wert ist.“ [2] Danach erschien eine Vielzahl von wissenschaftlichen Arbeiten über den Hanf als Arzneipflanze – der Startschuss zu einer vielversprechenden Karriere war gefallen.
Hanfkraut und seine Zubereitungen (Cannabistinktur, Cannabisextrakt) wurden in die Arzneibücher Europas aufgenommen. Die aufstrebende pharmazeutische Industrie stellte Cannabisextrakt und andere Halbfabrikate (z. B. Cannabinon) zur pharmazeutischen Weiterverarbeitung her und brachte auch einige Spezialitäten auf den Markt. Typische Indikationen waren Schlafprobleme, Asthma und krampfartige Schmerzen. In der Apotheke wurde Cannabisextrakt oft zu Pillen verarbeitet, z. B. nach folgendem Rezept [3]:
Extractum Cannabis indicae
Herba Cannabis indicae aa 2,5
M.f.pil. Nr. C
D.S. Bei Schlafproblemen, abends 4 Pillen
Indischer Hanf
Der wissenschaftliche Name Cannabis indica, Indischer Hanf, stammt von dem französischen Botaniker Jean Baptiste Lamarck (1744 – 1829), der ihn damit von dem in Europa angebauten Hanf C. sativa unterschied. Heute ist umstritten, ob es sich um eigene Arten (Spezies) oder um zwei Unterarten (Subspezies) derselben Art handelt. Unabhängig von der Stammpflanze wird „Indischer Hanf“ im Deutschen häufig als Synonym für Rausch- oder Drogenhanf verwendet, z. B. auch in der Homöopathie.
Die Zeit von 1880 bis 1900 kann als eigentlicher Höhepunkt der Verwendung von Cannabis als Arzneimittel bezeichnet werden. Danach ging der Gebrauch allmählich zurück, wofür vor allem vier Gründe zu nennen sind:
- der medizinisch-pharmazeutische Fortschritt,
- die Instabilität der Hanfpräparate,
- rechtliche Einschränkungen bis hin zum Verbot,
- Probleme bei der Beschaffung der Droge [4].
Zum endgültigen Verschwinden der Cannabispräparate führte das 1961 verabschiedete internationale Einheitsabkommen über die Betäubungsmittel (Single Convention on Narcotic Drugs). Einzig die wissenschaftliche Erforschung von Cannabinoiden war noch erlaubt.
Seit der Entdeckung der Cannabinoid-Rezeptoren CB1 (im Jahr 1990) und CB2 (1993) ist das Interesse für die Wirkung von Cannabinoiden wieder stark gestiegen. Dank der neuen Erkenntnisse werden Hanf und dessen Hauptwirkstoff, das ∆-9-Tetrahydrocannabinol (THC), wieder als Therapieoption akzeptiert – trotz der immer noch schwierigen betäubungsmittelrechtlichen Situation. So ist Dronabinol (internationaler Freiname von THC, der aber meistens für (partial-)synthetisches THC verwendet wird) seit 1998 in Deutschland als BtM verordnungsfähig, und vor wenigen Jahren erhielt ein Cannabisextrakt in Sprayform (Sativex®) die Zulassung in den meisten europäischen Staaten (in Deutschland 2011, in der Schweiz 2014). Das Dronabinol-Fertigpräparat Marinol® und Präparate mit dem THC-Derivat Nabilon (Cesamet®, Canemes®) sind aber weder in Deutschland noch in der Schweiz zugelassen.
Vergleich: Deutschland und die Schweiz
In Deutschland wie in der Schweiz sind die betäubungsmittelrechtlichen Hürden so groß, dass Verschreibungen von Cannabis- oder THC-haltigen Arzneimitteln immer noch eine Ausnahme darstellen. In Deutschland sind derzeit folgende, dem BtM-Recht unterstehende Präparate zugelassen:
- das Oromukosalspray Sativex® zur Behandlung von schwerer Spastik bei Patienten mit multipler Sklerose und
- Rezepturarzneimittel (Kapseln und ölige Tropfen) mit Dronabinol (NRF 22.7. und NRF 22.8.).
In besonderen Fällen kann beim BfArM bzw. bei der Bundesopiumstelle ein Antrag gestellt werden, natürliche Cannabispräparate (z. B. Hanfblüten) unter ärztlicher Begleitung einzusetzen [5]. Die Absicht der Bundesregierung, Cannabispräparate als normale rezeptpflichtige Arzneimittel einzustufen, wird von den meisten Fachleuten begrüßt, stößt aber auch auf Kritik [13].
In der Schweiz erlaubt das Schweizerische Betäubungsmittelgesetz seit dem 1. Juni 2011 grundsätzlich das Verwenden von natürlichen Cannabinoiden. Daher sind neben dem THC (synthetischen oder natürlichen Ursprungs) und dem registrierten Fertigpräparat Sativex® auch die Magistralrezepturen Cannabistinktur (Cannabis extractum fluidum normatum) und Cannabisöl (sog. Sativa-Öl) verordnungsfähig. Wie beim THC ist dafür eine Ausnahmebewilligung des Bundesamtes für Gesundheitswesen (BAG) nötig (Tab. 1).
Präparat |
Cannabinoid-Gehalt* |
Deutschland |
Schweiz |
|---|---|---|---|
|
Sativex® Spray
|
2,7 mg THC und 2,5 mg CBD pro Sprühstoß |
seit 2011 als BtM zugelassen |
seit 2014 als BtM zugelassen |
Dronabinol-Rezepturen(Kapseln, ölige Tropfen, Inhalationslösung) |
2,5 / 5 / 10 mg THC pro Kapsel (NRF 22.7.) oder
25 mg THC pro ml (NRF 22.8.)
|
seit 1988 als BtM verordnungsfähig |
seit 2008 mit BAG-Ausnahmebewilligung als BtM verordnungsfähig |
|
Cannabistinktur
(Magistralrezeptur)
|
10 mg THC und 19 mg CBD pro ml |
nicht verordnungsfähig |
seit 2012 mit BAG-Ausnahmebewilligung als BtM verordnungsfähig |
|
Cannabisöl
(Magistralrezeptur)
|
10 mg THC und 3 mg CBD pro ml |
nicht verordnungsfähig |
seit 2015 mit BAG-Ausnahmebewilligung als BtM verordnungsfähig |
Cannabisblüten |
bis 19% THC |
in Ausnahmefällen verordnungsfähig |
nicht verordnungsfähig |
* THC = ∆-9-Tetrahydrocannabinol; CBD = Cannabidiol
| |||
Indikationen
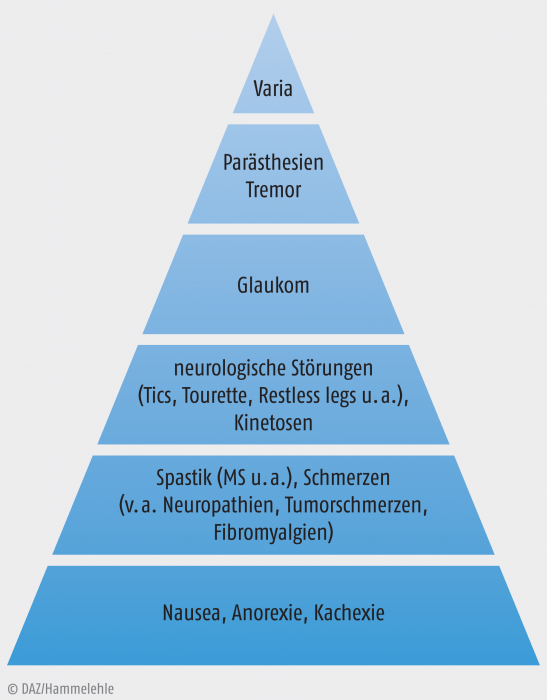
Die Anwendungsgebiete für Cannabinoide sind ausgesprochen vielseitig. Die Grafik veranschaulicht die wichtigsten Indikationen (Abb. 2). An der Basis der Pyramide stehen die etablierten, durch wissenschaftlich anerkannte Studien belegten Indikationen, weiter oben stehen vor allem erfahrungsmedizinische Anwendungen für Cannabis.
Abb. 2: Indikationen von Cannabinoid-haltigen Arzneimitteln; Evidenz von unten nach oben abnehmend.
Obschon die Indikationen Nausea, Anorexie und Kachexie am besten dokumentiert sind, dominieren in der Praxis die Anwendung bei Spastik und Schmerzen, gefolgt von neurologischen Störungen (vgl. Abb. 3). Unter Varia finden sich u. a. Juckreiz, entzündliche Darmerkrankungen und Schlafstörungen.
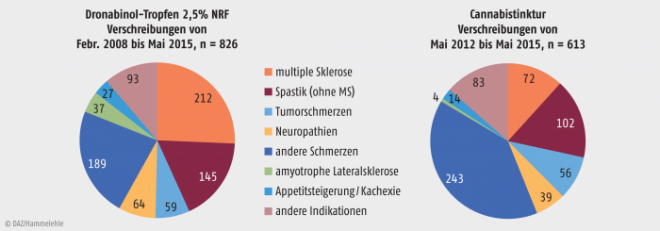
Abb. 3: Verschreibung von öligen Dronabinol-Tropfen NRF und Cannabistinktur in der Schweiz seit der Legalisierung bis 2015 (vgl. Tab. 1). Anzahl der Verschreibungen mit Indikationen, die in der Pionierapotheke verabfolgt wurden. Die in der zweiten Apotheke (ab 2012) eingelösten Rezepte für ölige Dronabinol-Tropfen sind hier nicht erfasst.
In den letzten Jahren häufen sich Hinweise, dass Cannabinoide (vor allem THC und CBD, s. u.) tumorhemmende Effekte haben können [6]. Demgemäß gibt es in der Apothekenpraxis mehr Anfragen zu Cannabis und Krebs vonseiten der Patienten wie auch der Ärzte.
Verordnungsstatistik in der Schweiz
Zwei Grafiken zeigen das Verschreibungsmuster der Cannabispräparate Ölige Dronabinol-Tropfen 2,5% bzw. 25 mg/ml (NRF 22.8.) und Cannabistinktur in der Schweiz in einem mehrjährigen Zeitraum (Abb. 3). Während der ersten Jahre (2008 bis 2011) liefen sämtliche Dronabinol-Verschreibungen über eine einzige dazu autorisierte Apotheke (Pionierapotheke), danach kam ein weiterer Anbieter dazu, dessen Rezepturen nicht in die der Grafik zugrunde liegende Statistik eingegangen sind. Die Cannabistinktur wurde nur in der Pionierapotheke abgegeben, sodass diese Grafik sämtliche Patienten, die damit in der Schweiz behandelt wurden, erfasst. Von dem erst seit 2015 verordnungsfähigen Cannabisöl, das hauptsächlich von Patienten mit amyotropher Lateralsklerose angewandt wird, gibt es bisher keine Statistik.
Die Dronabinol-Lösung und die Cannabistinktur werden bei den gleichen Indikationen verschrieben, allerdings mit verschiedenen Schwerpunkten. Cannabistinktur wird vor allem als Schmerzmittel eingesetzt, Dronabinol hingegen bevorzugt zur Behandlung von Spastik bei Patienten mit oder ohne MS. Weil Cannabistinktur das entzündungshemmende Cannabidiol enthält, kann sie für gewisse Schmerzpatienten vorteilhafter sein als das reine THC.
Wirkstoffe und Wirkprinzipien
Für die meisten bekannten Wirkungen (und Nebenwirkungen) ist das THC verantwortlich. In den letzten Jahren ist auch ein anderes Cannabinoid, das Cannabidiol (CBD), vermehrt ins Interesse der Forschung gerückt. Anders als das THC ist CBD nicht psychoaktiv und untersteht auch nicht dem Betäubungsmittelgesetz. CBD allein wird vor allem zur Behandlung von speziellen Formen der Epilepsie bei Kindern (z. B. Dravet-Syndrom) eingesetzt. Zurzeit laufen Studien, um ein Medikament mit dieser Indikation auf den Markt zu bringen.
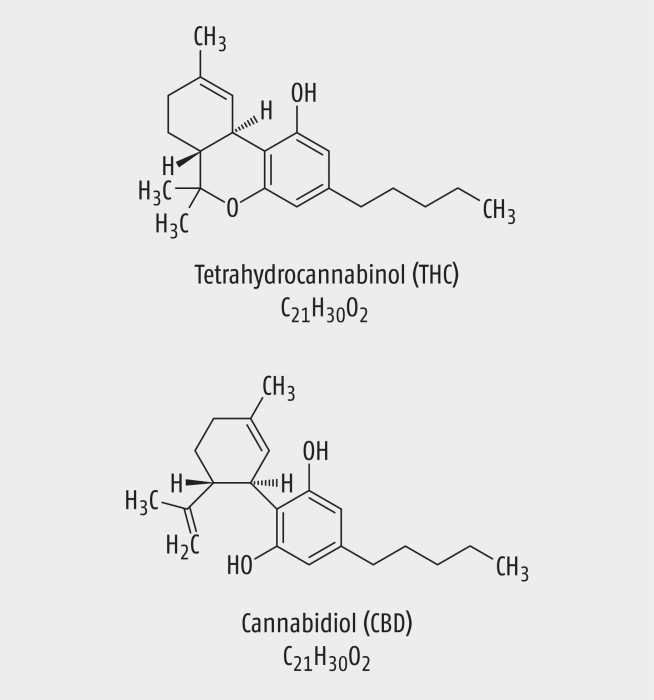
Die pharmakologischen Wirkungen von THC und CBD kommen insbesondere durch die Bindung an CB1 - und CB2 -Rezeptoren zustande [7]. Neueste Erkenntnisse zeigen auch andere Wirkprinzipien, z. B. die entzündungshemmenden Eigenschaften des CBD, welche auf der Aktivierung bzw. Hemmung unterschiedlicher Zytokine (Interleukin 10 und Interleukin 17) beruhen [9]. Interessanterweise sind die beiden Moleküle THC und CBD Strukturisomere, d. h. sie weisen dieselbe Summenformel und Molekularmasse auf (Abb. 4). Trotzdem sind ihre pharmakologischen Wirkungen zum Teil verschieden oder sogar gegensätzlich: THC ist psychoaktiv, CBD wirkt antipsychotisch.
Dosierung
Cannabispräparate werden gemäß ihrem THC-Gehalt dosiert. Die Dosierung schwankt erheblich von 5 bis 50 mg pro Tag. Das liegt einerseits an der Indikation (Tab. 2), andererseits an dem individuell unterschiedlichen Ansprechen: Was bei dem einen Patienten noch keine Wirkung zeigt, kann bei dem anderen bereits zu unerwünschten Arzneimittelwirkungen führen. Daher muss bei jedem Patienten die ideale Dosierung individuell eruiert werden. Zudem spielt es eine Rolle, ob ein Vielstoffpräparat (z. B. Sativex® oder Cannabistinktur) oder ein Präparat mit THC als Reinsubstanz angewendet wird (z. B. ölige Dronabinol-Tropfen).
| Indikation | Typische Tagesdosis | Tagesdosis (Bereich) |
|---|---|---|
| Kachexie, Anorexie | 5 mg | 5 – 20 mg |
| Spastik (Patienten mit und ohne MS) | 15 mg | 5 – 30 mg |
| Schmerz | 15 mg | 5 – 50 mg |
| Übelkeit und Erbrechen | 30 mg | 10 – 50 mg |
| Bewegungsstörungen (Restless legs, Parkinson, Tics, Tourette u. a.) | 15 mg | 10 – 30 mg |
| Glaukom, Asthma u. a. | – | 10 – 50 mg |
Unerwünschte Arzneimittelwirkungen, Abhängigkeitspotenzial, Interaktionen
Da praktisch in allen Organen des menschlichen Körpers Cannabinoid-Rezeptoren vorhanden sind, können Cannabispräparate eine Vielzahl von unerwünschten Wirkungen auslösen. In therapeutischen Dosen wird Cannabis allerdings im Regelfall sehr gut vertragen. Es kommt selten vor, dass man eine Cannabis-Therapie wegen Nebenwirkungen abbrechen muss.
Die möglichen unerwünschten Effekte sind stark dosisabhängig und betreffen vor allem das zentrale Nervensystem und das Herz-Kreislauf-System. Die Angst vor psychischen „High“-Effekten ist in der Regel unbegründet, da psychotrope Effekte bei Erwachsenen durchschnittlich ab 10 bis 20 mg THC (orale Einzeldosis) auftreten [10]. Die therapeutisch wirksame Dosis ist bei den meisten Patienten viel niedriger, und eine höhere Tagesdosis wird auf zwei oder mehrere Einzeldosen verteilt.
Die am häufigsten auftretenden unerwünschten Arzneimittelwirkungen sind: Müdigkeit, Schläfrigkeit, Abnahme der kognitiven Fähigkeiten, Koordinationsstörungen (orthostatische Hypotonie, Schwindel), des Weiteren akute Symptome wie Mundtrockenheit, Tachykardie, gerötete Augen [11, 12].
Bei therapeutischer Dosierung von Cannabispräparaten gelten eine körperliche oder psychische Abhängigkeit und Toleranzentwicklung als vernachlässigbar. Werden THC-haltige Präparate längere Zeit in einer höheren Dosis eingenommen, sind vereinzelt Entzugssymptome möglich, welche aber innerhalb weniger Tage komplett verschwinden [14].
Cannabis und Dronabinol (THC) wurden in Kombination mit einer Vielzahl von Medikamenten eingesetzt, ohne dass klinisch relevante Wechselwirkungen auftraten. Von praktischer Bedeutung sind vor allem die Verstärkung des sedierenden Effektes anderer Stoffe (Benzodiazepine, Alkohol) und die Wechselwirkung mit Substanzen, die auf das Herz wirken (Betablocker, Diuretika, trizyklische Antidepressiva u. a.).
Bestimmte additive Effekte können erwünscht sein, z. B. die Steigerung der schmerzlindernden Effekte der Opiate.
Die akute Toxizität von THC spielt in der Therapie keine Rolle: Die niedrigste toxische Dosis (oral) liegt bei 60 mg THC/kg KG während 20 Tagen, und eine tödliche Dosis beim Menschen ist nicht bekannt [18].
Kontraindikationen
Eine absolute Kontraindikation ist eine Allergie gegen THC, die aber nur sehr selten auftritt. Falls Patienten auf Cannabispräparate allergisch reagieren, sind dafür eher andere Inhaltsstoffe der Hanfpflanze verantwortlich.
Als relative Kontraindikationen gelten: schwere psychiatrische Erkrankungen (z. B. Schizophrenie, schwere Depressionen), schwerwiegende Herzerkrankungen, Schwangerschaft und Stillzeit. Bei Kindern sollten Cannabispräparate nur in Ausnahmefällen eingesetzt werden (z. B. bei schwerer, sonst nicht behandelbarer Spastik) [15, 16].
Ausblick
In den letzten Jahren haben sich Cannabispräparate in Deutschland und der Schweiz einen Platz in der Therapie zurückerobert, wobei es derzeit noch Unterschiede in der betäubungsmittelrechtlichen Einstufung und der Verschreibungspraxis gibt. Hier wie dort engagieren sich politische Entscheidungsträger, Heilberufler und Patienten, dem Hanf als Arzneimittel den Weg zu ebnen. Es ist gut möglich, dass in absehbarer Zeit die therapeutische Anwendung von Cannabispräparaten nichts Ungewöhnliches mehr darstellt. Wie schrieb bereits vor über 100 Jahren Hastings Burroughs in seiner Dissertation [17]:
„In therapeutischen Dosen ist der indische Hanf ungefährlich und hätte es verdient, vermehrt angewendet zu werden.“ |
Literatur
[1] Hahnemann S. Neues Edinburger Dispensatorium, Erster Theil. Leipzig 1797:266
[2] O’Shaughnessy WB. On the preparations of the Indian hemp, or Gunjah. Trans Med Phys Soc Bengal 1838-40;71:421-461. Reprint in: Mikuriya TH (Ed). Marijuana: Medical papers 1839–1972. Oakland 1973:3 – 30
[3] Liebreich O, Langgaard A. Medicinisches Recept-Taschenbuch. Berlin 1884:293
[4] Fankhauser M. Haschisch als Medikament: Zur Bedeutung von Cannabis sativa in der westlichen Medizin. Langnau 2002:129 – 131
[5] Volk R-B. Therapeutische Optionen mit Cannabis und Cannabinoiden: ein Überblick. Z Phytother 2011:32:202 – 208
[6] Sanchez C. Krebserkrankungen – Cancer, in: Cannabinoide in der Medizin – eine Option? Schweizer Arbeitsgruppe für Cannabinoide in der Medizin, Bern 2013:10
[7] Grotenhermen F. Hanf als Medizin. Ein praxisorientierter Ratgeber. Solothurn 2015:40 – 52
[8] THC Pharm. Therapie mit Cannabinoiden, Dronabinol als Rezeptursubstanz in der Praxis, Informationen für Fachkreise, 3. Aufl. Frankfurt 2012:10 – 11
[9] Kozela E, et al. Cannabinoids decrease the th17 inflammatory autoimmune phenotype. J Neuroimmune Pharmacol 2013;8:1265 – 76
[10] Arbeitsgemeinschaft Cannabis als Medizin. ACM-Magazin 2015. Rüthen 2015:9
[11] Grotenhermen (wie [7]):130 – 131
[12] Kleiber D, Kovar KA. Auswirkungen des Cannabiskonsums, eine Expertise zu pharmakologischen und psychosozialen Konsequenzen. Stuttgart 1998:87
[13] Trauner S. Cannabis auf Rezept: „Für einen allgemeinen Einsatz fehlt uns die Datengrundlage“. Spiegel online vom 2. 3. 2015
[14] Grotenhermen F, Reckendrees B. Die Behandlung mit Cannabis und THC. Solothurn 2014:50
[15] Lorenz R. Bei neurologischen Erkrankungen: Therapieoption Cannabis. Pädiatrie hautnah 2003;15:390
[16] Gottschling S. Cannabinoide bei Kindern: Gute Erfahrungen bei Schmerzen, Spastik und in der Onkologie. Angew Schmerzther Palliativmed 2011;4:55 – 57
[17] Burroughs H. Le chanvre indien (Cannabis indica). St.-Etienne 1886
Autor
Manfred Fankhauser
Bahnhof Apotheke Langnau AG
Dr. M.+ B. Fankhauser-Jost
Dorfstr. 2
CH 3550 Langnau























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.