
- DAZ.online
- DAZ / AZ
- DAZ 25/2015
- Ernährung auf Intensiv
Ernährung auf Intensiv
Wichtiger Baustein in der Therapie kritisch Kranker
Historische Entwicklung
Die Intensivmedizin in ihrer modernen Struktur ist nicht mehr nur in der Lage, die Überwachung und Behandlung derjenigen Patienten zu gewährleisten, deren Vitalfunktionen gefährdet oder gestört sind. Vielmehr erhalten Schwer- und Schwerstkranke heute regelhaft auch Therapiemaßnahmen, die Störungen im Stoffwechsel, Säure-Base-, Elektrolyt- und Wasserhaushalt sowie der Nierenfunktion beheben [1]. Hierzu gehören auch die Möglichkeiten der intra- und extrakorporalen Beatmung sowie sämtliche Organersatzverfahren [2]. Ernährung bzw. ernährungstherapeutische Maßnahmen hingegen standen in der Intensivmedizin lange im Hintergrund, da sie nicht der akuten Notfallsituation dienen, sondern erst nach einer gewissen Zeit essenziell werden [3].
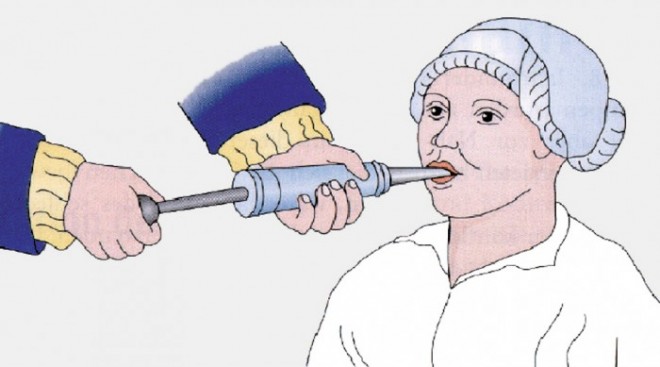
Abb. 1: Injektionsspritze zur Applikation von Medikamenten und Nahrung, Lehrbuch aus dem Jahre 1695 [28].
Chirurgen und Anästhesisten konnten Schwerkranke in vergangenen Jahrhunderten meist mit nur wenigen invasiven Methoden und entsprechendem Monitoring behandeln [2]; Resorptionsmechanismen des Darmes waren noch nicht bekannt [4]. Es gab Tuben aus Gummi [2], Silberkanülen und Injektionsspritzen (Abb. 1), mit denen Nahrung in den Pharynx bzw. Oesophagus oder rektal über einen Nährklistier (Einlauf) appliziert wurde [4]. Künstliche Ernährung gab es allenfalls über periphere Venenzugänge (Venae sectio) [2], „enterale“ Ernährung kam für Chirurgen und Anästhesisten aus Sorge über Komplikationen wie postoperatives Erbrechen oder Anastomosen-Insuffizienzen nicht infrage [5, 6]. Zudem wurden nicht-standardisierte, selbst hergestellte sogenannte Nährgetränke angeboten [2]. Diese kamen einzig für wache Patienten in Frage und wiesen mit heutiger Betrachtung in punkto Keimzahl und Nährstoffgehalt meist keine wirkliche Unterstützung für die schwer kranken Patienten auf.
Die ersten in den 1970er- und 1980er-Jahren entwickelten Nähr- und Infusionslösungen beinhalteten komplexe hochmolekulare Inhaltsstoffe für die enterale und parenterale Zufuhr [7]. Ziel war es unter anderem, die Stickstoffbilanz positiv zu beeinflussen. Moderne Nähr- und Infusionslösungen fokussieren mit ihrer definierten Zusammensetzung von Makro- und Mikronährstoffen die Stoffwechselregulation und vor allem Immunmodulation des Intensivpatienten [7]. Mit speziellen Substraten in meist pharmakologischen Dosierungen (Glutamin, ω3-Fettsäuren) werden der Stressstoffwechsel und seine Auswirkungen auf das Immunsystem des kritisch Kranken berücksichtigt.
Postaggressionsstoffwechsel – das „Notfallprogramm“ des kritisch Kranken
Da sich das Patientenklientel der kritisch Kranken hinsichtlich Diagnose und Krankheitsschwere meist sehr differenziert darstellt, sind auch die metabolischen Funktionen als Grundlage einer Ernährungstherapie sehr unterschiedlich [8]. Observationspatienten sind in der Regel nur für eine kurze Zeit auf der Intensivstation, sodass Besonderheiten hinsichtlich des Postaggressionsstoffwechsels meist nur in wenigen Fällen berücksichtigt werden müssen [9]. Screening und Monitoring ebenso wie fundierte ernährungsmedizinische Behandlung müssen diejenigen Intensivpatienten erfahren, deren Zustand bedrohlich ist oder werden könnte [9]. Akute Erkrankungen, Infektionen, Intoxikationen oder zeitintensive schwere Operationen verursachen im Organismus Stress, der sich unterschiedlich schwer und mit phasenhaftem Verlauf auf das Stoffwechselgeschehen des Intensivpatienten auswirkt (Abb. 2). Diese pathophysiologische Stressreaktion wird als „Gesamtkörperinflammationssyndrom“ (systemic inflammation response syndrome, SIRS) bezeichnet [2, 10].
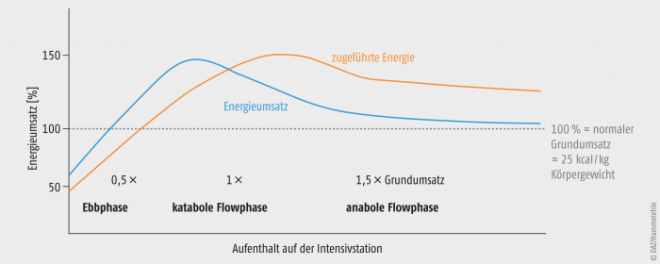
Abb. 2: Energieumsatz in den verschiedenen Phasen des Postaggressionsstoffwechsels sowie Zufuhrempfehlung in Bezug auf den errechneten Grundumsatz; modifiziert nach [29].
Unabhängig vom auslösenden Stress-Ereignis kommt es beim SIRS zu einer hormonellen und metabolischen Stressreaktion, die zur massiven Freisetzung proinflammatorischer Mediatoren mit Auswirkungen auf den gesamten Organismus führt [7]. Dieser durch aktivierte Hormonsysteme (Katecholamine, Glukagon, Cortisol, Vasopressin) und eine Vielzahl an Mediatoren (u. a. Interleukin-1, -6, -8, TNF-α) vermittelte Hypermetabolismus zeigt sich bei kritisch kranken Patienten unter verschiedenen ernährungsmedizinischen Aspekten [7]:
- verstärkte Katabolie,
- verminderte Glucose-Verwertung (erhöhte Glucose-Toleranz),
- verstärkte endogene Synthese von Aminosäuren,
- verstärkte Freisetzung von Lipiden (Lipolyse),
- erhöhte Na- und H2O-Rückresorption.
Dauer und Intensität dieser Autoregulation variieren je nach Patient und Erkrankung über ca. 24 bis 48 Stunden. Physiologischer „Zweck“ dieses nach Traumata oder Schock ablaufenden postaggressiven Hypermetabolismus ist die Sicherung der Energiebereitstellung und die Versorgung des Körpers mit Struktureiweißen. Im Gegensatz zum Hungerstoffwechsel, dessen physiologische Anpassungen (Glukoneogenese, Glykogenolyse, Lipolyse, Proteinolyse) durch exogene Substratzufuhr rasch beendet werden, ist der Postaggressionsstoffwechsel durch exogene Nährstoffzufuhr kaum zu beeinflussen [11]. Dies muss um Rahmen der Ernährungstherapie von kritisch Kranken maßgeblich berücksichtigt werden.
Der Phasenverlauf im Postaggressionsstoffwechsel (Abb. 2) hat erhebliche Auswirkungen auf den Kohlenhydrat-, Eiweiß- und Fettstoffwechsel und beeinflusst direkt den Ernährungszustand [2]. Die drei Phasen des Postaggressionsstoffwechsels zeichnen sich durch unterschiedliche physiologische Reaktionen aus [12]:
1. Ebbphase (Aggressionsphase)
- unmittelbar nach dem Trauma (Verletzung oder Operation)
- Insulin-Mangel nach massivem Anstieg antiinsulinärer Hormone, Insulin-Resistenz und Protein-Katabolie
2. Katabole Flowphase (Postaggressionsphase)
- unzureichende Insulin-Sekretion; bei inadäquater exogener Glucose-Zufuhr vermehrte Sauerstoff- und Energie-verbrauchende Lipogenese
- Proteinkatabolie (besonders in den Muskeln) und damit negative Stickstoffbilanz
- Abbau von zerstörten immunkompetenten Zellen
3. Anabole Flowphase (Gainphase/Rekonstitutionsphase)
- wieder steigende Insulin-Sekretion und -Wirkung bis hin zur endogenen Normoglykämie
In der Ebbphase reagiert der Körper des kritisch Kranken nicht adäquat auf exogene Nahrungszufuhr, sondern auch bei exogener Zufuhr von Kohlenhydraten und Aminosäuren wird Muskulatur abgebaut. Daher ist während der Ebbphase nach einem Trauma eine Hyperalimentation kontraindiziert [7, 10, 11]. Auch in der sich anschließenden, katabolen Flowphase lässt sich die stressphysiologisch bedingte Katabolie durch exogene Nahrungszufuhr nicht gänzlich unterdrücken [7, 11, 12]. Ziel der Ernährungstherapie in dieser Phase ist es deshalb, eine durch die Katabolie potenziell entstehende Nährstofflücke zu schließen. In der anabolen Flowphase reagiert der Körper dann wieder adäquat auf eine exogene Nahrungszufuhr; daher besteht das Ziel der Ernährungstherapie hier im Ausgleich entstandener Nährstoffverluste, was durch eine erhöhte Nährstoffzufuhr sichergestellt werden muss.
Ernährungstherapeutische Konsequenzen für den Intensivpatienten
Werden die metabolischen Folgen eines SIRS nicht durch eine optimale Ernährungstherapie kompensiert, kann es bei kritisch Kranken zu Mangelernährung und erheblicher Prognoseverschlechterung kommen [7]. Tatsächlich liegt die Prävalenz der Mangelernährung bei stationären Patienten in Deutschland bei rund 25% [13], was sich wiederum direkt negativ auf die Liegezeiten, Komplikationsraten, die Mortalität und die gesamte medizinische Prognose auswirkt [14 – 16].
Energiebedarf. Eine rechtzeitig begonnene, kalorisch bedarfs- und nährstoffgerechte, optimal zusammengesetzte Ernährung ist ein entscheidender Faktor für eine möglichst kurze Beatmungszeit, eine Verkürzung der Liegedauer auf Intensivstation, eine minimierte Komplikationsrate und einen prognostisch günstigen Krankheitsverlauf bei Intensivpatienten [3, 10, 17]. Ziel ernährungsmedizinischer Maßnahmen ist es, in Abhängigkeit von der jeweiligen Phase des Postaggressionsstoffwechsels die Auswirkungen der Katabolie zu verringern und eine Mangelernährung zu verhindern [7]. Dies beinhaltet grundsätzlich die Vermeidung sowohl einer Hyper- als auch einer Hypoalimentation, da beide Ernährungsformen zum jeweils falschen Zeitpunkt negative Folgen haben können [3, 8, 10]: Eine unzureichende Energiezufuhr führt ebenso zu einer erhöhten Mortalität wie eine zu hohe Energiezufuhr [18, 19]. Das primäre Therapieziel einer intensivmedizinischen Ernährung ist daher die normokalorische Ernährung [20], wofür in allen drei Phasen des Postaggressionsstoffwechsels eine Energiemenge von 25 kcal/kg Körpergewicht/d als Berechnungsgrundlage verwendet wird [21]. Für diverse andere Formeln und Korrekturfaktoren zur individuelleren Berechnung des Energiebedarfes konnten bislang keine relevanten Vorteile belegt werden [22].
Proteine. Die durch den Postaggressionsstoffwechsel reduzierten Körpereiweißspeicher müssen bei der Proteinzufuhr berücksichtigt werden. Defizitäre Muskelarbeit, z. B. der Herz- oder Atemmuskulatur, erschwert das Mobilisieren und das Weaning (Beatmungsentwöhnung) der Intensivpatienten [10]. Als optimal gilt derzeit eine Proteinzufuhr von 1,5 bis 2 g/kg Körpergewicht/Tag in allen drei Phasen des Postaggressionsstoffwechsels [3, 21]. Besonders gegen Ende der Flowphase kann eine eher hohe Proteinzufuhr (2 g/kg Körpergewicht/Tag) Vorteile aufweisen [10]; eine darüber hinausgehende, höhere Eiweißzufuhr führt zu vermehrter Thermogenese und Harnstoffproduktion, was bei kritisch Kranken eher ungünstig ist [11].
Die adäquate Zufuhr an Kohlenhydraten (und Fetten) unterstützt die optimale Verwertung der Aminosäuren. Extreme Blutzuckerschwankungen müssen dringend vermieden werden, weshalb während des gesamten Postaggressionsstoffwechsels eine kontinuierliche Blutzuckermessung unentbehrlich ist [10, 11]. Zielwert für die Blutzuckerkonzentration unter exogener Glucose-Zufuhr sollte < 150 mg/dl sein, und das metabolisches Monitoring sollte parallel Triglycerid- und Harnstoffwerte mit einschließen [7] (siehe Kasten „Metabolisches Monitoring“). Die leitliniengerechte Kohlenhydrat- bzw. Glucose-Zufuhr liegt bei 3 bis 5 (max. 7) g/kg Körpergewicht/Tag [3, 21].
Metabolisches Monitoring im Rahmen der Ernährungstherapie
Für die aufgrund von Operationen, Traumata oder schweren Erkrankungen vorliegende Ausnahmesituation des kritisch Kranken sind die kontinuierliche Überwachung, das Erfassen von z. B. Atmung und Körpertemperatur sowie das metabolische Monitoring unentbehrlich [30]. Dieses ermöglicht eine weitgehend individuelle Abstimmung der Ernährung für den einzelnen kritisch Kranken. Individuelle Ernährungstherapie erscheint dadurch jedoch nicht nur effektiv, sondern auch kompliziert und zeitaufwändig – was aber nicht grundsätzlich gegen die Individualisierung der Ernährungstherapie spricht, da dasselbe auch für intensivmedizinische Standardverfahren wie die Beatmung oder die Dialyse gilt [10].
- Parameter täglich: Blutglucose, Natrium, Kalium, Chlorid, Calcium, Magnesium, Phosphat, Laktat, Creatinin, Harnstoff im Serum, Blutgas-Analyse
- Parameter zwei- bis dreitägig: Triglyceride, Lipase, γ-Glutamyltransferase (γ-GT), alkalische Phosphatase (AP) im Serum
- Parameter einmal wöchentlich: Differentialblutbild, Gesamteiweiß, Albumin, Cholesterinesterase, Gerinnung
Fette. Die empfohlene „Nicht-Protein-Energiezufuhr“ sollte mit 25 bis 40% in Form von Fetten gedeckt werden [11]. Durch die direkte Verwertung der Fettsäuren als primäre Energiequelle z. B. im Myokard und in der Skelettmuskulatur wird als maximale Zufuhrmenge 1,2 bis 1,7 g/kg Körpergewicht/Tag angegeben; allerdings ist hierbei die Triglycerid-Kontrolle unerlässlich, und bei Triglycerid-Konzentrationen > 400 mg/dl (> 4,6 mmol/l) muss die Zufuhrmenge angepasst, das heißt reduziert werden [11, 21]. Die in der Onkologie geführte Diskussion um eine Glucose-Reduktion zugunsten einer Erhöhung und gleichzeitigen Modifikation der zugeführten Fette findet sich auch im Zusammenhang mit den intensivmedizinischen Ernährungskonzepten wieder. Das Angebot der industriell hergestellten Lipidemulsionen trägt dieser Diskussion mit einem auf das Minimum reduzierten Anteil an langkettigen ω6-Triglyceriden sowie einem entsprechend erhöhten Anteil an mittelkettigen Triglyceriden (MCT) und ω3-Fettsäuren Rechnung [3, 11].
Vitamine und Mineralstoffe. Empfehlungen für die tägliche Zufuhr an Vitaminen und Mineralstoffen für Intensivpatienten sind in den aktuellen Leitlinien der nationalen wie internationalen Gesellschaften zu finden [3, 21].
Zufuhrweg der Nahrung
Hinsichtlich des Zufuhrwegs von Nahrung empfehlen alle nationalen und internationalen Leitlinien einhellig: „Use the gut if you can“ [21, 23]. Die enterale Ernährung ist daher wann immer möglich einer wie auch immer gearteten parenteralen Ernährung vorzuziehen; die Standardlösung der enteralen Ernährung ist eine nährstoffdefinierte Sondenkost [7]. Durch die frühzeitige und nahe an den Empfehlungen für Kalorien und Protein gehaltene enterale Ernährung können bei Sepsispatienten die Beatmungsdauer und die Mortalität gesenkt werden [24]. Zahlreiche Untersuchungen und Metaanalysen konnten zeigen, dass insbesondere bei kritisch kranken Intensivpatienten eine frühzeitige enterale Ernährung – bereits innerhalb von 48 Stunden nach Aufnahme auf die Intensivstation – mit signifikant geringeren Infektions- und Sepsisraten einhergeht [23, 25]. Grund hierfür ist, dass die enterale Ernährung entscheidend zur sogenannten „Zottenernährung“ der Darmzotten beiträgt, wodurch die Mukosabarriere aufrechterhalten und eine Translokation von Darmbakterien ins Blut verhindert wird.
Eine parenterale Ernährung erfüllt die Erfordernisse, wenn andere Zufuhrwege nicht genutzt werden können. Hierbei gilt es dringend, die mit einer Hyperalimentation verbundenen Risiken zu berücksichtigen [26, 27]. Insbesondere bei kritisch Kranken werden enterale und parenterale Ernährung mittlerweile jedoch weitestgehend als komplementäre Ansätze und nicht mehr wie früher als Entweder-oder-Konkurrenz gesehen [7].
Fazit
- Auch kritisch kranke Intensivpatienten benötigen in jedem Fall eine Ernährung.
- Moderate Hypoalimentation führt zu weniger Komplikationen als eine Hyperalimentation.
- Kalorische Hyperalimentation ist zu vermeiden.
- Die Energiebedarfsberechnung über den Schätzwert 25 kcal/kg Körpergewicht/Tag ist im klinischen Alltag ausreichend, Formel- oder Korrekturfaktorberechnungen bringen keine Vorteile.
- Die Ernährung sollte frühzeitig (bereits innerhalb 24 Stunden nach Aufnahme auf die Intensivstation) beginnen, wodurch die Liegezeit und Beatmungsdauer reduziert werden kann.
- Eine enterale Ernährung ist einer parenteralen Ernährung vorzuziehen.
- Wenn die enterale Ernährung kalorisch nicht ausreicht, ist eine supplementierende oder totale parenterale Ernährung empfohlen.
- Die Ernährung sollte zunächst mit niedriger Rate starten, um ab dem dritten bis fünften Tag langsam gesteigert zu werden.
- Eine optimale Nährstoffzusammensetzung ist noch nicht abschließend geklärt, mit Sicherheit wird die angekündigte Leitlinie der Deutschen Gesellschaft für Ernährungsmedizin zur „Ernährung Kritisch Kranker“ Hilfestellung für die Diskussion geben. |
Literatur
[1] Larsen R. Einführung in die Intensivmedizin. In: Anästhesie und Intensivmedizin für die Fachpflege. 8. vollständig überarb. Aufl. 2012, Springer. Berlin
[2] Hackl JM. Hat die Ernährung den Krankheitsverlauf bei Intensivpatienten verbessert? Persönliche Erfahrungen eines Intensivmediziners zur Ernährungstherapie. Aktuel Ernährungsmed 2009;34:215-219
[3] Druml, W. Wieviel Ernährung braucht der Intensivpatient? Sind differenzierte Strategien notwendig? 9. Refresher-Kurs Intensivmedizin in: Druml W, Jadma K (2008) AKE-Recomendations for enterale and parenteral nutrition in adults. Pocket-Version 2008-2010. AKE-Eigenverlag Wien, 2008;30-33
[4] Vinnars E, Wilmore D. History of parenteral nutrition. J Parent Enteral Nutr, 2003;27:225-232
[5] Edwards G, Morton HJV, Pask EA, Wylie ED. Deaths assicated with anaesthesia . A report on 1000 cases. Anaesthesia, 1956;11:194–220
[6] Bannister WK, Satillaro AJ. Vomiting and aspiration during anesthesia. Anesthesiology, 1962;23:251-264
[7] Felbinger TW, Richter HP (2012) Ernährung von Intensivpatienten. Nutrition of the Critically ill. Aktuel Ernährungsmed, 2012;37:36–57
[8] Kreymann KG, Berger MM, Deutz NE et al. ESPEN Guidelines on Enteral Nutrition: Intensive care. Clin Nutr, 2006;25:210–223
[9] Ovel C. Ein kritischer Blick auf die Eignung des Nutritional Risk Screening 2002 (NRS-2002) für die unterschiedlichen Patientengruppen auf der Intensivstation. Bachelorarbeit zur Erlangung des Akademischen Grades Bachelor of Science (B. Sc.) Mathias Hochschule Rheine, 2014;9-10
[10] Kampa U. Ernährung des intensivpflichtigen Patienten. Workshop „Enterale Ernährung des intensivpflichtigen Patienten- Praktische Handhabung und Komplikationsprophylaxe. Deutscher Fachpflegekongress Münster, 2014
[11] Rümelin A, Mayer K (Hrsg.). Ernährung des Intensivpatienten, 2013, Springer. Berlin
[12] Cuthberston DP. Oberservation on the disturbance of metabolism produced by injury to the limbs. Q.J.Med, 1932;1:237-246
[13] Pirlich M, Schütz T, Norman K et al. The German hospital malnutrition study. Clin Nutr, 2006;25:563–572
[14] Sorensen J, Kondrup J, Prokopowicz J et al. EuroOOPS: an international, multicentre study to implement nutritional risk screening and evaluate clinical outcome. Clin Nutr, 2008;27:340–349
[15] Villet S, Chiolero RL, Bollmann MD et al. Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin Nutr, 2005;24(4):502-509
[16] Alberda C, Gramlich L, Jones N et al. The relationship between nutritional intake and clinical outcomes in critically ill patients: results of an international multicenter observational study. Intensive Care Med, 2009;35:1728–1737
[17] Artinian V, Krayem H, DiGiovine B. Effects of early enteral feeding on the outcome of critically ill mechanically ventilated medical patients. Chest, 2006;129:960-967
[18] Krishnan JA, Parce PB, Martinez A et al. Caloric intake in medical ICU patients: consistency of care with guidelines and relationship to clinical outcomes. Chest, 2003;124:297–305
[19] Egi M, Bellomo R, Stachowski E et al. Blood glucose concentration and outcome of critical illness: the impact of diabetes. Crit Care Med, 2008;36:2249–2255
[20] Ibrahim EH, Mehringer L, Prentice D et al. Early versus late enteral feeding of mechanically ventilated patients: results of a clinical trial. JPEN J Parenter Enteral Nutr, 2002;26:174–181
[21] Singer P, Berger MM, van den Berghe G et al. ESPEN Guidelines on Parenteral Nutrition: Intensive care. Clin Nutr, 2009;28:387–400
[22] Douglas CC, Lawrence JC, Bush NC et al. Ability of the Harris Benedict formula to predict energy requirements differs with weight history and ethnicity. Nutr Res, 2007;27:194–199
[23] Berger MM, Soguel L. Feed the ICU patient ‘gastric’ first, and go post-pyloric only in case of failure. Crit Care, 2010;14:123
[24] Elke G, Wang M, Weiler N et al. Close to recommended caloric and protein intake by enteral nutrition is associated with better clinical outcome of critically ill septic patients: secondary analysis of a large international nutrition database Critical Care, 2014;18:29
[25] Heyland DK, Dhaliwal R, Suchner U et al. Antioxidant nutrients: a systematic review of trace elements and vitamins in the critically ill patient. Intensive Care Med, 2005;31:327–337
[26] Dhaliwal R, Jurewitsch B, Harrietha D et al. Combination enteral and parenteral nutrition in critically ill patients: harmful or beneficial? A systematic review of the evidence. Intensive Care Med, 2004;30:1666–1671
[27] Casaer MP, Mesotten D, Hermans G et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med, 2011;365:506–51.
[28] Dekkers F. Exercitationes practicae circa medendi methodum. Chapter V Boutesteyn, Leyden. (1695) 338 (nicht in der Erstausgabe von 1673).
[29] Kochanek M, Michels G. Repetitorium internistische Intensivmedizin. Ernährungstherapie (2010) Springer. Berlin; 65-72
[30] Wilhelm W (Hrsg.). Praxis der Intensivmedizin konkret, kompakt, interdisziplinär. 2., aktualisierte und erweiterte Auflage (2013) Springer, Berlin; 111-121
Autoren
Prof. Dr. rer. nat. Martin Smollich, Fachapotheker für Klinische Pharmazie, Antibiotic Stewardship-Experte (DGI). 1998 bis 2004 Studium von Biologie und Pharmazie in Münster und Cambridge (UK), 2005 bis 2008 wissenschaftlicher Mitarbeiter an der Universitätsfrauenklinik Münster und Promotion über ein Thema zur experimentellen Pharmakotherapie des Mammakarzinoms, 2009 bis 2013 klinische Tätigkeit und pharmakologischer Konsildienst. Seit 2013 Professor und Studiengangsleiter des Studiengangs Clinical Nutrition/Ernährungsmanagement an der Mathias Hochschule Rheine.
Wissenschaftliche Schwerpunkte:
Klinische Ernährung, Klinische Pharmakologie, Arzneimitteltherapiesicherheit und rationale Antiinfektiva-Therapie.
Dipl. med. päd. Birgit Blumenschein, Diätassistentin, 1988 bis 1990 Ausbildung zur staatlich anerkannten Diätassistentin, 1996 bis 2002 Lehrassistentin an medizinischer Fachschule, Fachbereich Diätassistenz, 1997 bis 2003 Studium der Medizinpädagogik an der Charité in Berlin. Seit 2003 selbstständig tätig in eigener Praxis, seit 2011 wissenschaftliche Mitarbeiterin an der Mathias Hochschule Rheine, Studiengangskoordinatorin des Studiengangs Clinical Nutrition/Ernährungsmanagement, B. Sc.
Wissenschaftliche Schwerpunkte:
Ernährungsmedizin mit den Schwerpunkten Gastroenterologie, Stoffwechsel und Adipositas; Gesundheitsbildung, Betriebliches Gesundheitsmanagement.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.