
- DAZ.online
- DAZ / AZ
- DAZ 22/2015
- Zwei Fliegen mit einer ...
Arzneimittel und Therapie
Zwei Fliegen mit einer Klappe
Apremilast bei Psoriasis-Arthritis und Plaque-Psoriasis wirksam
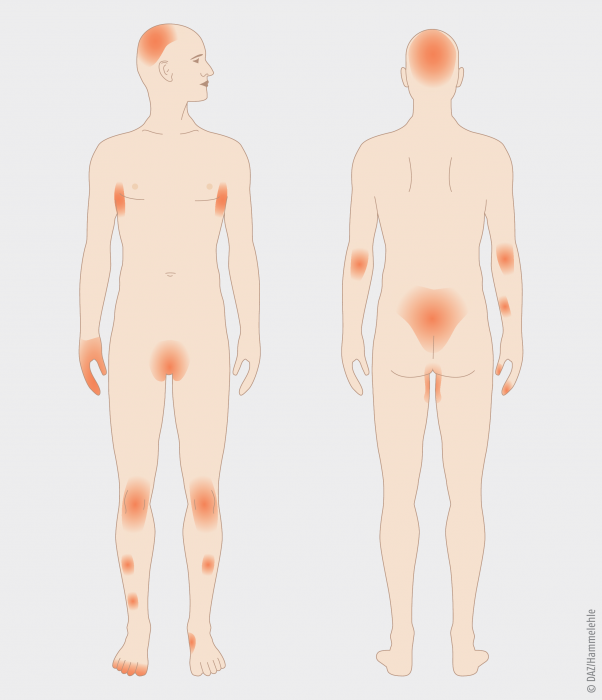
Zu den Psoriasis-Formen zählen unter anderem die Plaque-Psoriasis, welche gemeinhin als Schuppenflechte bezeichnet wird und die Psoriasis-Arthritis (PsA), welche zu den Spondyloarthropathien gehört. Beiden Psoriasis-Formen ist gemein, dass chronische Entzündungen das Krankheitsgeschehen bestimmen. Bei der Plaque-Psoriasis äußert sich die schubweise auftretende Erkrankung an prägnanten Körperstellen (siehe Abbildung 1: Kopfhaut, symmetrisch an den Außenflächen von Armen und Beinen, z. B. Ellbogen und Knien, Rücken oberhalb des Gesäßes, aber auch Finger- und Fußnägel) in Form von roten, oval-rundlichen, stark abgegrenzten und verdickten Hautstellen (Plaques), die mit trockenen, sich ständig ablösenden Schuppen bedeckt sind. Die meisten Patienten mit Plaque-Psoriasis klagen über mitunter quälenden Juckreiz. Auch wenn die Hautsymptome auf eine dermatologische Erkrankung hindeuten, fasst man die Psoriasis heute als systemische Erkrankung auf [2]. Etwa jeder fünfte Patient, der wegen einer Psoriasis behandelt wird, leidet unter einer Psoriasis-Arthritis. Dabei handelt es sich um eine in Schüben verlaufende Gelenkentzündung, die meist die peripheren Gelenke (Schultern, Hüften, Hände und Füße) betrifft und oft, aber nicht immer mit der für Schuppenflechte typischen Hautveränderung verbunden ist.
Wirkmechanismus
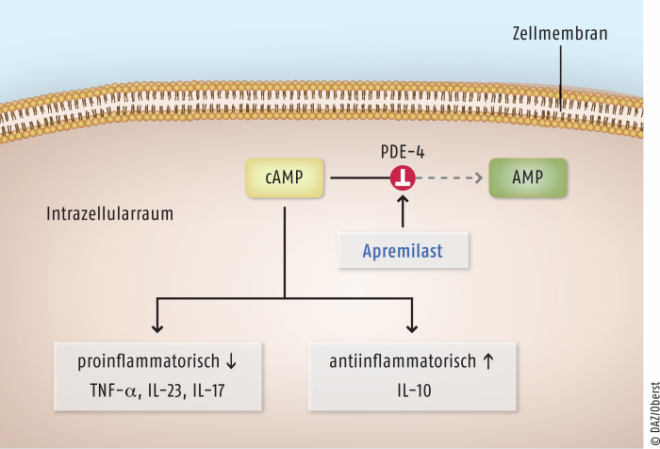
Auf molekularer Ebene wird das komplexe autoimmune Entzündungsgeschehen der Psoriasis durch vermehrte Ausschüttung proinflammatorischer Zytokine, wie dem Tumornekrosefaktor α (TNF-α), Interleukin 2, 12, 17, 22 und 23 (IL-2, IL-12, IL-17, IL-22, IL-23) aus überaktiven Immunzellen aufrechterhalten. Hier offenbart sich der Haupt-Angriffspunkt einer systemischen Therapie, weshalb die gegen TNF-α gerichteten Biologika Adalimumab (Humira®), Infliximab (Remicade®) und Etanercept (Enbrel®), der IL-12/23-Hemmer Ustekinumab (Stelara®) oder der neu zugelassene monoklonale Antikörper gegen IL-17A, Secukinumab (Cosentyx®), bei mittelschweren bis schweren Formen der Plaque-Psoriasis und zum großen Teil bei PsA im Einsatz sind. Apremilast greift ebenfalls direkt in das Entzündungsgeschehen ein, es hemmt die Phosphodiesterase-4, ein Schlüsselenzym der Zytokinproduktion, welches in Entzündungszellen eine dominante Rolle spielt [1]. Durch PDE-4-Hemmung wird der Abbau von cyclischem AMP (cAMP) zu AMP unterbunden (siehe Abbildung 2). Die in der Folge erhöhten intrazellulären cAMP-Spiegel bewirken eine reduzierte Expression von TNF-α, IL-17 und IL-23 und damit eine Eindämmung (Downregulation) der Entzündungsreaktion. Man nimmt an, dass erhöhte cAMP-Spiegel des Weiteren positive Einflüsse auf die Ausschüttung des antiinflammatorischen Zytokins IL-10 haben.
Abb. 2: Apremilast ist ein PDE-4-Hemmer, der durch Hemmung des cAMP-Abbaus den intrazellulären cAMP-Spiegel hebt. Hohe cAMP-Spiegel senken die Konzentration proinflammatorischer Zytokine wie TNF-α und IL-23 und IL-17 und erhöhen die Bildung antiinflammatorischer Zytokine wie IL-10.
Dosierung und Einnahmehinweise
Die Initiierung der Therapie sollte von Spezialisten in der Diagnose und Behandlung der Psoriasis bzw. Psoriasis-Arthritis eingeleitet werden. Bei beiden Erkrankungen wird Otezla® in der Dosierung zweimal täglich 30 mg angewendet. Die Tablette ist als Ganzes, unabhängig von einer Mahlzeit und mit einem Abstand von zwölf Stunden einzunehmen [1]. Wurde die Einnahme vergessen, sollte die Gabe so schnell wie möglich nachgeholt werden, es sei denn, der nächste Einnahmezeitpunkt ist beinahe erreicht (die Fachinformation macht keine Angabe, welcher Zeitabstand unter „beinahe“ zu verstehen ist). In der ersten Behandlungswoche ist ein initiales Titrationsschema durchzuführen (siehe Tabelle 1), für das eine Starterpackung erhältlich ist. Bei Patienten mit schwerer Nierenfunktionseinschränkung (Kreatinin-Clearance nach Cockroft-Gault < 30 ml/min) beträgt die Dosierung einmal täglich 30 mg, die initiale Dosistitration besteht dabei nur aus den morgendlichen Gaben des üblichen Titrationsschemas. Bei älteren Patienten und Patienten mit eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich. Die gleichzeitige Einnahme starker CYP3A4-Induktoren ist zu vermeiden, da diese die Apremilast-Plasmaspiegel durch Beschleunigung des Abbaus erniedrigen und zum Wirksamkeitsverlust führen (zum Beispiel Rifampicin, Phenobarbital, Carbamazepin, Phenytoin, Johanniskraut). Falls nach sechsmonatiger Behandlung keine Besserung der Symptome eingetreten ist, sollte die Therapie mit Otezla® überdacht werden.
| Tag 1 | Tag 2 | Tag 3 | Tag 4 | Tag 5 | Tag 6 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| morgens | morgens | abends | morgens | abends | morgens | abends | morgens | abends | morgens | abends |
| 10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 30 mg | 30 mg | 30 mg |
Symptombesserung bei Plaque-Psoriasis
Der Schweregrad einer Plaque-Psoriasis wird mithilfe von klinischen Parametern, die zum Beispiel im „Psoriasis Area and Severity Index“ (PASI, Index zur Beurteilung von Fläche und Schweregrad der Psoriasis) zusammengefasst sind, bestimmt [2]. Es wird dabei berücksichtigt, welche Ausprägung die Symptome Erythem (Rötung), Infiltration und Schuppung haben und welches Ausmaß diese Symptome an den betroffenen Körperoberflächen für die Regionen Kopf, Arme, Rumpf und Beine einnehmen. Zur Beurteilung der Wirksamkeit eines Medikamentes wird in Studien eine mindestens 75%-ige Reduktion des PASI (PASI 75) als klinisch und für den Patienten relevanter Parameter angesehen. Der Behandlungserfolg wird aber auch anhand einer Evaluation der Lebensqualität bemessen, da diese bei Psoriasis-Patienten oft entscheidend eingetrübt ist. Apremilast führte in den zulassungsrelevanten Studien bei Plaque-Psoriasis (ESTEEM-1 und -2) zu einer Reduktion der Epidermisdicke der betroffenen Hautareale, zu einer Reduktion der befallenen Areale an der Kopfhaut und den Nägeln sowie zu einer deutlichen Abnahme der Juckreiz-Intensität (Pruritus). Die Effekte waren bereits nach zwei- bis vierwöchiger Behandlung sichtbar und gegenüber Placebo statistisch signifikant. Insgesamt wurden 1257 Patienten eingeschlossen, unter der Therapie erreichten nach 16 Behandlungswochen 33,1% (ESTEEM-1) bzw. 28,8% (ESTEEM-2) einen PASI 75, unter Placebo schafften dies nur 5,3% bzw. 5,8%. Es konnten zudem signifikante Verbesserungen der Lebensqualität erzielt werden [1].
Wirkung auf Gelenke
In klinischen Studien zur Beurteilung der Wirksamkeit eines Medikamentes bei Psoriasis-Arthritis wird häufig die ACR20-Skala (American College of Rheumatology 20-Skala) verwendet. Diese beurteilt die Reduktion von Druckschmerz und Schwellungen in den betroffenen Gelenken um mindestens 20%. Bei Psoriasis-Arthritis wirkte Apremilast an den betroffenen Gelenken schmerzlindernd und reduzierte Schwellungen, so dass insgesamt eine Verbesserung der körperlichen Funktionsfähigkeit festgestellt werden konnte (PALACE-1 bis -3, Psoriatic Arthritis Longterm Assessment of Clinical Efficacy). In den drei Studien erreichten statistisch signifikant mehr Patienten der Verum-Gruppe (32,1 − 40,7%) nach 16 Behandlungswochen den primären Studienendpunkt, eine mindestens 20%-ige Reduktion der ACR-Skala, verglichen mit Placebo (18,3 − 19,0%) [1,4]. Zusätzlich konnten signifikante Verbesserungen der gesundheitsbezogenen Lebensqualität festgestellt werden. Eingeschlossen waren Patienten mit aktiver PsA, die trotz Vortherapie mit DMARDs (z. B. Methotrexat, Sulfasalazin, Leflunomid, TNFα-Blocker) an ≥ 3 geschwollenen Gelenken und ≥ 3 druckschmerzempfindlichen Gelenken litten.
Langzeiteffekte
Auch nach 32 (Plaque-Psoriasis) bzw. 52 (PsA) Behandlungswochen konnten die positiven Effekte von Apremilast aufrechterhalten bzw. gesteigert werden. Mehr als die Hälfte der PsA-Patienten (54,6%), die Apremilast in der Standarddosierung von 2x täglich 30 mg über einen Zeitraum von 52 Wochen erhielten, zeigten ein Ansprechen auf die Therapie, gemessen am ACR20 [5]. Nach 16 Behandlungswochen erzielten 38,1% der Patienten diesen Wert. Eine Einschätzung der möglicherweise gesteigerten Wirksamkeit nach 52 Behandlungswochen muss aber immer im Kontext der schubweise verlaufenden Erkrankung gesehen werden. Es konnte, da der Placebo-Arm nicht über 52 Wochen fortgeführt wurde, nicht abgeschätzt werden, ob eine Verbesserung nicht eher dem natürlichen Verlauf der Krankheit zuzusprechen ist.
Nebenwirkungen
Die meisten Nebenwirkungen wurden innerhalb der ersten 24 Behandlungswochen beobachtet [5]. Bei mehr als 5% der behandelten PsA-Patienten zeigten sich gastrointestinale Nebenwirkungen (Diarrhoe, Übelkeit), Infektionen des oberen Gastrointestinaltraktes, Kopfschmerzen und Nasopharyngitis. Die beiden häufigsten Nebenwirkungen, Diarrhoe und Übelkeit, traten meist in den ersten zwei Behandlungswochen auf und legten sich innerhalb von vier Wochen trotz Fortführung der Therapie wieder. Nebenwirkungsbedingte Therapieabbrüche traten in den Studien bei weniger als 10% der Patienten auf. Der Anteil schwerwiegender unerwünschter Arzneimittelwirkungen betrug durchschnittlich 6%. Von den schwerwiegenden UAW wurden ein Fall einer Clostridieninfektion und zwei Fälle einer Pneumonie in Zusammenhang mit der Therapie gesetzt. Auch beim Einsatz von Apremilast bei Plaque-Psoriasis standen die gastrointestinalen Nebenwirkungen im Vordergrund. 18,8% der Patienten klagten über Diarrhoe, 15,7% über Übelkeit. Verglichen mit der bekannten UAW-Inzidenz und -Schwere der im Einsatz befindlichen Biologika scheint die Verträglichkeit von Apremilast akzeptabel zu sein.
Blick auf die Waage
Besonders untergewichtige Patienten sollten unter der Behandlung mit Apremilast ihr Gewicht im Auge behalten. In einer klinischen Studie zur Anwendung bei Psoriasis-Arthritis betrug der durchschnittliche Gewichtsverlust nach 52 Behandlungswochen - 1,79 kg [5]. Während die Mehrheit der mit Apremilast behandelten Patienten weniger als 5% ihres Ausgangsgewichtes verloren, reduzierte sich das Körpergewicht bei 17,2 % der Patienten um mehr als 5% des Ausgangsgewichtes.
Wechselwirkungen
Apremilast ist ein Substrat des Cytochroms P450 3A4, wird aber auch über CYP-unabhängige Stoffwechselwege (Oxidation, Hydrolyse, Konjugation) metabolisiert. Eine gleichzeitige Anwendung mit starken CYP3A4-Induktoren, wie zum Beispiel Phenytoin, Carbamazepin, Phenobarbital, Rifampicin und Johanniskraut (Hypericum perforatum), wird nicht empfohlen. Aufgrund der Interaktionen kann es zu sinkenden Plasmaspiegeln von Apremilast kommen, die mit einer nicht ausreichenden therapeutischen Wirkung einhergehen. Apremilast selbst ist weder Induktor noch Inhibitor des Cytochrom-Enzymsystems. In Studien wurde Apremilast zusammen mit Psoriasis-typischen Wirkstoffen (topische Therapeutika wie Glucocorticoide, Kohlenteer-Shampoo, salicylsäurehaltige Präparate zur Kopfhautbehandlung, UVB-Phototherapie, Ketoconazol und Methotrexat) angewendet, es zeigten sich dabei keine relevanten Wechselwirkungen. Ebenso bestehen keine Wechselwirkungen mit oralen Kontrazeptiva.
Schwangerschaft und Stillzeit
In Tierversuchen an Mäusen und Affen zeigte sich bei höheren Dosen als der derzeit empfohlenen Dosis ein embryotoxisches Potenzial [1]. Otezla® darf daher nicht von Schwangeren oder von Frauen im gebärfähigen Alter, die keine Empfängnisverhütung anwenden, eingenommen werden. Eine Schwangerschaft ist vor Beginn der Therapie auszuschließen, während der Behandlung sind wirksame Methoden der Empfängnisverhütung anzuwenden. Aufgrund begrenzter Erfahrungen sollte Apremilast nicht während der Stillzeit angewendet werden.
Kein Zusatznutzen
Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) findet bei Apremilast keinen Zusatznutzen. Damit ist das IQWiG der Auffassung des Herstellers gefolgt, der diesen auch nicht beantragt und daher keine Studien eingereicht hat. Eine endgültige Entscheidung über den Zusatznutzen trift der G-BA. Für die Verordnungs- und Erstattungsfähigkeit wird das unabhängig vom Ausgang keine Folgen haben, da die Therapiekosten bereits heute niedriger sind als bei den zweckmäßigen Vergleichstherapien.
Zulassung ohne Vergleich
Der Ausschuss für Humanarzneimittel der EMA (CHMP) sah den Nutzen von Apremilast bei Plaque-Psoriasis und Psoriasis-Arthritis als erwiesen an, obwohl das Arzneimittel nicht mit anderen zugelassenen Therapien, sondern nur mit Placebo, verglichen wurde und für PsA kein Röntgennachweis über die Reduktion der Progressionsrate von Gelenkschäden vorlag [3]. Man geht davon aus, dass die vorwiegend leichten bzw. mäßigen Nebenwirkungen und die perorale Verfügbarkeit des Arzneimittels die Akzeptanz bei Patienten erhöhen wird.
|
Literatur:
[1] Fachinformation Otezla® Filmtabletten (Apremilast). Celgene Europe Ltd. Stand der Information: Januar 2015.
[2] Rzany B. et al. S3-Leitlinie zur Therapie der Psoriasis vulgaris. Update 2011. (letzter Zugriff am 08.05.2015).
[3] European Medicines Agency. Zusammenfassung des EPAR für die Öffentlichkeit. Otezla® – Apremilast. EMA/727043/2014. www.ema.europe.eu.
[4] Kavanaugh A. et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis. 2014 Jun;73(6):1020-6
[5] Kavanaugh A. et al. Longterm (52-week) results of a phase III randomized, controlled trial of apremilast in patients with psoriatic arthritis. J Rheumatol 2015;42(3):479-88.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.