
- DAZ.online
- DAZ / AZ
- DAZ 20/2015
- Gemeinsam aus dem Loch
Kinder-und Jugendmedizin
Gemeinsam aus dem Loch
Zur Pharmakotherapie von depressiven Störungen bei Kindern und Jugendlichen

Um zu entscheiden, ob Kinder oder Jugendliche tatsächlich die diagnostischen Kriterien einer depressiven Störung nach ICD-10 erfüllen, ist eine umfangreiche Charakterisierung der Symptome erforderlich, die anhand standardisierter Fragebögen und körperlicher Untersuchungen evaluiert werden [2], siehe Beitrag „Süßer Vogel Jugend – Depressionen bei Kindern und Jugendlichen“ auf S. 42 in dieser DAZ.
Ist eine Depression als solche erkannt, sollte sie auch entsprechend behandelt werden. Je nach Schweregrad der Symptome wird eine Beobachtung, Psychotherapie oder auch medikamentöse Behandlung notwendig. Letztere sollte jedoch nur mit entsprechender Umsicht und Zurückhaltung eingesetzt werden und dient zumeist als Ergänzung bzw. Teil des therapeutischen Gesamtplanes. Hauptsächlich bei mittleren bis schweren Ausprägungen depressiver Symptome sowie bei chronischen Formen oder unzureichendem Ansprechen auf psychotherapeutische Interventionen sind Antidepressiva auch bei Kindern und Jugendlichen indiziert. Die deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN) empfiehlt, die Pharmakotherapie sorgfältig nach Nutzen und Risiken individuell abzuwiegen und zu überwachen. In Einzelfällen ist nicht auszuschließen, dass eine initiale Behandlung mit Antidepressiva suizidale Gedanken und aggressive Impulse provoziert [3].
Meist Off-label-use
Wie bei vielen anderen Arzneimittelklassen auch wird der Einsatz von Antidepressiva bei Kindern dadurch erschwert, dass Wirkstoffe, die bei Erwachsenen für verschiedene Formen der Depression (ängstlich-agitiert, gehemmt-apathisch oder wahnhaft) im Rahmen der evidenzbasierten Medizin indiziert sind, für den Einsatz bei Kindern und Jugendlichen noch nicht ausreichend klinisch untersucht wurden. Sie werden daher zumeist off label angewandt. Diese therapeutischen Einschränkungen müssen ebenso berücksichtigt werden wie die Abwägung des möglichen Nutzens einer medikamentösen Therapie gegenüber eventueller Nebenwirkungen. Daher sollte eine leitlinienkonforme Medikation stets zeitlich begrenzt, jedoch ausreichend lange erfolgen und bei eventuellem Nichtansprechen ein Wechsel der Wirkstoffgruppe stattfinden, wobei Arzneimittelkombinationen vermieden werden sollten. Die Deutsche Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie (DGKJP) hat im Rahmen der evidenz- und konsensbasierten S3-Leitlinie zur Behandlung von depressiven Störungen bei Kindern und Jugendlichen die aktuellen Erkenntnisse zur pharmakotherapeutischen Intervention bei Depressionen bewertet [2].
Selektive Serotonin-Reuptake-Inhibitoren
Pharmakotherapeutisch lässt sich bei Kindern und Jugendlichen eine kurzfristige Reduktion einer Depression erreichen, jedoch zeigen sich Unterschiede in der Wirksamkeit der verschiedenen Substanzklassen [4]. Im Rahmen randomisierter klinischer Studien wurde Fluoxetin als selektiver Serotonin-Reuptake-Inhibitor (SSRI) am besten untersucht. Vertreter der SSRI scheinen kurzzeitig wirksamer als Placebo, um die depressiven Symptome bei Kindern und Jugendlichen zu reduzieren. Eine getrennte Analyse der SSRI bestätigt jedoch nur für Fluoxetin eine höhere Wirksamkeit in allen drei Outcome-Maßen
- der Reduktion der Symptomatik,
- der Response-/Remissionsrate und
- der Verbesserung des Funktionsniveaus.
Darauf folgend verbessern Escitalopram zwei und Citalopram bzw. Sertralin je ein Outcome-Maß. Für Paroxetin findet sich in einem systematischen Review kein Nachweis für die Verbesserung der definierten Outcome-Maße [5].
SSRI hemmen nahezu ausschließlich die neuronale Wiederaufnahme von Serotonin aus dem synaptischen Spalt der Nervenzellen durch Blockade des Monoamin-Transporters und verstärken hierdurch die serotonerge Signalübertragung. Sie interagieren nicht oder kaum mit anderen Neurotransmitter-Rezeptoren. Da die Transporter-Blockade unmittelbar eintritt, die Besserung der depressiven Symptomatik jedoch erst zeitlich versetzt deutlich wird, erscheinen nachfolgende neurochemische Regulationen an der Wirkung der SSRI beteiligt. Antidepressiva vom SSRI-Typ normalisieren vermutlich nach längerfristiger Gabe die noradrenerge und serotonerge Neurotransmission im ZNS und wirken dadurch stimmungsaufhellend bzw. depressionslösend. Da SSRI keine Affinität zu zentralen H1-Rezeptoren besitzen, zeigen sie auch keine psychomotorisch dämpfenden oder sedierenden Effekte, sodass die antriebssteigernde Wirkung überwiegt. Daher ist möglicherweise zu Therapiebeginn mit einem erhöhten Suizidrisiko zu rechnen. Die Datenlage hierzu ist noch uneinheitlich, wobei gerade für junge Patienten ein alters- und dosisabhängiger Effekt angenommen wird. In einer kürzlich erschienenen Metaanalyse wurde suizidales Verhalten bei Kindern und Erwachsenen bis 24 Jahre unter einer hoch dosierten Initialtherapie zweimal häufiger festgestellt als bei entsprechenden Kontrollpatienten, welche die empfohlene SSRI-Dosierung erhielten [6]. Personen über 24 Jahre hingegen zeigten weder eine signifikant gesteigerte Suizidrate noch eine entsprechende Dosisabhängigkeit.
Als häufige Nebenwirkungen gelten Kopfschmerzen, grippeartige Symptome, Schlafstörungen, Übelkeit und Diarrhö. Auch Agitiertheit und Störungen der Sexualfunktion werden beschrieben. Vor allem letztere Nebenwirkung erscheint bei der Behandlung von Kindern nur unzureichend beachtet, da Libidoverlust und sexuelle Dysfunktionen in dieser Altersgruppe, anders als bei erwachsenen Patienten, bisher als nicht altersgerechte Symptome eingestuft werden [7]. Eine entsprechende Bewertungsskala klinischer Endpunkte in den pädiatrischen Studien beinhaltet daher auch nicht die sexuelle Symptomatik [8]. Problematisch jedoch ist das Fehlen eines angepassten Bewertungssystems für Jugendliche, da sexuelle Nebenwirkungen in diesem spezifischen Patientenkollektiv durchaus im Rahmen der antidepressiven Therapie mit SSRI auftreten [9]. Die Tatsache, dass Depressionen und Angstzustände selbst die Sexualfunktion der betroffenen Patienten negativ beeinflussen, lässt den derzeitigen Mangel an adäquaten Bewertungskriterien für Sexualstörungen umso schwerwiegender erscheinen. Ähnlich wie bei Erwachsenen sollte eine Anfangsbeurteilung und fortwährende Überwachung der Sexualfunktion zum Standard einer antidepressiven Therapie bei Jugendlichen gehören.
SSRI gelten sowohl als Substrate als auch als Inhibitoren von CYP450-Isoenzymen, inklusive CYP2D6- und CYP2C9/19, sodass die Plasmaspiegel einer Vielzahl anderer Wirkstoffe erhöht werden können. Aufgrund der Gefahr toxischer Serotonin-Konzentrationen im ZNS ist darüber hinaus die gleichzeitige Behandlung mit Monoaminoxidase(MAO)-Inhibitoren kontraindiziert. Es muss eine ausreichende Behandlungspause eingehalten werden, ehe ein MAO-Hemmer verabreicht werden kann [10]. MAO-Inhibitoren verhindern den oxidativen Abbau der Neurotransmitter, sodass die synaptische Konzentration von Dopamin, Noradrenalin, Adrenalin und Serotonin im ZNS zunimmt. Diese Interaktion ist jedoch nur von theoretischer Relevanz, da für den MAO-Inhibitor Moclobemid gegenüber Placebo bisher kein Unterschied in der Senkung depressiver Symptome bei Kindern nachgewiesen werden konnte [11]. Für Tranylcypromin fehlen ausreichende klinische Daten, um eine evidenzbasierte Evaluation durchzuführen. Für beide Substanzen gilt daher die Anwendung im Rahmen der Behandlung mittlerer bis schwerer Depressionen bei Kindern als nicht empfehlenswert, da neben der nicht erwiesenen Wirksamkeit auch mit vermehrten Nebenwirkungen wie Appetitlosigkeit, GI-Symptomen, Kopfschmerzen, Müdigkeit, Schwindel sowie Schlafproblemen zu rechnen ist.
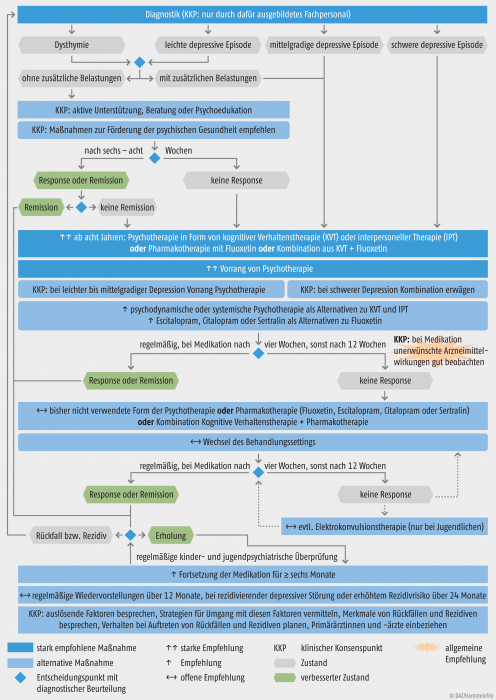
Behandlungsalgorithmus für die Therapie von depressiven Störungen bei Kindern und Jugendlichen
Trizyklische Antidepressiva
Für die Vertreter der trizyklischen Antidepressiva (TZA) Amitriptylin, Clomipramin, Desipramin, Imipramin und Nortriptylin existiert derzeit kein evidenzbasierter Wirksamkeitsnachweis zur Senkung der depressiven Symptomatik bei Kindern und Jugendlichen, für Nefazodon sind die Ergebnisse uneinheitlich [12 – 14]. Anders als die neuere Substanzgruppe der SSRI besitzen TZA vielfältige Wirkmechanismen, wodurch deren antidepressive Effekte erklärt werden können. Neben der Inhibition des neuronalen Reuptakes von Serotonin sowie Noradrenalin im ZNS wird zusätzlich direkt mit zentralen und peripheren Neurotransmitterrezeptoren interagiert [15]. Diese vielfältigen Wirkungen erklären auch die Vielzahl von unerwünschten Nebenwirkungen, die im Rahmen einer TZA-Therapie auffallen. Während die stimmungsaufhellende Wirkung erst nach zwei bis drei Wochen auftritt, treten anticholinerge Effekte, die aus der Inhibition entsprechender Cholinozeptoren resultieren, bereits zu Beginn der Behandlung auf. Mundtrockenheit, Schwindel und orthostatische Dysregulationen gelten als solche und werden durch zentralnervöse Störungen wie Schlaflosigkeit, Kopfschmerzen und Tremor ergänzt. Aufgrund nicht nachgewiesener Wirksamkeit und des hohen Intoxikationsrisikos (letale kardiale Folgen) sind trizyklische Antidepressiva nicht bei Depressionen in der Kinder- und Jugendpsychiatrie indiziert.
Tetrazyklische Antidepressiva
Ähnlich negativ fällt die evidenzbasierte Beurteilung zur Wirksamkeit des tetrazyklischen Antidepressivums Mirtazapin sowie der selektiven Serotonin-Noradrenalin-Wiederaufnahmehemmer (SSNRI) Duloxetin und Venlafaxin aus. Für Venlafaxin ist zusätzlich ein kurzfristig erhöhtes Risiko für suizidbezogene Ereignisse bei Kindern von sieben bis 17 Jahren dokumentiert [5]. Mirtazapin entspricht in seinen pharmakologischen Eigenschaften denen der trizyklischen Antidepressiva, wobei vor allem präsynaptische α2- und 5-HT3-Rezeptoren blockiert werden. Hierdurch erfolgt eine verstärkte Serotonin- und Noradrenalin-Freisetzung bei gleichzeitig fehlender Serotonin-Wiederaufnahmehemmung und deutlich schwächerer H1-Rezeptor-Antagonisierung [15]. Vor allem zu Beginn der Therapie treten zentral dämpfende Effekte auf, sodass tetrazyklische Antidepressiva vornehmlich bei ängstlich-agitierten Depressionen eingesetzt werden. Hervorzuheben ist die im Vergleich zu den trizyklischen Antidepressiva geringer ausgeprägte anticholinerge Wirkkomponente. Als Nebenwirkungen treten metabolische Dysregulationen wie Gewichtszunahme, Appetitsteigerung und Hypertriglyceridämie auf. SSNRI hemmen wie die TZA den Reuptake von Noradrenalin und Serotonin, haben jedoch keine antagonistischen Effekte auf Neurotransmitter-Rezeptoren, sodass sie nicht sedierend wirken und auch keine anticholinergen Wirkungen haben. Als Nebenwirkungen können Übelkeit, Schwindel, Müdigkeit oder abdominale Schmerzen auftreten, die gleichzeitige Gabe von MAO-Inhibitoren ist kontraindiziert.
Nicht belegte Wirksamkeit
Bei einer Vielzahl weiterer Antidepressiva unterschiedlicher Wirkstoffklassen ist derzeit keine evidenzbasierte Wirksamkeitsbewertung möglich, da die klinische Studienlage meist unzureichend ist. Hierzu zählen einige trizyklische Antidepressiva wie Trimipramin und Doxepin, tetrazyklische Antidepressiva wie Maprotilin und Mianserin sowie Reboxetin, ein selektiver Noradrenalin Reuptake-Inhibitor (SNRI), oder Bupropion als Vertreter der selektiven Noradrenalin-Dopamin-Reuptake-Hemmer (NDRI). Für Lithium können derzeit keine randomisierten klinischen Studien evaluiert werden, jedoch gibt es Fallserien, die darauf hindeuten, dass bei weiblichen Jugendlichen depressive Symptome verhindert oder verringert werden können. Lithium beeinflusst den zentralen Phosphatidylinositol-Stoffwechsel durch Hemmung spezifischer Enzyme, welche die Dephosphorylierung von Inositol vermitteln, sodass Letzteres in nur unzureichenden Mengen zur Bildung des Membranphospholipids Phosphatidylinositol-4,5-diphosphat zur Verfügung steht [16]. Vermutlich schwächt Lithium so die Aktivität von Neuronen mit Phospholipase-C-gekoppelten Rezeptorsystemen. Zur Behandlung bipolarer Störungen (manisch-depressiver und schizoaffektiver Psychosen) sind Lithium-Salze dagegen bereits für Kinder ab zwölf Jahren zugelassen, und ein frühzeitiger Einsatz ist hier empfehlenswert.
Möglichkeiten der Selbstmedikation
Die Wirksamkeit nicht-verschreibungspflichtiger Medikamente einschließlich Johanniskraut-Präparaten, Glutamin und Vitamin C wurde nur in Studien mit niedrigem Evidenzgrad untersucht. Die Ergebnisse deuten darauf hin, dass Johanniskraut als Phytopharmakon bei Kindern und Jugendlichen von ein bis 17 Jahren wirksam sein kann und gut vertragen werden könnte. Es muss jedoch auf das breite Nebenwirkungs- und Interaktionsprofil geachtet werden, da die Aktivität von CYP3A4-Isoenzymen sowie des P-Glykoproteins induziert wird [17]. Johanniskraut wird daher nicht als leitliniengerechte Therapieoption bei Kindern und Jugendlichen empfohlen. Die selbstständige Anwendung von nicht-verschreibungspflichtigen Johanniskraut-Präparaten wird abgelehnt, einerseits um eventuelle Interaktionen mit bestehenden Medikationen zu verhindern, andererseits um bei Auftreten depressiver Symptome den dringend erforderlichen Arztbesuch nicht hinauszuzögern.
Leitlinienkonforme Pharmakotherapie in Deutschland
Entsprechend der evidenzbasierten Gesamtbewertung empfiehlt die DGKJP bei depressiven Störungen von Kindern und Jugendlichen mit mittelschwerer bis schwerer Ausprägung im Rahmen ihrer Leitlinie einzig die Gabe von Fluoxetin, da dieses auch aufgrund der klinischen Wirksamkeitsnachweise bisher als einziges SSRI für Kinder über acht Jahre in Deutschland zugelassen ist. Bei unzureichendem Ansprechen oder Unverträglichkeiten sollte alternativ die Gabe von Escitalopram, Citalopram oder Sertralin in Betracht gezogen werden. TZA, Moclobemid, Paroxetin, Venlafaxin und Mirtazapin sollten nicht eingesetzt werden. Zu beachten ist jedoch, dass der Stellenwert einer pharmakotherapeutischen Intervention in der S3-Leitlinie der DGKJP einer kognitiv-verhaltenstherapeutischen oder interpersonellen Psychotherapie unterzuordnen ist, da durch die Gabe von SSRI eine Verstärkung der Suizidgedanken provoziert werden kann sowie weitere unerwünschte Nebenwirkungen auftreten können. Erst bei unzureichender Besserung der depressiven Symptomatik durch eine spezifische Psychotherapie bzw. bei schweren Formen der Depression wird nachfolgend eine Kombinationsbehandlung aus Verhaltens- und Pharmakotherapie empfohlen. Für Kinder unter acht Jahren wird aufgrund mangelnder empirischer Evidenz jedoch noch immer keine eindeutige Empfehlung zur Pharmakotherapie ausgesprochen.
Aktuelle Empfehlung des britischen NICE
Ungeachtet solcher Einschränkungen entspricht dieser Empfehlungsgrad dem der seit 2005 gültigen Leitlinie des britischen National Institute for Health and Clinical Excellence (NICE), welche ebenso Fluoxetin als Mittel der Wahl bei mittelschwerer bis schwerer Depression einstuft und alternativ nur die Gabe von Citalopram oder Sertralin befürwortet [18]. Im Gegensatz zur S3-Leitlinie der DGKJP erfolgte hier jedoch eine im März 2015 durchgeführte Neubewertung der Erst-Linien-Therapie für Kinder und Jugendliche im Alter von zwölf bis 18 Jahren mit mittlerer bis schwerer Depression [19]. Anstatt die Wirksamkeit einer initialen psychologischen Behandlung abzuwarten und erst im nächsten Schritt die Gabe von Antidepressiva zu beginnen, sieht das NICE-Komitee trotz der Bedenken zu möglichen Nebenwirkungen von SSRI keine Evidenz für eine erhöhte Rate an suizidalen Gedanken durch die sofortige Gabe von Fluoxetin, sofern die Medikation zusammen mit einer psychologischen Behandlung erfolgt. Die NICE-Leitlinie empfiehlt ab sofort die Kombinationsbehandlung aus Verhaltens- und Pharmakotherapie als Alternative zur bisherigen Erst-Linien-Option, da dieser duale Ansatz einen höheren therapeutischen Nutzen aufweist als eine alleinige spezifische Psychotherapie. Auch für Kinder von fünf bis elf Jahren sieht die NICE-Leitlinie Fluoxetin als mögliche Medikationsalternative, sofern eine Psychotherapie nicht den gewünschten Erfolg bringt.
Zu den Dosierungen für die empfohlenen Medikamente schlägt die NICE-Leitlinie vor, die Behandlung mit Fluoxetin mit 10 mg/Tag zu beginnen und die Dosis, falls notwendig, nach einer Woche auf 20 mg/Tag zu steigern. Für andere Antidepressiva wird empfohlen, mit der Hälfte der täglichen Dosis für Erwachsene zu beginnen und diese Dosierung über die nächsten zwei bis vier Wochen bis maximal zur täglichen Dosis für Erwachsene zu erhöhen. Allgemein ist eine Dosierung jedoch individuell anzupassen, sodass bei jüngeren Kindern mit geringem Körpergewicht auch niedrigere Dosierungen angewandt werden können bzw. bei Jugendlichen mit höherem Körpergewicht und/oder wenn die Schwere der Erkrankung ein rasches Ansprechen nötig macht, eine entsprechende Anpassung zu höheren Dosierungen erfolgen sollte.
Ob auch im Rahmen der S3-Leitlinie der DGKJP eine analoge Aktualisierung der Empfehlung zur Anwendung von SSRI zu Therapiebeginn erfolgt, bleibt abzuwarten. Wichtig erscheint jedoch, dass zukünftig weitere klinische Daten erhoben werden, um die Anwendung von Arzneimitteln bei Kindern und Jugendlichen sicherer zu machen und gegebenenfalls die Indikationsgebiete der Wirkstoffe auch für Kinder in sehr jungen Jahren (unter acht Jahre) zu erweitern. So können die individuelle Entscheidungsfindung zum leitlinienkonformen Einsatz von Antidepressiva für die behandelnden Ärzte erleichtert und die Chancen eines Therapieerfolgs erhöht werden. |
Literatur
[1] Stellungnahme der DGKJP zur Pressemitteilung der DAK „Immer mehr depressive Jugendliche im Krankenhaus“. 20. Februar 2014, www.dgkjp.de/aktuelles/195-dak-stellungnahme
[2] Behandlung von depressiven Störungen bei Kindern und Jugendlichen, S3-Leitlinie der Deutschen Gesellschaft für Kinder- und Jugendpsychiatrie, Psychosomatik und Psychotherapie (DGKJP), AWMF-Registernummer 028 – 043, Stand: 1. Juli 2013. www.awmf.org/uploads/tx_szleitlinien/028-043l_S3_Depressive_St%C3%B6rungen_bei_Kindern_Jugendlichen_2013-07.pdf
[3] Stellungnahme der Deutschen Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN) zur ARD-Reportage „Gefährliche Glückspillen“ vom 18. Februar 2013, www.dgppn.de
[4] Tsapakis EM et al. Efficacy of antidepressants in juvenile depression: meta-analysis. Br J Psychiatry, 2008;10-17
[5] Hetrick SE et al. Newer generation antidepressants for depressive disorders in children and adolescents. Cochrane Database Syst Rev, 2012. DOI: 10.1002/14651858.CD004851.pub3.
[6] Miller M, Swanson S, Stürmer T. Antidepressant Dose and Risk of Deliberate Self-harm—Reply. JAMA Intern Med. 2015;175(3):464, doi:10.1001/jamainternmed.2014.7180.
[7] Levine A, McGlinchey E. Assessing Sexual Symptoms and Side Effects in Adolescents. Pediatrics 2015;135:4 e815-e817; published ahead of print March 23, 2015, doi:10.1542/peds.2014-3003
[8] Poznanski EO, Mokros HB. Children’s Depression Rating Scale, Revised (CDRS-R): Manual. Vancouver, WA: Western Psychological Services; 1996
[9] Scharko AM. Selective serotonin reuptake inhibitor–induced sexual dysfunction in adolescents: a review. J Am Acad Child Adolesc Psychiatry. 2004;43(9):1071–1079
[10] Gysling E. Aktuelle Arzneimittel-Interaktionen. Pharma-Kritik 1991;13:69-72
[11] Avci A et al. Comparison of moclobemide and placebo in young adolescents with major depressive disorder. Ann Medic Scienc 1999;8(1):31-40
[12] Papanikolaou K et al. Efficacy of antidepressants in child and adolescent depression: a meta-analytic study. J Neural Transm, 2006;113(3):399-415
[13] Maneeton N, Srisurapanont M. Tricyclic antidepressants for depressive disorders in children and adolescents: a meta-analysis of randomized-controlled trials. J Med Assoc Thai, 2000;83(11):1367-1374
[14] Moreno C et al. Antidepressants in child and adolescent depression: where are the bugs? Acta Psychiatr Scand, 2007;115(3):184-195
[15] Mutschler E et al. Mutschler Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftliche Verlagsgesellschaft Stuttgart 2013
[16] Benkert O et al. Kompendium der Psychiatrischen Pharmakotherapie. 5. Auflage. Springer Verlag, Luxemburg, Berlin 2005
[17] Hübner WD, Kirste T. Depressive Symptome und psychovegetative Störungen bei Kindern unter 12 Jahren. Ergebnisse einer Beobachtungsstudie mit Johanniskraut (Hypericum perforatum). Schweizerische Zeitschrift für GanzheitsMedizin, 2002;14(6):318-324
[18] Depression in children and young people: Identification and management in primary, community and secondary care. NICE clinical guideline 28, März 2015, www.nice.org.uk
[19] Hopkins K, Crosland P, Elliott N, Bewley S. Diagnosis and management of depression in children and young people: summary of updated NICE guidance BMJ 2015;350:h824
[20] Mehler-Wex C. Depressive Störungen im Kindes- und Jugendalter. Dtsch Arztebl 2008;105(9):149-155; DOI: 10.3238/arztebl.2008.0149
[21] Schulte-Markwort M, Forouher N. Affektive Störungen. In: Herpertz-Dahlmann B, Resch F, Schulte-Markwort M ,Warnke A (Hrsg.): Entwicklungspsychiatrie. Stuttgart, New York: Schattauer 2003;609-636
[22] Essau CA, Petermann U. Depression. In: Petermann F (Hrsg.): Lehrbuch der Klinischen Kinderpsychologie und -psychotherapie (4. Auflage). Göttingen: Hogrefe 2000;291-322
[23] Deutsche Gesellschaft für Kinder- und Jugendpsychiatrie und Psychotherapie, Berufsverband der Ärzte für Kinder- und Jugendpsychiatrie und Psychotherapie in Deutschland e. V., Bundesarbeitsgemeinschaft der leitenden Klinikärzte für Kinder- und Jugendpsychiatrie und Psychotherapie e. V. In: Warnke A, Lehmkuhl G (Hrsg.): Leitlinien zur Diagnostik und Therapie von psychischen Störungen im Säuglings-, Kindes- und Jugendalter. Köln: Deutscher Ärzte-Verlag 2006;57-72
Autor
André Said studierte von 2004 bis 2008 Pharmazie an der FU Berlin. Die Approbation als Apotheker erhielt er 2010 und arbeitete anschließend als Doktorand im Fachbereich Pharmakologie/Toxikologie an der FU Berlin bei Prof. Dr. Günther Weindl. Seine Promotion mit dem Titel: „Funktionelle Charakterisierung von dendritischen Zellen unter entzündlichen Bedingungen in vitro und Integration in humane Vollhautäquivalente“ schloss er 2014 erfolgreich ab. Seit 2013 ist Dr. André Said für die DAZ als freier Autor tätig.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.