
- DAZ.online
- DAZ / AZ
- DAZ 19/2015
- Hirn auf Hochtouren
Neuroenhancement
Hirn auf Hochtouren
Über Wirkungen und Nebenwirkungen eines „Hirndopings“

Ziel des Hirndopings ist es, eine Steigerung der geistigen Leistungsfähigkeit oder die Verbesserung des emotionalen Befindens zu erreichen. Dies ist keineswegs nur eine Erscheinung der Moderne. Psychoaktive Substanzen wie Alkohol, Tabak oder Kaffee werden seit Langem eingesetzt, um körperliche oder psychische Leistungen zu steigern. Bisher besteht jedoch Uneinigkeit darüber, welche Stoffe überhaupt als sogenannte Neuroenhancer deklariert werden sollten. Eine eng gefasste Definition versteht hierunter ausschließlich verschreibungspflichtige Medikamente, andere wiederum beziehen auch natürliche und pflanzliche sowie illegale Substanzen (z. B. Amphetamine, Kokain) ein [1]. Der diesjährige Gesundheitsreport der DAK zu „Doping im Job“ spricht von ca. drei Millionen Beschäftigten, die wenigstens einmal ohne medizinische Indikation leistungssteigernde oder stimmungsaufhellende Medikamente einnahmen, um die beruflichen Anforderungen zu erfüllen [2]. Dies entspricht einer Steigerung von 4,7% auf 6,7% innerhalb der letzten sechs Jahre und bestätigt einen wachsenden Einfluss pharmazeutischer Mittel auf den beruflichen Alltag in Deutschland sowie die allmähliche Akzeptanz des medikamentösen Hirndopings in der Bevölkerung.
Tatsächlich streiten Experten derzeit, ob die Kurzzeitverordnung von Neuroenhancern im Einzelfall sogar zu befürworten ist. Unterstützer des Hirndopings sehen eine zeitweilige Verbesserung von Aufmerksamkeit und Konzentration als durchaus vertretbar an und favorisieren die Möglichkeit, mit umfangreichen Therapieangeboten der Gefahr einer Sucht bzw. psychischen Abhängigkeit entgegenzutreten, anstatt das Hirndoping generell zu verbieten. Dopinggegner zweifeln jedoch an der tatsächlichen Wirksamkeit der potenziellen Substanzen und kritisieren, dass Erkenntnisse zur Langzeitwirkung diverser Substanzen bei nicht indizierter Einnahme an gesunden Personen bisher kaum vorhanden sind.
Psychostimulanzien: Beispiel Methylphenidat
Methylphenidat (Ritalin®, Medikinet®, Concerta®) wurde bereits 1944 synthetisiert und ab den 1950er Jahren gegen chronische Müdigkeit, Lethargie, Verwirrung und Psychosen vermarktet [3]. Heute wird diese Substanz in Deutschland als verkehrs- und verschreibungsfähiges Betäubungsmittel eingestuft. Therapeutisch wirksam ist das S-(+)-Enantiomer. Zugelassen ist der Wirkstoff bei Kindern, Jugendlichen und Erwachsenen mit Aufmerksamkeitsdefizit- und Hyperaktivitätsstörungen (ADHS). Daneben wird Methylphenidat auch zur Therapie der Narkolepsie bei Erwachsenen eingesetzt. Wird der Wirkstoff bei gesicherter Indikation bestimmungsgemäß verwendet, besteht ein nur sehr geringes Suchtrisiko. Aufgrund seiner antriebssteigernden Wirkung wird Methylphenidat missbräuchlich zur kognitiven Leistungsförderung verwendet und kann bei unsachgemäßer Handhabung euphorische Gefühlswahrnehmungen induzieren. Methylphenidat stellt als Phenylethylamin-Derivat mit Amphetamin-ähnlicher Wirkung ein indirekt wirkendes Sympathomimetikum dar und besitzt zentralnervös stimulierende Effekte. Die illegale Anwendung von Methylphenidat als Mittel zur Steigerung der Hirnleistung bei mentalen Anforderungen basiert auf der vermittelten Erhöhung der geistigen Aufmerksamkeit, Konzentration und Vigilanz. Durch eine veränderte Aktivität von Neurotransmittern sollen aufgabenbezogene Hirnaktivitäten fokussiert und überflüssige Anstrengungen verhindert werden.
Pharmakodynamik: Methylphenidat erhöht die Konzentrationen von Dopamin und von Noradrenalin im Zentralnervensystem. Diese Wirkung basiert vermutlich ausschließlich auf einer Wiederaufnahmehemmung der Neurotransmitter aus dem synaptischen Spalt, wodurch eine verlängerte prä- und postsynaptische Interaktion mit den jeweiligen Rezeptoren vermittelt wird. Anders als die Wirkung der Amphetamine, welche auch selbst einen Auswärtstransport endogener Katecholamine aus dopaminergen, noradrenergen oder adrenergen Neuronen induzieren, sind die pharmakologischen Effekte von Methylphenidat jedoch von der Erregung des Axons abhängig. In der Peripherie steigert Methylphenidat als indirektes Sympathomimetikum die Plasmakonzentration von Noradrenalin und induziert somit positiv inotrope und chronotrope Effekte am Herzen, erhöht die vaskuläre Tonizität und vermittelt hierdurch einen Anstieg des Blutdrucks.
Pharmakokinetik: Die Dosierung ist stets individuell anzupassen, wobei eine maximale Höchstdosis von 80 mg/Tag nicht überschritten werden darf. Methylphenidat wird gastrointestinal gut resorbiert und bereits präsystemisch extensiv metabolisiert. Die durchschnittliche Bioverfügbarkeit beträgt nur etwa 30%. Die Verteilung in das ZNS erfolgt hauptsächlich durch passive Diffusion. Methylphenidat wird größtenteils durch Esterasen hydrolysiert und anschließend entweder als Ritalinsäure oder unverändert renal eliminiert. Die terminale Halbwertszeit beträgt zwei bis zweieinhalb Stunden.
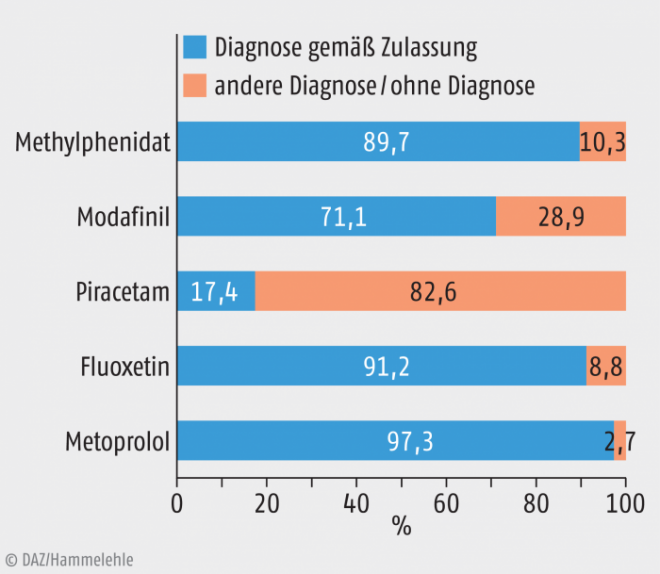
Abb. 1: Verordnungen ohne nachvollziehbare Diagnose. Die Verknüpfung der Verordnungsdaten mit den ambulanten Diagnosedaten, den Krankenhaus- und Arbeitsunfähigkeitsdaten zeigt den Anteil der Versicherten, bei denen keine Diagnose zur Verordnung vorliegt. Daraus kann gefolgert werden, dass dies Verordnungen ohne medizinische Notwendigkeit sind. (Quelle: [2])
Entsprechend der stimulierenden Effekte können zentralnervöse Störungen, wie Kopfschmerzen, Tremor, Schlafstörungen und Appetitmangel auftreten. Subjektiv kann Methylphenidat irreale Euphorie und Hochgefühle, Selbstüberschätzung, Angst sowie Unruhe erzeugen. Mundtrockenheit, Tachykardien und Blutdrucksteigerung erklären sich durch die peripheren Effekte [4]. Zudem werden allergische Reaktionen beobachtet. Im Falle der missbräuchlichen Anwendung zur kognitiven Leistungsförderung besteht die Gefahr der psychischen Abhängigkeit. Insbesondere bei Risikopersonen sind kardiale sowie zerebrovaskuläre Komplikationen möglich. Bei mittelschwerer bis schwerer Hypertonie, Hyperthyreose, Anorexia nervosa, Tachykardie, Schizophrenie, Angsterkrankungen und Phäochromozytom ist Methylphenidat daher kontraindiziert [5]. Durch Hemmung von CYP450-Isoenzymen muss zudem mit zahlreichen Interaktionen gerechnet werden [6, 7].
Methylphenidat
Methylphenidat kann bei ADHS von Kindern und Jugendlichen oder bei Narkolepsie sinnvoll eingesetzt werden, sofern die Diagnose klinisch adäquat gesichert ist. Umstritten ist, ob ein Off-label-use von Methylphenidat bei gesunden Personen tatsächlich zu einer Verbesserung der kognitiven Fähigkeiten führt [8]. In Anbetracht der Gefahr psychischer Abhängigkeit sowie teils schwerwiegender zentraler und kardiovaskulärer Nebenwirkungen ist die Anwendung von Methylphenidat als Neuroenhancer nicht zu vertreten.
Nootropika: Beispiel Piracetam
Der Begriff Nootropika ist nicht eindeutig definiert. Er umfasst Substanzen, die die Hirnleistungen verbessern, ohne dabei zentral stimulierend zu wirken. Obwohl die Effekte aus tierexperimentellen Versuchen sowie klinischen Studien am Menschen statistische Signifikanz aufweisen, werden sie als therapeutisch irrelevant angesehen, sodass die Wirksamkeit von Nootropika wie Piracetam (Nootrop®, Normabrain®) bei Hirnleistungsstörungen noch immer umstritten ist [5]. Die Indikation zur Behandlung mit einem Wirkstoff dieser Gruppe wird daher sehr zurückhaltend gestellt. Entsprechend dieser Einschränkungen ist die Evidenz für die Wirksamkeit von Piracetam zum Beispiel bei Alzheimer-Demenz unzureichend, die Behandlung wird nicht mehr empfohlen [9, 10]. Trotz dieser Vorbehalte wird auch Piracetam missbräuchlich zum Hirndoping angewandt. Dabei sollen Konzentrationsschwierigkeiten reduziert, die Lern- und Denkfähigkeit gefördert sowie die Gedächtnisfunktion verbessert werden. Durch Beeinflussung des Gehirnstoffwechsels und einzelner biochemischer Effekte soll die Aktivität von Neurotransmittern erhöht werden, so dass die Kognition gesteigert wird.
Piracetam
Entsprechend der klinisch nicht gesicherten Wirksamkeit von Piracetam zur symptomatischen Behandlung hirnorganisch bedingter Leistungsstörungen finden sich nur wenige Belege, dass Nootropika tatsächlich relevant die Hirnfunktionen verbessern. Das gilt ebenfalls für eine missbräuchliche Anwendung bei gesunden Personen, die Piracetam zur Verbesserung der Gedächtnisleistung einnehmen. Auch hier stehen dem vermutlich sehr geringen Nutzen eine Vielzahl an Nebenwirkungen gegenüber, die die Anwendung von Piracetam, selbst bei klinisch gesicherter Indikation, derzeit fragwürdig erscheinen lassen.
Pharmakodynamik: Die vielfältigen und zum Teil wenig spezifischen Effekte von Piracetam auf den Hirnstoffwechsel wurden bisher zumeist tierexperimentell erhoben und sind klinisch kaum gesichert. Diese umfassen u. a. die Erhöhung der Glucoseverwertung über den Pentosephosphatweg, die Verbesserung der Membraneigenschaften, Stimulierung der Adenylatkinase, Anregung des Phospholipidstoffwechsels, Förderung der Nucleotid- und Proteinbiosynthese oder Erhöhung des ATP-Umsatzes. Auch vermittelt Piracetam eine Zunahme der Dichte muscarinerger Cholinozeptoren im Frontalhirn sowie eine Steigerung des Dopamin-Umsatzes [11]. Studien am Menschen weisen auf eine Erhöhung der Durchblutung ischämischer Hirnareale hin, wodurch die Sauerstoffversorgung und Glucose-Verwertung gesteigert wird.
Pharmakokinetik: Nootropika werden oral gut resorbiert, jedoch ist die Bioverfügbarkeit teilweise gering [12]. Piracetam wird hauptsächlich unverändert renal eliminiert, wobei die terminale Halbwertszeit mit fünf bis sechs Stunden angegeben wird [5]. Die mittlere therapeutische Tagesdosis liegt zwischen 2400 und 4800 mg.
Piracetam kann eine gesteigerte psychomotorische Aktivität induzieren und daneben Schlafstörungen, Nervosität, Aggressivität, depressive Verstimmung, Schwindel und gastrointestinale Beschwerden hervorrufen. Auch eine Zunahme der Libido sowie allergische Reaktionen werden beobachtet. Bei Überempfindlichkeit gegen Pyrrolidon-Derivate oder terminaler Niereninsuffizienz ist Piracetam kontraindiziert. Bei gleichzeitiger Gabe von Cumarin-Derivaten ist möglicherweise mit einer Wirkverstärkung zu rechnen und auch die Effekte von zentral stimulierenden Substanzen sowie von Schilddrüsenhormonen können potenziert werden.
| Substanz, Dosis | AnzahlRCT | Anzahl Probanden | Alter | Vigilanz und Aufmerksamkeit | Reaktionszeit | Müdigkeit | Gedächtnis | Stimmung | subjektive Selbsteinschätzung/Selbstvertrauen |
|---|---|---|---|---|---|---|---|---|---|
| Coffein, einmal 50 – 600 mg bis zu 6 Tage | 6 | 358 | 18 – 77 | ↑ | (↓) | (↓) | 0 | 0 | (↑) |
| Energy Drink,einmal 250 ml | 6 | 174 | 18 – 35 | ↑↑ | ↓ | (↓) | 0 – (↑) |
0 | (↑) |
| Methylphenidat,einmal 5 mg bis zweimal 40 mg | 6 | 205 | 18 – 40 | ↑ | (↓) | k. A. | 0 – (↑) |
0 | 0 – (↑) |
| D-Amphetamin,einmal 10 – 20 mg | 6 | 154 | 18 – 44 | ↑↑ | ↓ | (↓) | 0 – (↑) |
↑ | ↑ |
| Modafinil, einmal 100 - 400 mg bis zu 3 Tage | 6 | 218 | 19 – 67 | (↑) | ↓ | 0 – (↓) |
0 – (↑) |
↑ – (↓) |
(↑) |
| Donepezil, ein- bis zweimal 5 mg bis zu 14 Tage | 5 | 122 | 25 – 85 | (↓) | ↑ – ↓ | k. A. | 0 –↑–↓ | k. A. | k. A. |
| Rivastigmin,einmal 3 mg | 1 | 16 | 60 – 75 | k. A. | (↓) | k. A. | 0 –↑–↓ | k. A. | k. A. |
| Memantin,einmal 30 mg | 3 | 88 | 20 – 35 | 0 | 0 | k. A. | 0 – (↓) |
0 | k. A. |
| Ginkgo, 120 – 360 mg bis zu 8 Monate | 16 | 1160 | 18 – 82 | (↑) | 0 | 0 | 0 – (↓) |
0 | (↑) |
| Fluoxetin, einmal 20 mg bis zu 6 Wochen | 3 | 42 | 21 – 45 | (↓) | 0 | 0 | k. A. | 0 | ↓ |
| Fluvoxamin, einmal 50 – 100 mg | 3 | 30 | 21 – 50 | 0 | 0 – (↓) |
k. A. | (↑) | 0 | k. A. |
| Citalopram, einmal 20 - 40 mg bis zu 15 Tage | 7 | 161 | 19 – 59 | (↓) | 0 | 0 | ↓ – ↑ | 0 | 0 |
| Escitalopram, einmal 10 - 20 mg bis zu 6 Wochen | 2 | 39 | 19 – 36 | 0 | 0 | (↓) | 0 | 0 | 0 |
| Paroxetin, einmal 10 - 40 mg bis zu 21 Tage | 8 | 169 | 21 – 85 | 0 | 0 – (↓) |
0 – (↓) |
0 | 0 | 0 |
| Sertralin, einmal 50 - 100 mg bis zu 14 Tage | 5 | 215 | 30 – 64 | 0 – (↓) |
0 | 0 | 0 | 0 | k. A. |
k. A.: keine Angabe; 0: kein Effekt; (↑)(↓): leichter Effekt; ↑/↓ mittelstarker Effekt; ↑↑/↓↓: starker Effekt | |||||||||
Antidepressiva: Beispiel Fluoxetin
Die Beobachtung, dass ein Reserpin-induzierter Monoamin-Mangel depressive Symptome auslösen kann, führten bereits vor etwa 40 Jahren zu der Vermutung, dass Depressionen auf einer Verminderung der noradrenergen und/oder serotonergen Neurotransmission im ZNS beruhen [7]. Fluoxetin (Fluxet®) gilt als neueres Antidepressivum und wurde 1987 als eines der ersten vom SSRI-Typ (selektive Serotoninwiederaufnahme-Inhibitoren) eingeführt. Es besitzt keine chemische Verwandtschaft zu trizyklischen Antidepressiva. Wirkstoffe dieser Substanzklasse hemmen primär die neuronale Wiederaufname von Serotonin. Hierdurch bessern sich gehemmt-apathische depressive Symptome exogener und endogener Pathogenese sowie Formen von Zwangs- und Angstsyndromen, aber auch psychisch bedingte Ess-Störungen (Bulimie) werden hiermit behandelt. Aufgrund der Verbesserung des psychischen Wohlbefindens sowie einer Steigerung des Antriebs bzw. Erhöhung der Leistungsbereitschaft wird die Substanz darüber hinaus missbräuchlich als „Wachmacher“ oder auch als „Glückspille (Happy Pill)“ eingenommen. Der berufliche Alltag soll damit in jeder Stresssituation mental gemeistert werden und auch Ermüdungserscheinungen würden unterdrückt.
Fluoxetin
Die Wirkungen und Nebenwirkungen von Fluoxetin bei gehemmt-apathischer depressiver Symptomatik sind klinisch gut dokumentiert und unterscheiden sich zum Teil erheblich von denen der trizyklischen Antidepressiva. Die pharmakodynamischen Effekte sind sehr komplex und lassen sich nur mit der Inhibition der Serotonin-Wiederaufnahme nicht vollständig erklären. Sekundäre Effekte der SSRI-Behandlung scheinen eine Dysregulation der Signalübertragung zwischen Nervenzellen zu beeinflussen. Dieser Aspekt ist von besonderer Bedeutung bei der Anwendung von Fluoxetin bei gesunden Personen. Hier konnten zwar geringe Effekte auf die kognitiven Funktionen beschrieben werden, eine Verbesserung der emotionalen Stimmungslage wurde jedoch nicht belegt [16]. Die Anwendung von Fluoxetin bei gesunden Personen geht mit der Gefahr einher, dass sich durch eine dauerhafte Inhibition serotonerger Transporter langfristig eine komplexe neuronale Dysregulation einstellt, die Persönlichkeitsveränderungen und Abhängigkeit hervorrufen kann [18].
Pharmakodynamik: Fluoxetin hemmt als SSRI nahezu ausschließlich die Wiederaufnahme von Serotonin aus dem synaptischen Spalt der Nervenzellen durch Blockade des entsprechenden Monoamin-Transporters. Hierdurch wird die serotonerge Signalübertragung verstärkt, wobei Fluoxetin nicht oder kaum mit anderen Neurotransmitter-Rezeptoren interagiert. Da die Hemmung der Serotonin-Wiederaufnahme unmittelbar eintritt, die Besserung der depressiven Symptomatik jedoch erst nach etwa zwei Wochen deutlich wird, erscheinen neurochemische Folgewirkungen der Transporterblockade an der Wirkung der SSRI beteiligt. Heute wird angenommen, dass sich noradrenerge und/oder serotonerge Neuronensysteme gegenseitig beeinflussen und der für die depressive Symptomatik ursächliche Mangel an Monoaminen eine veränderte Rezeptorempfindlichkeit prä- sowie postsynaptischer Rezeptoren induziert. Antidepressiva vom SSRI-Typ normalisieren vermutlich nach längerfristiger Gabe die noradrenerge und/oder serotonerge Neurotransmission im ZNS und wirken so stimmungsaufhellend und depressionslösend. Da SSRI keine Affinität zu zentralen H1-Rezeptoren besitzen, sind sie auch nicht psychomotorisch dämpfend oder sedierend wirksam und es überwiegt die antriebssteigernde Wirkung. Dadurch ist gerade zu Therapiebeginn mit einem erhöhten Suizidrisiko zu rechnen [13]. Eine vorübergehende Kombination mit Benzodiazepinen kann daher individuell indiziert sein [5].
Pharmakokinetik: SSRI werden aufgrund ihrer hohen Lipophilie rasch und gut resorbiert und ihre orale Bioverfügbarkeit liegt bei über 50%. Fluoxetin wird hepatisch durch Demethylierung zu Norfluoxetin metabolisiert, welches ebenfalls die Wiederaufnahme von Serotonin blockiert und somit zur Wirksamkeit von Fluoxetin beiträgt [14]. Die mittlere Plasmahalbwertszeit von Fluoxetin beträgt zwei bis vier Tage, die von Norfluoxetin sogar sieben Tage. Die Elimination erfolgt vorwiegend renal. Bei stark eingeschränkter Nierenfunktion kann es zu einer Akkumulation von Fluoxetin und seiner Metaboliten kommen [15]. Die mittlere orale Tagesdosis beträgt initial 20 mg. Eine etwaige Erhöhung der Dosierung sollte stets schrittweise erfolgen und 80 mg/Tag nicht überschreiten.
Aufgrund der geringen Affinität zu adrenergen und cholinergen Rezeptoren treten kardiovaskuläre und anticholinerge Nebenwirkungen, wie sie für trizyklische Antidepressiva beschrieben werden, bei SSRI praktisch nicht auf. Vor allem zu Therapiebeginn treten Kopfschmerzen, Schwindel, Schlafstörungen, Übelkeit und Diarrhö auf. Auch Agitiertheit und Störungen der Sexualfunktion werden beschrieben. Die Gefahr der erhöhten Suizidrate wurde bereits erwähnt. SSRI gelten sowohl als Substrate als auch als Inhibitoren von CYP450-Isoenzymen, sodass die Plasmaspiegel trizyklischer Antidepressiva, Neuroleptika und anderer Substanzen erhöht werden. Darüber hinaus vermindern SSRI die antiestrogene Wirkung von Tamoxifen durch Inhibition des CYP2D6-Isoenzyms. Aufgrund der Gefahr toxischer Serotonin-Konzentrationen im ZNS ist die gleichzeitige Behandlung mit Monoaminoxidase (MAO)-Inhibitoren kontraindiziert. Die lange Halbwertszeit von Fluoxetin und dessen aktiver Metabolite bedingt eine ausreichende Behandlungspause von mindestens fünf Wochen, ehe die Verabreichung eines MAO-Hemmers erfolgt [16].
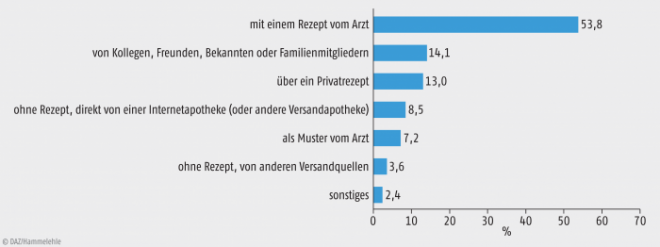
Abb. 2: Bezugsquellen für Arzneimittel zum Hirndoping Am häufigsten werden Medikamente zum Neuroenhancement von einem Arzt mit Rezept bezogen. Aber auch Freunde oder Familienmitglieder, die diese Wirkstoffe aus medizinischer Notwendigkeit heraus tatsächlich verschrieben bekommen haben, sind eine Quelle. Mehrfachnennungen möglich. (Quelle: [2])
Betablocker: Beispiel Metoprolol
Seit den 1970er Jahren werden Betablocker in Deutschland zur Therapie der arteriellen Hypertonie und koronaren Herzkrankheit eingesetzt und stellen heute die am häufigsten verordnete Medikamentengruppe in der Therapie von Herz-Kreislauf-Erkrankungen dar. Die blutdrucksenkende Wirkung beruht auf unterschiedlichen Mechanismen. Initial stehen zunächst kardiale Effekte im Vordergrund, wonach die aktivierende Wirkung von Adrenalin und Noradrenalin am Herz-Kreislauf-System blockiert wird. Längerfristig kommt eine verringerte Sympathikusaktivität sowie eine Hemmung des Renin-Angiotensin-Aldosteron-Systems hinzu. Daneben besitzen Betablocker auch beruhigende neurologische Effekte und wirken stabilisierend auf die psychomotorische Leistungsfähigkeit. Daher werden Vertreter wie Metoprolol (Beloc-Zok®, Jutabloc®) auch missbräuchlich eingenommen, um die mental ausgleichende Wirkung dieser Sympatholytika zu nutzen und die kognitiven Fähigkeiten in Stresssituationen zu steigern bzw. Prüfungsangst und Nervosität zu lindern.
Metoprolol
Entsprechend der klinisch gesicherten Wirkung der Betablocker auf das kardiovaskuläre System sowie der zentralen Dämpfung durch das lipophile Metoprolol, finden sich auch sympatholytische Effekte bei gesunden Personen. Hier werden bereits bei geringer Dosierung Symptome der Angst, Aufregung oder Nervosität effektiv reduziert [23]. Ein Off-label-Einsatz von niedrig dosiertem Metoprolol im Rahmen eines Neuroenhancements sollte zeitlich sehr begrenzt und ausschließlich unter strenger ärztlicher Kontrolle durchgeführt werden, um das Risiko von Nebenwirkungen zu minimieren und Kontraindikationen auszuschließen. Gefährliche Rebound-Effekte nach längerer, missbräuchlicher Anwendung können nicht ausgeschlossen werden und gegenteilige Effekte, wie Nervosität und Tachykardie induzieren. Auch fehlen klinisch gesicherte Daten zur Langzeitanwendung von Betablockern an gesunden Personen, weshalb eine längere Einnahme von Metoprolol, auch in niedriger Dosierung, nicht befürwortet werden darf.
Pharmakodynamik: Betablocker besitzen strukturelle Verwandtschaft zu den Katecholaminen Adrenalin und Noradrenalin und antagonisieren selektiv oder unselektiv β-Adrenozeptoren. Sie werden daher bei arterieller Hypertonie, tachykarden Herzrhythmusstörungen, Herzinsuffizienz und koronarer Herzkrankheit eingesetzt. Auch werden sie bei Tremor, zur Migräneprophylaxe, bei Glaukom und Hyperthyreose angewendet [5, 7, 19]. Metoprolol zeigt eine relative Selektivität für β1-Rezeptoren am Herzen. In niedriger Dosierung besitzt Metoprolol daher ein entsprechend günstiges Nebenwirkungsprofil. Dennoch muss bei höheren Dosierungen auch mit blockierenden Effekten am β2-Rezeptor gerechnet werden, da die Rezeptorselektivität begrenzt ist. Das lipophile Metoprolol ist in der Lage, die Blut-Hirn-Schranke zu passieren, so dass auch eine zentrale Dämpfung sympathischer Impulse möglich ist. Metoprolol wird zur antihypertensiven Therapie ausschließlich in retardierter Form als Tartrat bzw. Succinat eingesetzt, um eine gleichmäßige und langdauernde Wirkung zu garantieren.
Für die Behandlung der Herzinsuffizienz ist die Galenik bedeutsam, da bisher ausschließlich für Metoprolol-Succinat in einer Zero-Order-Kinetik (ZOK) eine Verringerung der Mortalität nachgewiesen wurde, nicht jedoch für Metoprolol-Tartrat [20]. Retardformulierungen ermöglichen die Freisetzung des Wirkstoffs über längere Zeit, weshalb trotz der kurzen terminalen Halbwertszeit von vier Stunden eine einmal tägliche Verabreichung ausreicht. Die mittlere orale Tagesdosis von Metoprolol beträgt 50 bis 200 mg, wobei die hohe Lipophilie der Substanz eine sehr gute Resorption aus dem Gastrointestinal-Trakt bedingt. Durch einen deutlichen First-pass-Effekt beträgt die orale Bioverfügbarkeit nur etwa 40%. Metoprolol wird nahezu ausschließlich über CYP2D6 abgebaut. Hierbei ist auf Polymorphismen im CYP2D6-Gen zu achten. Bei Poor-Metabolizern besteht die Gefahr einer relativen Überdosierung. Und auch bei pathologischen Veränderungen der Leber ist mit erhöhten Plasmaspiegeln zu rechnen. Die Elimination erfolgt überwiegend renal. Eine Langzeittherapie mit Betablockern darf keineswegs abrupt beendet werden. Es besteht die Gefahr eines Rebound-Effektes mit Blutdruckanstieg und Tachykardie. Eine dauerhafte Blockade der β-Rezeptoren führt zu einer Zunahme der Rezeptordichte und erhöht die Empfindlichkeit des Zielgewebes für Katecholamine, sodass die Therapie stets ausschleichend abgesetzt werden sollte.
Fazit
Obwohl die Verbreitung von Hirndoping in Deutschland zum aktuellen Zeitpunkt noch gering ist, sollte das Risiko der Arzneimitteleinnahme zum Neuroenhancement nicht unterschätzt werden. Wie die Beispiele zeigen, geht ein Missbrauch von Psychostimulanzien, Nootropika, Antidepressiva oder Betablockern stets mit der Gefahr schwerwiegender Nebenwirkungen einher, wobei eine positive Wirkung der Substanzen bei gesunden Personen in den seltensten Fällen klinisch gesichert erscheint.
Bei einer nicht indizierten Einnahme verschreibungspflichtiger Pharmaka zur Erhöhung der kognitiven Leistungsfähigkeit besteht generell auch immer ein hohes Risiko für die Entwicklung einer psychischen Abhängigkeit, da die betroffenen Personen zu dem Schluss gelangen, dem Leistungsdruck nur standhalten zu können, wenn entsprechende Präparate eingenommen werden. Dies erhöht die Wahrscheinlichkeit körperlicher Langzeitfolgen sowie sozialer und finanzieller Konflikte.
Eine umfassende psychologische Betreuung der betroffenen Personen ist daher ebenso indiziert wie verhaltenspräventive Maßnahmen, um Mitarbeiter und Mitarbeiterinnen gegenüber Abhängigkeitspotenzialen und gesundheitlichen Risiken zu sensibilisieren und einen Missbrauch von vermeintlichen Neuroenhancern frühzeitig zu verhindern.
Unerwünschte Wirkungen und Kontraindikationen: Nebenwirkungen wie Bradykardie und AV-Überleitungsstörungen leiten sich von den negativ chronotropen und dromotropen Effekten am Herzen ab. Eine Vasokonstriktion kann zudem die Gewebedurchblutung vermindern und dadurch periphere Durchblutungsstörungen verstärken. Zusätzlich werden bei lipophilen Stoffen zentralnervöse Nebenwirkungen wie Müdigkeit und depressive Verstimmung beobachtet. Auch Potenzprobleme traten auf. Durch die Blockade von β2-Rezeptoren bedingte unerwünschte Arzneimittelwirkungen sind auch bei Metoprolol nicht ganz auszuschließen. Somit kann die Relaxation der glatten Bronchialmuskulatur verhindert und ein Asthmaanfall ausgelöst werden. Auch kann die Hemmung der Glykogenolyse in der Leber die Gefahr einer Hypoglykämie bei Diabetikern erhöhen, wobei Warnsymptome (Tachykardie, Tremor, Schwitzen) vom Patienten unbemerkt bleiben. Zu den Kontraindikationen zählen schweres Asthma bronchiale, akute Herzinsuffizienz, Bradykardie, Erregungsleitungsstörungen (AV-Block 2. oder 3. Grades) sowie periphere Durchblutungsstörungen. Besondere Vorsicht bei der Therapie mit Betablockern ist zudem bei eingeschränkter Leberfunktion oder Diabetes mellitus indiziert. Für Metoprolol als kardioselektivem Vertreter ist eine Anwendung bei leichten Formen des Asthma bronchiale unter Einschränkung möglich [21, 22]. |
Quelle
[1] Hirndoping am Arbeitsplatz – Einflussfaktoren und Präventionsmöglichkeiten für Unternehmen. Initiative Gesundheit und Arbeit. www.iga-info.de
[2] DAK Studie: Doping im Job nimmt deutlich zu. Aus: DAK Gesundheitsreport 2015, www.dak.de, 31. März 2015
[3] Leonard BE et al. Methylphenidate: a review of its neuropharmacological, neuropsychological and adverse clinical effects. Hum Psychopharmacol Clin Exp 2004;19:151-180
[4] Nissen SE. ADHD drugs and cardiovascular risk. N Engl J Med 2006;354:1445-1448
[5] Mutschler E et al. Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage, Wissenschaftliche Verlagsgesellschaft, Stuttgart 2013
[6] Nevels RM et al. Methylphenidate and Its Under-recognized, Under-explained, and Serious Drug Interactions: A Review of the Literature with Heightened Concerns. Germ J Psychiatry 2013;16:29-42
[7] Aktories K et al. Förstermann, Ulrich; Hofmann, Franz Bernhard; Starke, Klaus; Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage, Urban & Fischer Verlag, München 2009
[8] Repantis D et al. Psychopharmakologisches Neuroenhancement – Aktuelle Möglichkeiten, Risiken und Perspektiven. Berlin: Charité Centrum für Neurologie, Neurochirurgie und Psychiatrie 2008
[9] Demenzen. S3-Leitlinie der Deutschen Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (DGPPN) und der Deutschen Gesellschaft für Neurologie (DGN), 2009
[10] Demenz. Leitlinie der Deutsche Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) Nr. 12, 2008
[11] Oberdisse E et al. Pharmakologie und Toxikologie. 3. Auflage, Springer Verlag, Luxemburg, Berlin 2001
[12] Estler CJ et al. Pharmakologie und Toxikologie: für Studium und Praxis ; mit Geleitwort von Eckhart von Hirschhausen. 6. Auflage, Schattauer GmbH, Stuttgart 2006
[13] Teicher MH et al. Emergence of intense suicidal preoccupation during fluoxetine treatment. Am J Psychiatry 1990;147:207-210
[14] Fluoxetin. pharma-kritik 2013;19:PK561, www.infomed.ch
[15] Aronoff GR et al. Fluoxetine kinetics and protein binding in normal and impaired renal function. Clin Pharmacol Ther 1984;36:138-144
[16] Gysling E. Aktuelle Arzneimittel-Interaktionen. pharma-kritik 1991;13:69-72
[17] Franke A, Lieb K. Pharmakologisches Neuroenhancement und Hirndoping – Chancen und Risiken. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 2010;8:853–859
[18] Kontrollierte Drogen (Arzneimittel) – Psychopharmaka. Arbeitsblätter www.stangl-taller.at, 31. März 2015
[19] Herdegen T. Kurzlehrbuch Pharmakologie und Toxikologie. 3. Auflage. Thieme Verlagsgruppe, Stuttgart 2013
[20] Barron AJ et al. Systematic review of genuine versus spurious side-effects of beta-blockers in heart failure using placebo control: Recommendations for patient information. Int J Cardiol. 2013. doi: 10.1016/j.ijcard.2013.05.068
[21] Salpeter EE et al. Cardioselective beta-blockers in patients with reactive airway disease: a meta-analysis. Ann Intern Med. 2002;137(9):715-25
[22] Quint JK et al. Effect of beta blockers on mortality after myocardial infarction in adults with COPD: population based cohort study of UK electronic healthcare records BMJ 2013;347:f6650
[23] Lieb, K. Hirndoping. Warum wir nicht alles schlucken sollten. 2. Auflage. Artemis & Winkler, Mannheim 2010
Autor
Apotheker Dr. André Said studierte von 2004 bis 2008 Pharmazie an der FU Berlin. Die Approbation als Apotheker erhielt er 2010 und arbeitete anschließend als Doktorand im Fachbereich Pharmakologie/Toxikologie an der FU Berlin bei Prof. Dr. Günther Weindl. Seine Promotion mit dem Titel: „Funktionelle Charakterisierung von dendritischen Zellen unter entzündlichen Bedingungen in vitro und Integration in humane Vollhautäquivalente“ schloss er 2014 erfolgreich ab. Seit 2013 ist Dr. André Said für die DAZ als freier Autor tätig.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.