
- DAZ.online
- DAZ / AZ
- DAZ 48/2014
- Chance OTC-Switch
Zulassung
Chance OTC-Switch
Die Entlassung von Arzneimitteln aus der Verschreibungspflicht
Der Sachverständigenausschuss für Verschreibungspflicht befasst sich schwerpunktmäßig mit der Entlassung von Arzneimitteln aus der Verschreibungs- in die Apothekenpflicht. Der BAH engagiert sich als Mitglied in diesem Ausschuss seit nunmehr 35 Jahren. Der Switch ist im Laufe der Jahre zu einer echten Erfolgsstory geworden – für Patient und Apotheker gleichermaßen.
Deutschland ist Spitzenreiter bei OTC-Switchen
Deutschland gehörte in den letzten drei Jahrzehnten zu den erfolgreichsten Switch-Ländern Europas und weltweit. Dies zeigt der Vergleich ausgewählter Arzneistoffe in den EU-Ländern Deutschland, Großbritannien, Italien, Frankreich und Schweden sowie in den USA und Japan. Verglichen wurde die Verfügbarkeit von über 30 bedeutenden rezeptfreien Wirkstoffen in wichtigen Indikationen wie Schmerz, Allergie, Husten/Schnupfen, Magen/Darm-Beschwerden, Pilzerkrankungen sowie Migräne. In diesen für die Selbstmedikation zugänglichen Indikationen sind in Deutschland viele Arzneimittel verschreibungsfrei erhältlich. Der deutsche Spitzenplatz im internationalen Vergleich wurde durch die Entlassungen der Triptane zur Behandlung der Migräne und Omeprazol bei Sodbrennen und saurem Aufstoßen weitere Male untermauert.
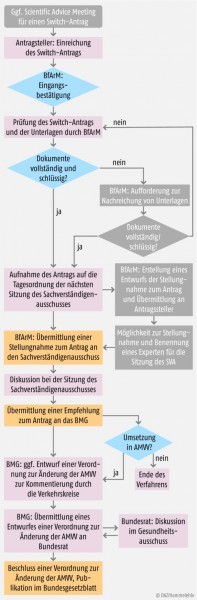
Das deutsche Verfahren bei Änderungen der Verschreibungspflicht
Zentrale Akteure im Switch-Verfahren sind der Arzneimittel-Hersteller, die zuständige Bundesoberbehörde (in den überwiegenden Fällen also das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)), der beim BfArM ansässige Sachverständigenausschuss für Verschreibungspflicht, das Bundesministerium für Gesundheit (BMG) und der Bundesrat mit seinem Gesundheitsausschuss.
Das Verfahren startet in der Regel mit einem Antrag des Herstellers auf Entlassung eines Arzneimittels aus der Verschreibungspflicht. Anschließend prüft die zuständige Bundesoberbehörde den Antrag. Nach Prüfung auf Vollständigkeit und Schlüssigkeit wird der Antrag auf die Tagesordnung der nächsten Sitzung des Sachverständigenausschusses genommen. Dieser tagt in der Regel zweimal jährlich. Die Bundesoberbehörde erstellt zu dem Antrag eine Stellungnahme, die die Ausschussmitglieder vorab erhalten. Auf Basis dieser Unterlagen bewertet der Ausschuss den Antrag und verabschiedet eine Empfehlung gegenüber dem BMG.
Diese Empfehlung ist nicht bindend: Das BMG kann die Empfehlung umsetzen, modifizieren oder ablehnen. Wenn das BMG zugestimmt hat, wird ein Entwurf einer Verordnung zur Änderung der Arzneimittelverschreibungsverordnung (AMVV) dem Bundesrat zur Zustimmung zugeleitet, der wiederum seinen Gesundheitsausschuss mit der Prüfung befasst.
Die Zustimmung des Bundesrates war in der Vergangenheit eher eine Formsache; inhaltliche Änderungen waren äußerst selten. In jüngster Zeit bringt sich der Bundesrat jedoch aktiver in diesen Prozess ein. Das ganze Verfahren nimmt von der Antragstellung bis zur Publikation im Bundesgesetzblatt im günstigsten Fall rund sechs Monate in Anspruch, kann aber auch bedeutend länger dauern oder ganz scheitern.
Anfangsphase des Sachverständigenausschusses für Verschreibungspflicht
Bereits das „alte“ Arzneimittelgesetz (AMG) von 1961 sah für Fragen der Vertriebsabgrenzung nach § 35a und 38a AMG einen beratenden Beirat vor; die Einstufung des Vertriebsstatus eines Arzneimittels in verschreibungspflichtig oder nicht-verschreibungspflichtig lag jedoch in der Kompetenz der Zulassungsbehörde.
Mit der Einführung des „neuen“ Arzneimittelgesetzes im Jahr 1976 wurden dann – nicht zuletzt aufgrund der Erfahrungen mit dem früheren Beirat – erstmals Sachverständigenausschüsse als fachliche Beratungsgremien für Fragen der Vertriebsabgrenzung im Arzneimittelgesetz verankert.
Als erster Ausschuss wurde am 1. Januar 1978 der Sachverständigenausschuss für Verschreibungspflicht vom damals zuständigen Bundesministerium für Jugend, Familie und Gesundheit berufen. Von Anfang an gehörte auch ein Vertreter des BAH (der damals noch unter dem Namen Bundesfachverband der Heilmittelindustrie firmierte) dem Ausschuss an. Der Ausschuss nahm unverzüglich seine Arbeit auf und etablierte die noch heute gültige Sitzungsfrequenz von zwei Sitzungen jährlich.
Ein Schwerpunkt der Ausschuss-Arbeit: Bewertung von Schmerzmitteln
Bereits zu Beginn der Arbeit des Sachverständigenausschusses, also in den 80er Jahren, standen Schmerzmittel im Mittelpunkt. So wurde bereits bei der ersten Sitzung über das Nutzen-Risiko-Profil von Acetylsalicylsäure und Phenacetin beraten. Auch Paracetamol war in der Folge vielfach Gegenstand von Beratungen im Ausschuss. Der Ausschuss kam stets zu der Auffassung, dass Paracetamol-haltige Produkte ein positives Nutzen-Risiko-Profil aufweisen; zuletzt wurde diese Auffassung 2012 bestätigt. Allerdings wurde 2009 die Packungsgröße rezeptfreier Paracetamol-Präparate zur Vermeidung einer missbräuchlichen Anwendung auf 10 g begrenzt. Diese Entscheidung bot Anlass zu weitergehenden Diskussionen zur Frage der Packungsgröße auch bei anderen rezeptfreien Analgetika. Der Ausschuss hat hierzu zwischen 2009 und 2012 diverse Male beraten und unterschiedliche Beschlüsse gefasst; zuletzt empfahl der Ausschuss im Juni 2012 mehrheitlich eine Begrenzung der Packungsgröße auf eine maximal viertägige Anwendung. Um eine bestmögliche Umsetzung der Empfehlung vornehmen zu können, hat das BMG unlängst das Robert Koch-Institut (RKI) beauftragt, in einer Studie die Gebrauchsgewohnheiten von Schmerzmitteln zu untersuchen.
Umgekehrt wurde im Laufe der vergangenen Jahre eine Vielzahl von analgetischen Wirkstoffen aus der Verschreibungspflicht entlassen. Einige dieser Switche stellten wegweisende Entscheidungen für die Entwicklung des Selbstmedikationssektors in Deutschland dar. Zuvorderst ist hier auf die 1989 erfolgte Freistellung von Ibuprofen – sowohl oral zur Behandlung von leichten bis mittelstarken Schmerzen und Fieber als auch topisch bei Rheuma – von der Rezeptpflicht hinzuweisen. Es folgten sukzessive zusätzliche Darreichungsformen und Wirkstärken. Nach diesem Durchbruch konnten weitere Wirkstoffe zur Behandlung von Rheuma (u.a. Diclofenac 1999) in topischer Form aus der Verschreibungspflicht in die Selbstmedikation entlassen werden. 2002 folgte dann die Entlassung von Naproxen sowie oralen Formen von Diclofenac (2004 und 2009) gegen Schmerzen.
Der nächste Durchbruch konnte 2006 mit der weltweit ersten Freistellung eines Triptans – Naratriptan – zur Behandlung der Migräne erreicht werden. Mit dieser Entscheidung erkannte sowohl der Sachverständigenausschuss als auch das BMG offiziell an, dass die Behandlung der Migräne – nach einer vorherigen Diagnose durch einen Arzt – eine für die Selbstmedikation geeignete Indikation ist.
Nicht umgesetzte Empfehlungen
In den vergangenen Jahren gab es einige wenige Fälle, bei denen das BMG die vom Sachverständigenausschuss für Verschreibungspflicht empfohlenen Entlassungen aus der Verschreibungspflicht nicht umgesetzt hat. Dies betrifft unter anderem die bislang nicht erfolgte Entlassung von Calcipotriol (ein Psoriasismittel) und den Wirkstoff Levonorgestrel („Pille danach“). Während bei Levonorgestrel eher grundsätzliche Gründe das BMG bewogen, von einer Umsetzung abzusehen, war es bei Calcipotriol der Einspruch der entsprechenden Fachgesellschaft. Darüber hinaus gab es weitere nicht umgesetzte Empfehlungen, wie etwa bei Sumatriptan sowie Zolmitriptan.
Europäischer Switch: Eine interessante Alternative
Die Einstufung eines Wirkstoffs als verschreibungspflichtig oder nicht ist in Europa eine rein nationale Angelegenheit. Jeder Mitgliedstaat hat hierzu eigene Verfahren mit nationalen Besonderheiten entwickelt. Dies macht es einem international operierenden Unternehmen nicht leicht, europaweit ein Produkt in den OTC-Status – sprich in den verschreibungsfreien Zustand – zu überführen. Einen Wirkstoff in der EU zentral zu „switchen“, hat deshalb eine hohe Attraktivität. Ein zentraler Switch muss bei der europäischen Zulassungsbehörde (EMA) beantragt und im Europäischen Ausschuss für Humanarzneimittel (CHMP) diskutiert werden. Der CHMP erstellt eine Empfehlung, und die Europäische Kommission fällt abschließend eine Entscheidung. Soll der Wirkstoff aus der Verschreibungspflicht entlassen werden, ist diese Entscheidung in allen EU-Mitgliedstaaten bindend.
Ein erstes erfolgreiches Beispiel für einen zentralen Switch war Orlistat, ein Mittel zur Gewichtsreduktion. Dabei handelte es sich um einen Antrag auf Erweiterung einer bereits bestehenden europäischen Zulassung. Der zweite Fall mit dem Wirkstoff Pantoprazol ging sogar noch weiter, war es doch das erste Beispiel für einen zentralen europäischen Neuzulassungsantrag direkt für ein rezeptfreies Arzneimittel. Mit dem Protonenpumpenhemmer Esomeprazol wurde 2013 eine weitere Substanz zentral für die ganze Europäische Union aus der Verschreibungspflicht entlassen. Für eine weitere Substanz – Ulipristal zur Notfallkontrazeption – hat der CHMP unlängst die Entlassung aus der Verschreibungspflicht empfohlen. Die endgültige Entscheidung muss nun die Europäische Kommission treffen.
Die Vorteile einer zentralen Entlassung aus der Verschreibungspflicht in der Europäischen Union sind auf den ersten Blick bestechend, erhält man auf diese Weise doch sofort Zugang zum gesamten EU-Markt. Jedoch gibt es auch Nachteile: Nach Rechtsauffassung der Europäischen Kommission kann es kein Nebeneinander von wirkstoffgleichen Produkten mit zentraler und nationaler Zulassung und auch keinen Raum für eine zusätzliche wissenschaftliche Bewertung und regulatorische Entscheidungen für das gleiche Arzneimittel auf nationaler Ebene geben. Wenn die europäische Entscheidung negativ ausfällt, es also keine EU-weite Entlassung aus der Verschreibungspflicht gibt, dürfen anschließend keine national begrenzten Entlassungsanträge mehr gestellt werden.
In aktuellen Verfahren wird diese Rechtsauffassung der EU-Kommission intensiv diskutiert; es bleibt möglicherweise einem Rechtsstreit überlassen, welcher Spielraum in solchen Konstellationen letztendlich für nationale Entscheidungen verbleibt. Das zentrale Verfahren der Entlassung aus der Verschreibungspflicht kann ein ganz wesentlicher Fortschritt zur Stärkung der Selbstmedikation und zur Überwindung der „Kleinstaaterei“ bezüglich der Vertriebsabgrenzung werden, birgt aber auch hohe Risiken. Das Verfahren muss weiter getestet werden, bevor eine abschließende Bewertung getroffen werden kann.
Wichtige Änderung der Zusammensetzung des Ausschusses nach 35 Jahren
Seit Arbeitsbeginn des Sachverständigenausschusses für Verschreibungspflicht am 1. Januar 1978 blieb auch die in § 53 AMG sowie der „Verordnung zur Errichtung von Sachverständigenausschüssen für Standardzulassungen, Apothekenpflicht und Verschreibungspflicht von Arzneimitteln“ festgelegte Zusammensetzung des Ausschusses in Verbindung mit den Stimmrechten im Wesentlichen unverändert. Mit dem Zweiten AMG-Änderungsgesetz (der sogenannten „16. AMG-Novelle“) wurde die seit Jahrzehnten bewährte Regelung zum Sachverständigenausschuss für Verschreibungspflicht dahingehend geändert, dass die Vertreter der Praxis – sowohl niedergelassene Ärzte, Apotheker und Heilpraktiker als auch die Vertreter der Arzneimittel-Hersteller – zwar weiterhin Mitglieder des Ausschusses sind, jedoch ohne Stimmrecht.
Im Gegenzug wurde die Präsenz der Hochschullehrer der verschiedenen medizinischen Fachrichtungen sowie der Pharmazie ausgebaut und zusätzlich Vertreter der Arzneimittelkommissionen der Ärzte, Apotheker und Tierärzte als stimmberechtigte Mitglieder berufen. Mit Inkrafttreten der gesetzlichen Neuregelungen gehören dem Ausschuss nunmehr 13 stimmberechtigte und 10 nicht stimmberechtigte Mitglieder an. Als Begründung für diesen Vorschlag wurde angegeben, dass „Fragen der Arzneimittelsicherheit [...] auf Basis rein wissenschaftlich fundierter Voten entschieden werden“ müssten. Eine Neujustierung der Stimmverhältnisse sei dadurch notwendig geworden, dass Fragen der Verschreibungspflicht nun im unmittelbaren Zusammenhang mit ökonomischen Fragen stünden. Die insbesondere von den Verbänden der Arzneimittel-Hersteller vorgebrachte Kritik gegenüber dieser Benachteiligung der Praxisvertreter fand leider keine Akzeptanz beim Gesetzgeber. Die erste Sitzung des „neuen“ Ausschusses fand am 25. Juni 2013 statt.
BAH fordert mehr Pragmatismus, Transparenz und die Beibehaltung der Apothekenpflicht
In den letzten Jahren führten immer wieder regulatorische Probleme zu langen Verzögerungen bei der Umsetzung von Empfehlungen des Sachverständigenausschusses für Verschreibungspflicht; in manchen Fällen erfolgt die Umsetzung überhaupt nicht, obwohl die betroffenen Substanzen unstrittig für die Selbstmedikation geeignet wären.
Wünschenswert wäre es, wenn die zuständigen Behörden frühzeitig mit dem Antragsteller in Dialog treten und mögliche Handlungsoptionen diskutieren würden. Als besonders pragmatisch in diesem Sinne hat sich die britische Zulassungsbehörde erwiesen; in Deutschland besteht diesbezüglich noch Potenzial. Der Antragsteller eines Switch-Verfahrens erhält beispielsweise über die Inhalte der Bewertung und auch des Bewertungsberichts des BfArM, welcher dem Sachverständigenausschuss vorgelegt wird, keinerlei Informationen.
Vor diesem Hintergrund hat der BAH zusammen mit einer Gruppe von Experten im Jahre 2013 Vorschläge erarbeitet, das Switch-Verfahren transparenter und effizienter zu gestalten. Erfreulicherweise haben BfArM und BMG einige der Anregungen aufgegriffen und bereits in die Praxis umgesetzt. So werden seit Kurzem die Beschlüsse des Ausschusses erheblich ausführlicher protokolliert. Der BAH wird sich für die weitere Optimierung des Verfahrens einsetzen.
Überlegungen gibt es auch hinsichtlich neuer, für die Selbstmedikation geeigneter Indikationen. Bisher orientieren sich Switches nämlich an Wirkstoffen. Denkbar wäre es, bei bestimmten Indikationen, wie Harnwegsentzündungen, die Akuttherapie von höchstens drei Tagen in die Hand des Apothekers zu geben. Bei Migräne hat sich dieses Prinzip bereits bewährt. Der Patient profitiert hiervon, beispielsweise wenn das Medikament am Wochenende dringend benötigt wird und er den Apotheker seines Vertrauens aufsuchen kann. Wartezeiten beim Arzt oder der Besuch des ärztlichen Notdienstes könnten so vermieden werden. Zudem bietet dies dem Apotheker die Chance, seine Kernkompetenz – nämlich die Beratung – weiter auszubauen. Notwendig hierfür sind die freiberuflich-inhabergeführten Apotheken und die Beibehaltung der grundsätzlichen Apothekenpflicht auch bei Switches. Für beides setzt sich der BAH nicht nur heute, sondern auch in Zukunft entschieden ein.
Autor
Dr. rer. nat. Elmar Kroth, Chemiker, ist seit 2010 Geschäftsführer Wissenschaft des Bundesverbandes der Arzneimittel-Hersteller (BAH). Zuvor war er wissenschaftlicher Mitarbeiter sowie Leiter der Arzneimittelsicherheit beim BAH. Seit 2010 ist er Mitglied im Sachverständigenausschuss für Verschreibungspflicht. Darüber hinaus engagiert er sich in zahlreichen europäischen und internationalen Gremien für die Interessen der Arzneimittel-Hersteller.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.