
- DAZ.online
- DAZ / AZ
- DAZ 45/2014
- Das Rennen geht weiter
Arzneimittel und Therapie
Das Rennen geht weiter
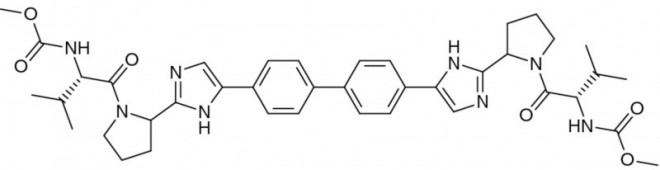
Daclatasvir als weitere Möglichkeit gegen Hepatitis C
Daclatasvir wurde durch ein beschleunigtes Bewertungsverfahren des Ausschusses für Humanarzneimittel (CHMP) der EMA zugelassen, wodurch der Wettbewerb um die Behandlung – respektive Heilung – der Hepatitis C angefeuert wird. Das beschleunigte Verfahren steht nur Wirkstoffen offen, die von großem öffentlichem Interesse für die Gesundheit sind. Nachdem jahrelang zur Behandlung der chronischen Hepatitis C nur die Interferon-Therapie zur Verfügung stand, später modifiziert durch pegyliertes Interferon alfa in Kombination mit dem Virustatikum Ribavirin und zuletzt den HCV-Protease-Inhibitoren und direkt wirkenden antiviralen Mitteln (DAA) Boceprevir und Telaprevir, können seit diesem Jahr durch Sofosbuvir und jetzt auch durch Daclatasvir hohe Heilungsraten bei kurzen Therapieregimen mit niedriger Pillenlast erreicht werden.
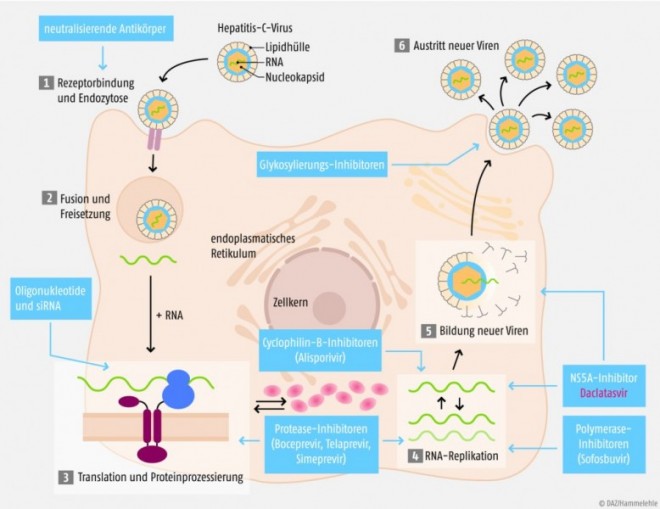
Wer oder was ist DAA?
Direkt wirkende antivirale Mittel (direct-acting antiviral agents, DAAs) unterdrücken die Replikation der Virus-RNA und greifen somit direkt in den Lebenszyklus des HC-Virus ein. Man unterscheidet derzeit vier Gruppen, die an drei viralen Proteintargets angreifen: NS3/4A-Protease-Inhibitoren, NS5B-Polymerase-Inhibitoren (nukleosidisch oder nicht-nukleosidisch) und NS5A-Inhibitoren. Die Hepatitis-C-Therapie der Zukunft wird vermutlich aus einer Kombination zweier oder mehrerer DAAs verschiedener Gruppen bestehen. Erreichbare Ziele einer solchen Kombination sind ein geringes Resistenzrisiko, eine kurze Behandlungsdauer, ein dauerhaftes virologisches Ansprechen und damit eine Heilung der Erkrankung.
Genotyp entscheidet die Therapie
Daclatasvir (Daklinza®) wurde europaweit zur Behandlung der chronischen Hepatitis C bei Erwachsenen als Teil einer Zweifach-Kombinationstherapie mit Sofosbuvir oder einer Dreifach-Kombinationstherapie mit Ribavirin und Sofosbuvir oder Ribavirin und pegyliertem Interferon alfa zugelassen. Daklinza® darf nicht als Monotherapie angewendet werden, auch nicht, wenn ein oder mehrere Kombinationspartner aufgrund von Nebenwirkungen oder ungenügendem virologischem Ansprechen abgesetzt werden müssen [2]. Die Dauer der Therapie und Art des Kombinationspartners richten sich nach vorhandenem HCV-Genotyp und Zirrhose-Status:
- Die Interferon-freie Behandlung aus Daclatasvir und Sofosbuvir ist für Patienten mit dem HCV-Genotyp 1 oder 4 möglich. Dabei beträgt die Therapiedauer zwölf Wochen für Patienten ohne Zirrhose (bzw. 24 Wochen für vorbehandelte Patienten ohne Zirrhose) und 24 Wochen für Patienten mit kompensierter Zirrhose (bzw. zwölf Wochen für therapienaive Patienten mit Zirrhose aber günstigen Prognosefaktoren und/oder niedriger Ausgangsviruslast).
- Zum Genotyp 2 wurden zwar Studien durchgeführt, in der Fachinformation werden aber keine Empfehlungen zu Behandlungsregimen und -dauer ausgesprochen.
- Die Interferon-freie Dreifach-Kombination aus Daclatasvir, Sofosbuvir und Ribavirin wird angewendet bei Patienten mit HCV-Genotyp 3, die zusätzlich eine kompensierte Zirrhose aufweisen und/oder vorbehandelt sind.
- Patienten mit dem Genotyp 4 können Daclatasvir auch mit dem früheren Standardregime aus Ribavirin und Peginterferon alfa kombinieren. Zeigt der Patient in den Therapiewochen 4 und 12 keine nachweisbaren HCV-RNA-Titer mehr, kann die gesamte Behandlung nach 24 Wochen beendet werden. Erreicht der Patient erst zu einem späteren Zeitpunkt nicht nachweisbare HCV-RNA-Titer, wird Daclatasvir nach 24 Wochen abgesetzt, Peginterferon alfa und Ribavirin aber für weitere 24 Wochen fortgeführt.
- Daclatasvir wurde nicht an Patienten untersucht, die mit dem HCV-Genotyp 5 oder 6 infiziert sind, weshalb keine Empfehlung für ein Behandlungsregime dieser Patientengruppe gegeben werden kann.
Angriff an zwei Stellen
Man nimmt an, dass NS5A-Hemmer wie Daclatasvir die Vermehrung des HC-Virus gleich an zwei Stellen stören und dadurch dessen Lebenszyklus effektiv unterbrechen. Der Wirkmechanismus ist aber noch nicht vollständig aufgeklärt. Fest steht, dass das gehemmte HCV-Nichtstrukturprotein NS5A multifunktional ist. Es spielt zum einen eine entscheidende Rolle bei der Formation des RNA-Replikationskomplexes, welcher für die RNA-Replikation des Virus-Genoms erforderlich ist, und ist zum anderen beim späteren intrazellulären Zusammenbau der Viruspartikel, dem sogenannten Assembly, von Bedeutung. Durch NS5A-Inhibition wird somit an zwei verschiedenen Stellen die Synthese funktionsfähiger Viren verhindert, was das in den Studien beobachtete schnelle Ansprechen auf die antivirale Therapie mit Daclatasvir erklären könnte (siehe unten).
Dosierung und Einnahmehinweise
Daklinza® wird einmal täglich 60 mg zu oder unabhängig von einer Mahlzeit eingenommen [2]. Die Dosierung muss auf einmal täglich 30 mg reduziert werden, wenn gleichzeitig starke CYP3A4-Inhibitoren eingenommen werden, da diese die Daclatasvir-Plasmaspiegel durch Hemmung des Abbaus erhöhen (siehe Kasten Steckbrief). Werden hingegen gleichzeitig moderate Induktoren von CYP3A4 eingenommen (z.B. Efavirenz), ist die Dosierung auf einmal täglich 90 mg zu erhöhen. Für die Effektivität der Therapie ist eine gute Therapietreue Voraussetzung, und es wird empfohlen, die Tablette möglichst immer zur gleichen Zeit einzunehmen. Bei älteren Patienten und bei Patienten mit beeinträchtigter Leber- oder Nierenfunktion ist keine Dosisanpassung erforderlich. Aufgrund eines unangenehmen Geschmacks sollte Daklinza® stets im Ganzen eingenommen und weder zerkaut noch zerteilt werden.
Steckbrief
Handelsname: Daklinza®
Hersteller: Bristol-Myers Squibb GmbH & Co. KGaA
Einführungsdatum: 15. September 2014
Zusammensetzung: 30 mg bzw. 60 mg Daclatasvir; sonstige Bestandteile mit bekannter Wirkung: Lactose
Stoffklasse: antivirale Mittel zur systemischen Anwendung, direkt wirkende antivirale Mittel, andere antivirale Mittel; ATC-Code: J05AXIndikation: Daclatasvir wird in Kombination mit anderen Arzneimitteln zur Behandlung der chronischen Infektion mit dem Hepatitis-C-Virus (HCV) bei Erwachsenen angewendet.
Dosierung: Die empfohlene Dosis von Daclatasvir ist 60 mg einmal täglich. Es kann mit oder unabhängig von den Mahlzeiten eingenommen werden. Daclatasvir muss in Kombination mit anderen Arzneimitteln (Sofosbuvir, Ribavirin, Peginterferon alfa) angewendet werden.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff; Koadministration mit Arzneimitteln, die starke Induktoren für CYP3A4 und P-Glycoprotein-Transporter (P-gp) sind
Nebenwirkungen: Daclatasvir in Kombination mit Sofosbuvir: Die am häufigsten berichteten Nebenwirkungen waren Ermüdung, Kopfschmerz und Übelkeit. Es wurden keine Nebenwirkungen vom Grad 3 oder 4 berichtet. Daklinza in Kombination mit Peginterferon alfa und Ribavirin: Die häufigsten Nebenwirkungen waren Ermüdung, Kopfschmerz, Pruritus, Schlaflosigkeit, grippeähnliche Erkrankung. Die häufigsten Nebenwirkungen vom Schweregrad 3 oder höher waren Neutropenie, Anämie und Lymphopenie.
Wechselwirkungen: Daclatasvir ist ein Substrat von CYP3A4 und P-gp. Starke oder moderate Induktoren von CYP3A4 und P-gp können die Plasmaspiegel und therapeutische Wirksamkeit von Daclatasvir senken. Es ist kontraindiziert in Kombination mit Arzneimitteln, die starke Induktoren für CYP3A4 und P-gp sind, z. B. Phenytoin, Carbamazepin, Oxcarbazepin, Phenobarbital, Rifampicin, Rifabutin, Rifapentin, systemisch angewendetes Dexamethason und das pflanzliche Mittel Johanniskraut, da dies zu Wirksamkeitsverlust führen kann.Warnhinweise und Vorsichtsmaßnahmen: Daclatasvir darf nicht als Monotherapie angewendet werden, sondern muss mit anderen Arzneimitteln zur Behandlung der chronischen HCV-Infektion kombiniert werden. Das Behandlungsregime muss entsprechend des HCV-Genotyps ausgewählt werden. Daclatasvir darf nicht während der Schwangerschaft oder bei Frauen im gebärfähigen Alter, die nicht verhüten, angewendet werden.
Heilungsraten vielversprechend
Daclatasvir führte in Kombination mit 400 mg Sofosbuvir zu einer schnellen und effektiven Senkung der Viruslast, auch bei Patienten mit fortgeschrittener Lebererkrankung, den schwer zu behandelnden HCV-Genotypen 1a und 3, dem non-CC IL28B-Genotyp und bei Patienten, die nicht auf vorangegangene Therapien mit HCV-Proteaseinhibitoren angesprochen haben. In einer randomisierten Open-Label-Studie nach Anwendung der Zweifachkombination (ggfs. noch zusätzlich mit Ribavirin) für zwölf beziehungsweise 24 Wochen konnten Heilungsraten von 89 bis 100% erzielt werden [3]. Es kann kritisiert werden, dass Patienten mit Zirrhose ausgeschlossen wurden, dies wäre sicherlich ein Faktor gewesen, der die Höhe der Heilungsrate gesenkt hätte. Der primäre Endpunkt der Studie war ein dauerhaftes virologisches Ansprechen (SVR), welches als nicht nachweisbare Hepatitis-C-Viruslast zwölf Wochen nach Behandlungsende definiert wird (SVR12). 201 von 211 Patienten mit den HCV-Genotypen 1, 2 oder 3 erreichten dieses Ziel, dies entspricht 95%. Auffällig war, dass die meisten Teilnehmer sehr schnell auf die Therapie ansprachen. Schon in der vierten Woche zeigten mehr als 97% eine Viruslast unterhalb der unteren Bestimmungsgrenze von weniger als 25 IU/ml. Genauer betrachtet erreichten fast alle (98%, n = 124 von 126) nicht vorbehandelte Patienten mit dem Genotyp 1 eine anhaltende Virus-Suppression zwölf Wochen über das Therapieende hinaus. Die Heilungsraten betrugen 96% (n = 25 von 26) der vom Genotyp 2 infizierten Patienten und 89% der Patienten mit dem Genotyp 3 (n = 16 von 18), beide Gruppen waren jedoch therapienaiv und damit vermutlich einfacher zu therapieren. Bei den erfolglos mit Telaprevir oder Boceprevir vorbehandelten Patienten des Genotyps 1 wiesen erfreuliche 98% (n = 40 von 41) eine SVR12 auf, nachdem sie für 24 Wochen mit der Zweifach-Kombination oder der um Ribavirin ergänzten Dreifach-Kombination behandelt wurden. Eine zusätzliche Therapie mit Ribavirin führte nicht zu erhöhten Heilungsraten, sondern zu niedrigeren (94% vs. 98%). Dies mag daran liegen, dass die Patienten, deren Erkrankungszustand eine Dreifach-Kombination erforderlich machte, schwerer zu therapieren waren.
Therapieerfolg abhängig von Polymorphismen?
Nur ein Proband mit dem Genotyp 3, welcher zunächst auf die Behandlung mit Daclatasvir und Sofosbuvir ansprach, erlitt nach dem Therapieende einen Rückfall. Dieser Patient wies vor Behandlungsbeginn und zum Zeitpunkt des Rezidivs einen sogenannten NS5A-A30K-Polymorphismus auf. Polymorphismen dieses und weiterer Typen sind in vitro mit einer verringerten oder mangelnden Empfindlichkeit gegenüber einer Hemmung durch Daclatasvir assoziiert und bergen daher starkes Resistenzpotenzial. Allerdings waren von NS5A-Polymorphismen zu Studienbeginn insgesamt 16% der Teilnehmer betroffen, kein weiterer zeigte jedoch einen Rückfall. In einer anderen Studie wurde Daclatasvir mit Peginterferon und Ribavirin kombiniert, hier zeigten einige Patienten mit vor der Behandlung bestehenden NS5A-Polymorphismen ein Therapieversagen. Es konnte jedoch die Mehrzahl der Patienten mit Polymorphismen eine SVR erreichen (5 von 9 [56%] Genotyp-1a-Patienten, 6 von 8 [75%] Genotyp-1b-Patienten und 52 von 57 [91%] Genotyp-4-Patienten). Die Kombination aus Daclatasvir und Sofosbuvir scheint aufgrund dieser (begrenzten) Studienlage das Risiko für Resistenzen eher zu minimieren als die Dreifach-Kombination aus Daclatasvir, Peginterferon alfa und Ribavirin. Es wird bereits diskutiert, ob ein Screening auf Polymorphismen vor Behandlungsbeginn sinnvoll ist, um die am besten geeignete Therapie zu initiieren [4].
Nebenwirkungen
Bisher wurden insgesamt 5500 Patienten in bereits abgeschlossenen oder derzeit laufenden Studien mit Daclatasvir behandelt. Verglichen mit der bekannten UAW-Inzidenz und -Schwere der bisherigen Standardtherapien [(Peg-)Interferon, Ribavirin] scheint die Verträglichkeit von Daclatasvir gut zu sein. Nebenwirkungsbedingte Therapieabbrüche traten in der Studie von Sulkowski et al. nur bei zwei Patienten auf (< 1%). In beiden Fällen wurde das Ereignis (Fibromyalgie und Schlaganfall) aber als nicht mit der Studienmedikation in Zusammenhang stehend eingestuft. Der Anteil schwerwiegender unerwünschter Arzneimittelwirkungen war mit 4,7% niedrig, jedoch entwickelte fast jeder dritte Patient eine Fatigue. Kopfschmerzen und Übelkeit zählten zu den weiteren häufigsten Nebenwirkungen. Die Teilnehmer, die zusätzlich mit Ribavirin behandelt wurden, zeigten erwartungsgemäß höhere Raten der bereits unter Ribavirin bekannten Nebenwirkungen. Da es sich jedoch um eine Studie begrenzter Größe handelt, können seltene Ereignisse nicht detektiert werden, weshalb die Sicherheit der Therapie in der Nachzulassungsphase und in weiteren Studien besonders kritisch beobachtet werden sollte. Einen ernstzunehmenden Hinweis liefert ein Fallbericht einer japanischen Studie, der in der Fachzeitschrift Hepatology veröffentlicht wurde. Ein Teilnehmer, der Daclatasvir mit dem in der Entwicklung befindlichen NS3/4A-Protease-Inhibitor Asunaprevir erhielt, entwickelte eine schwerwiegende Überempfindlichkeitsreaktion [5]. Der Patient zeigte am 15. bzw. 29. Therapietag Fieber, Eosinophilie und Leberschädigungen, eine Vergrößerung der Milz sowie erhöhte IgA- und IgE-Spiegel, die eine immunoallergene Hepatitis vermuten lassen. Nach Absetzen von Daclatasvir und Asunaprevir und dem Einleiten einer Prednisolon-Therapie besserte sich der Zustand. Es konnte nicht festgestellt werden, welcher der beiden Wirkstoffe für die Überempfindlichkeitsreaktion verantwortlich ist, man vermutet, dass eine genetische Disposition japanischer Patienten einen Risikofaktor darstellt.
Die Kasse klingelt zweimal
Nachdem die vom Hersteller Gilead Sciences geforderten Behandlungskosten für Sovaldi® weltweit für Aufsehen gesorgt haben, lohnt ein Blick auf die Preisvorstellungen von Bristol-Myers Squibb für Daklinza®. Eine Packung Daklinza® mit 28 Tabletten kostet 13.325,25 Euro (Apothekenverkaufspreis), dies entspricht „nur“ zwei Dritteln der Kosten von Sovaldi®, dessen Apothekenverkaufspreis derzeit bei 19.999,46 Euro liegt. Allerdings wird Daklinza® nicht als Monotherapie angewendet, sondern meist mit Sovaldi® kombiniert oder gar mit Ribavirin als Dreifachkombination. Für die Zweifachkombination kommen dann schnell Tagestherapiekosten von fast 1200 Euro und je nach Behandlungsdauer Gesamtkosten von 100.000 Euro (für zwölf Wochen) und 200.000 Euro (für 24 Wochen) zustande.
Wechselwirkungen
Daclatasvir ist ein Substrat des Cytochroms P450 3A4 und des P-Glycoproteins (P-gp). Eine gleichzeitige Anwendung mit starken Induktoren beider Systeme, wie Phenytoin, Carbamazepin, Oxcarbazepin, Phenobarbital, Rifampicin, Rifabutin, Rifapentin, systemisch angewendetes Dexamethason und Johanniskraut, ist kontraindiziert. Aufgrund der Interaktionen kann der Plasmaspiegel von Daclatasvir sinken, sodass keine ausreichende therapeutische Wirkung erreicht wird. Da Daclatasvir selbst ein Inhibitor von P-gp, dem Organo-Anion-Transporter-Polypeptid (OATP) 1B1, dem Organo-Kation-Transporter (OCT) 1 und dem Brustkrebs-Resistenz-Protein (BCRP) ist, kann es die systemische Exposition von Arzneimitteln, die Substrate dieser Systeme sind, erhöhen. Vorsicht ist besonders geboten bei Arzneimitteln mit enger therapeutischer Breite wie Digoxin und Dabigatranetexilat.
Empfängnisverhütung
In Tierversuchen zeigte sich ein embryotoxisches und teratogenes Potenzial. Daher darf Daklinza® nicht von Schwangeren oder von Frauen im gebärfähigen Alter eingenommen werden, die keine Empfängnisverhütung anwenden. Eine hochwirksame Empfängnisverhütung sollte auch noch fünf Wochen nach Ende der Therapie fortgeführt werden. Wird Daclatasvir zusammen mit Ribavirin angewendet, gelten die noch strengeren Kontraindikationen und Warnhinweise für Ribavirin. Dieses zeigte in allen untersuchten Tierarten signifikante teratogene und/oder embryotoxische Wirkungen. Deshalb muss mit äußerster Sorgfalt darauf geachtet werden, eine Schwangerschaft bei Ribavirin-Patientinnen und sogar bei Partnerinnen von Ribavirin-Patienten zu verhüten.
Fazit
Die Behandlungsmöglichkeiten der Hepatitis C werden derzeit mit Hochdruck erweitert. Nach der Zulassung von Sofosbuvir folgt nun nach nur wenigen Monaten Daclatasvir, das mit ähnlich hohen Heilungsraten überzeugen konnte. Mitte Oktober erteilte die FDA sogar dem ersten Kombinationspräparat zur Behandlung von Patienten mit dem HCV-Genotyp 1 die Zulassung: Die erste Interferon-freie Therapieoption in einer Tablette, bestehend aus Sofosbuvir und dem NS5A-Inhibitor Ledipasvir wird unter dem bedeutungsvoll „harmonischen“ Namen Harvoni® vermarktet. Die neue und sich vermutlich noch erweiternde Wirkstoffvielfalt bietet den Hepatologen wertvolle Möglichkeiten des kombinierten Angriffs, und es besteht die historische Chance, Hepatitis C bei einem Großteil der betroffenen Patienten zu heilen.
Quelle
[1] Virushepatitis C im Jahr 2012. Epidemiologisches Bulletin des Robert Koch-Instituts 2013, Nr. 30
[2] Fachinformation Daklinza®, Stand August 2014
[3] Sulkowski MS et al. Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection. N Engl J Med 2014;370:211-221
[4] Schneider MD, Sarazzin C. Antiviral therapy of hepatitis C in 2014: do we need resistance testing? Antiviral Res 2014;105:64-71
[5] Fujii Y et al. Drug-Induced Immunoallergic Hepatitis during Combination Therapy with Daclatasvir and Asunaprevir. Hepatology. 2014 Oct 12. doi: 10.1002/hep.27559. [Epub ahead of print]
Apothekerin Dr. Verena Stahl





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.