
- DAZ.online
- DAZ / AZ
- DAZ 34/2014
- Therapie der chronischen ...
Hepatitis C
Therapie der chronischen Hepatitis C
Neue direkt antivirale Medikamente versprechen Viruselimination
Aktuell zugelassen zur Therapie der chronischen Hepatitis C sind folgende Medikamente: PEG-Interferon α zur Erst- und Re-Therapie für alle HCV- Genotypen, Ribavirin als Kombinationstherapie, Simeprevir als Kombinationstherapie zur Erst- und Re-Therapie für die HCV-Genotypen 1 und 4 und Sofosbuvir als Kombinationstherapie zur Erst- und Re-Therapie für alle HCV-Genotypen.
Der Einsatz der Proteaseinhibitoren Telaprevir und Boceprevir wird nicht mehr empfohlen.
Im laufenden Jahr ist mit der Zulassung weiterer direkt antiviral wirkender Medikamente zu rechnen (s. Tab).
Drei Angriffspunkte
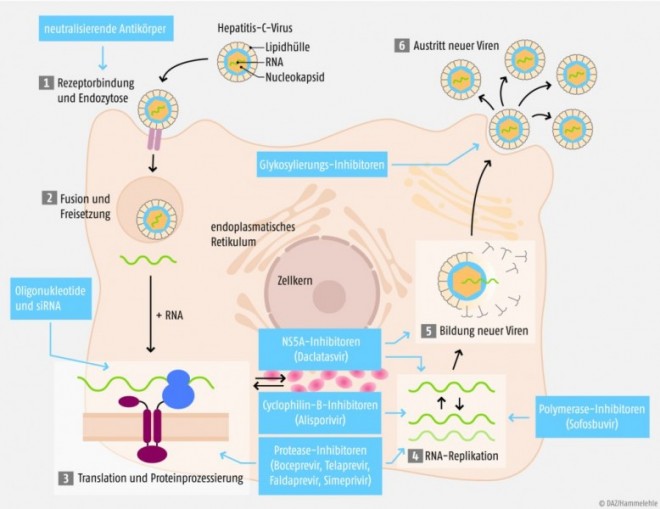
Es gibt drei unterschiedliche Klassen von direkt antiviral wirkenden Medikamenten, die sich in ihrem Hauptangriffspunkt im Replikationszyklus des Hepatitis-C-Virus unterscheiden (siehe Abb.):
- die NS3/4A-Protease-Inhibitoren Boceprevir, Telaprevir, Simeprevir und Faldaprevir,
- der NS5A-Inhibitor Daclatasvir und
- der NS5B-Polymerase-Inhibitor Sofosbuvir. Sofosbuvir (Sovaldi®, Gilead) ist ein pangenotypischer Polymerasehemmer der seit Anfang des Jahres zugelassen ist. Sofosbuvir wird in einer Dosis von 400 mg einmal täglich eingenommen.
Die Dringlichkeit einer antiviralen Therapie sollte basierend auf dem Stadium der Lebererkrankung eingeschätzt werden. Die Entscheidung, welches Medikament für welchen Patienten das geeignetste Medikament ist, hängt ab vom HCV-Geno-/Subtyp, dem Vorliegen von Resistenzmutationen und der eventuellen antiviralen Vortherapie.
In der Zeitschrift für Gastroenterologie wurden im Juli diesen Jahres die aktuellen Empfehlungen der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und des Berufsverbandes niedergelassener Gastroenterologen Deutschlands (bng) zur Therapie der chronischen Hepatitis C veröffentlicht [1]. Diese bilden die Grundlage für die im Folgenden aufgeführten Empfehlungen.
Therapieempfehlungen für HCV-Genotyp 1
Für die Ersttherapie von Patienten mit einer HCV-Genotyp-1-Infektion wird die antivirale Therapie mit Sofosbuvir, PEG-Interferon und Ribavirin für 12 Wochen empfohlen. In den Zulassungsstudien konnten mit dieser Kombinationstherapie Ausheilungsraten von 89% bei Patienten ohne fortgeschrittenen fibrotischen Umbau der Leber erreicht werden [2, 3]. Die Ausheilungsraten lagen mit ca. 80% bei Patienten mit kompensierter Leberzirrhose etwas niedriger.
Die Sofosbuvir-Triple-Therapie ist ebenfalls für die Re-Therapie von Patienten, die bereits erfolglose Interferon-basierte antivirale Therapien hinter sich haben, zugelassen, die zu erwartenden Ausheilungsraten liegen jedoch in diesem Patientenkollektiv mit ca. 50 bis 70% niedriger als bei einer Ersttherapie. Für die Patienten mit Interferon-Kontraindikationen ist auch die Interferon-freie antivirale Therapie mit Sofosbuvir und Ribavirin für eine Therapiedauer von 24 Wochen zugelassen. Die Daten beruhen jedoch auf sehr kleinen Patientenkollektiven, die im Rahmen von Studien behandelt worden sind. Insgesamt zeigten sich hier nur sehr ungenügende Ausheilungsraten.
Kontrollierte Studien zur Effektivität der Triple-Therapie mit Sofosbuvir bei Patienten mit Therapieversagen auf eine Proteaseinhibitor-basierte Therapie (Boceprevir oder Telaprevir) fehlen aktuell noch.
Im August bzw. im Dezember 2014 ist mit der Zulassung der NS5A-Inhibitoren Daclatasvir und Ledipasvir zu rechnen (s. Tab.), für die es Studiendaten von Patienten, die auf die Triple-Therapie mit Boceprevir und Telaprevir nicht angesprochen haben, gibt. Die Daten zeigen, dass über 90% dieser Patienten es schaffen, das Hepatitis-C-Virus dauerhaft zu eliminieren [4, 5]. Das Interaktionspotenzial von Sofosbuvir ist im Vergleich zu anderen antiviralen Medikamenten sehr gering, Interaktionen können jedoch bei Medikamenten auftreten, die ebenfalls über den Transporter P-Glykoprotein (PGP) abgebaut werden.
Das Nebenwirkungsprofil war in den Sofosbuvir-Zulassungsstudien im Wesentlichen geprägt durch die Nebenwirkungen, die durch PEG-IFN α und Ribavirin hervorgerufen werden. Häufige Nebenwirkungen, die berichtet wurden, waren Kopfschmerzen, Übelkeit, Müdigkeit und eine Ribavirin-induzierte Anämie.
Simeprevir (Olysio®, Janssen-Cilag) ist ein Inhibitor der Protease NS3/4A, der in einer Tagesdosis von 150 mg 1-mal täglich eingenommen wird. Simeprevir ist als Kombinationstherapie im Rahmen der Ersttherapie und bei Patienten mit Relapse oder Non-Response auf eine vorherige Interferon-basierte antivirale Therapie zugelassen. Bei therapienaiven Patienten und Patienten mit Relapse auf eine Vortherapie mit HCV-Genotyp 1 und 4 erfolgt die Therapie mit Simeprevir, PEG-IFN α und Ribavirin insgesamt über 24 Wochen. Die Behandlung mit Simeprevir muss in Kombination mit PEG-IFN α und Ribavirin begonnen und über einen Zeitraum von 12 Wochen fortgeführt werden, gefolgt von einer weiteren 12-wöchigen Behandlung mit PEG-IFN α und Ribavirin. Bei vorherigen Non-respondern mit HCV-Genotyp 1 und 4 muss die Behandlung mit Simeprevir in Kombination mit PEG-IFN α und Ribavirin begonnen und über einen Zeitraum von 12 Wochen fortgeführt werden, gefolgt von einer weiteren 36-wöchigen Behandlung mit PEG-IFN α und Ribavirin.
Therapieempfehlungen im Überblick
unter Berücksichtigung der Dringlichkeit der Behandlung, des Vortherapiestatus, der individuellen Interferonverträglichkeit und viraler Resistenzen [aus 1].
HCV-Genotyp 1
- Sofosbuvir, PEG-Interferon und Ribavirin für 12 Wochen (Evidenzgrad Ib bzw. IIb)
- Simeprevir plus Sofosbuvir +/- Ribavirin für 12 Wochen bei Interferon-Unverträglichkeit bzw. -Kontraindikationen (Evidenzgrad IIb)
HCV-Genotyp 2
- Sofosbuvir und Ribavirin für 12 Wochen (Evidenzgrad Ib)
HCV-Genotyp 3
- Sofosbuvir, PEG-Interferon und Ribavirin für 12 Wochen (Evidenzgrad IIb)
- Sofosbuvir plus Ribavirin für 24 Wochen (Evidenzgrad Ib)
HCV-Genotyp 4
- Sofosbuvir, PEG-Interferon und Ribavirin für 12 Wochen (Evidenzgrad Ib-V)
- Simeprevir, PEG-Interferon und Ribavirin für 24 Wochen (Evidenzgrad Ib)
- Simeprevir plus Sofosbuvir +/- Ribavirin für 12 Wochen bei Interferon-Unverträglichkeit bzw. -Kontraindikationen (Evidenzgrad V)
HCV-Genotyp 5 und 6
- Sofosbuvir, PEG-Interferon und Ribavirin für 12 Wochen (Evidenzgrad Ib)
- Sofosbuvir plus Ribavirin für 12 bis 24 Wochen (Evidenzgrad V)
Ebenfalls zugelassen ist bei Patienten mit dem Genotyp 1 und 4 unabhängig von vorherigen Behandlungen eine Interferon-freie Kombinationstherapie mit Simeprevir und Sofosbuvir (+/- Ribavirin) über 12 Wochen. Die Studien konnten zeigen, dass es einen Unterschied gibt bei Patienten mit Ersttherapie oder Relapse zwischen den Patienten mit vollständig nicht nachweisbarer HCV-RNA zu Woche 4 und solchen mit residualer Virämie <25 IU/ml mit SVR Raten von 93% bzw. 69%, so dass nur bei einer vollständig nicht nachweisbaren HCV-RNA Ausheilungsraten von >90% erreicht werden. Gemäß den aktuellen Empfehlungen der DGVS und des bng kann aufgrund der Studiendaten sowie fehlender relevanter Kostenersparnis die konventionelle Triple-Therapie mit Simeprevir, PEG-IFN α und Ribavirin nicht als Standardtherapie empfohlen werden [6–8]. Auch bei Patienten mit Non-Response kann die Simeprevir-basierte Triple-Therapie über 48 Wochen aufgrund der geringen Effektivität nicht empfohlen werden. Studiendaten zur Re-Therapie nach Boceprevir-/Telaprevir-Triple-Therapie existieren für Simeprevir nicht. Die Kombinationstherapie aus Sofosbuvir und Simeprevir wurde mit und ohne die zusätzliche Gabe von Ribavirin für 12 oder 24 Wochen bei HCV-Genotyp-1-Patienten mit und ohne Leberzirrhose als Erst- und Re-Therapie untersucht. Zusammenfassend wurden Ausheilungsraten von über 90% unabhängig von der Therapiedauer bzw. der Gabe von Ribavirin erreicht [9].
Therapieempfehlungen für HCV-Genotyp 2
Bei der Nutzenbewertung von Sofosbuvir hat der Gemeinsame Bundesausschuss (G-BA) für Patienten mit HCV-Genotyp 2 einen hohen Zusatznutzen bescheinigt, unabhängig vom Stadium der Lebererkrankung und bereits vorher stattgefundenen Vortherapien. Für dieses Patientenkollektiv ist die duale Therapie mit Sofosbuvir und Ribavirin für 12 Wochen zugelassen. Phase-3-Studien haben hohe Ausheilungsraten sowohl bei Erst- als auch bei Re-Therapie von 86 bis 97% gezeigt [2, 10].
Therapieempfehlungen für HCV-Genotyp 3
Für Patienten mit dem HCV-Genotyp 3 liegt eine Zulassung vor sowohl für die Triple-Therapie mit Sofosbuvir, PEG-IFN α und Ribavirin über 12 Wochen als auch für eine duale Interferon-freie Therapie mit Sofosbuvir und Ribavirin über 24 Wochen. Einen direkten Vergleich im Rahmen einer prospektiv randomisierten Studie gibt es nicht. Der G-BA hat in seiner Nutzenbewertung lediglich der dualen Therapie mit Sofosbuvir und Ribavirin im Vergleich zur Therapie mit PEG-Interferon und Ribavirin einen Zusatznutzen bescheinigt. Ein Zusatznutzen der Triple-Therapie mit Sofosbuvir, PEG-IFN α und Ribavirin wurde nicht belegt. Die Studiendaten zur Erst- und Re-Therapie mit Sofosbuvir und Ribavirin zeigen bei Patienten mit fehlender Leberzirrhose Ausheilungsraten von 85 bis 94% [11]. Bei Patienten mit Leberzirrhose lag die Heilungsrate bei Therapie-naiven Patienten bei 92%, bei Re-Therapie lag sie mit 60% deutlich niedriger.
Weitere Genotypen
Patienten mit dem HCV-Genotyp 4, 5 oder 6 kommen in Deutschland deutlich seltener vor, deshalb werden an dieser Stelle die aktuellen Empfehlungen der DGVS und des bng zur Behandlung dieses Patientenkollektivs nur kurz zusammengefasst [1]: Für Patienten mit dem HCV-Genotyp 4 stehen unter Berücksichtigung der Interferon-Unverträglichkeit, der Vortherapie und der Dringlichkeit folgende Therapieoptionen zur Verfügung: Sofosbuvir, PEG-IFN α und Ribavirin für 12 Wochen, Simeprevir, PEG-IFN α und Ribavirin für 24 Wochen und Simeprevir plus Sofosbuvir (+/- Ribavirin) für 12 Wochen bei Interferon-Unverträglichkeit oder Kontraindikationen.
Für Patienten mit dem Genotyp 5 oder 6 werden unter Berücksichtigung der Interferon-Unverträglichkeit entweder die Triple-Therapie mit Sofosbuvir, PEG-IFN α und Ribavirin für 12 Wochen oder die duale Therapie mit Sofosbuvir und Ribavirin für 12 bis 24 Wochen empfohlen.
Ausreichende Daten zur Behandlung von Patienten mit eingeschränkter Nierenfunktion liegen bislang noch nicht vor.
Für weitere, direkt antivirale Medikamente wird die Zulassung bis Ende des Jahres bzw. Anfang 2015 erwartet. Vorteile der neu zugelassenen, direkt antiviral wirksamen Medikamente sind eine deutlich verkürzte Therapiedauer, eine einmal tägliche Dosierung und das deutlich verbesserte Nebenwirkungsprofil.
Literatur
[1] Sarrazin C, Berg T, Buggisch P, Dollinger M, Hinrichsen H, Hüppe D, et al. Aktuelle Empfehlungen der DGVS und des bng zur Therapie der chronischen Hepatitis C. Zeitschrift fur Gastroenterologie. 2014;52(7):749-56.
[2] Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. The New England journal of medicine. 2013;368(20):1878-87.
[3] Kowdley KV, Lawitz E, Crespo I, Hassanein T, Davis MN, DeMicco M, et al. Sofosbuvir with pegylated interferon alfa-2a and ribavirin for treatment-naive patients with hepatitis C genotype-1 infection (ATOMIC): an open-label, randomised, multicentre phase 2 trial. Lancet. 2013;381(9883):2100-7.
[4] Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, Jacobson I, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. The New England journal of medicine. 2014;370(3):211-21.
[5] Afdhal N, Reddy KR, Nelson DR, Lawitz E, Gordon SC, Schiff E, et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. The New England journal of medicine. 2014;370(16):1483-93.
[6] Forns X, Lawitz E, Zeuzem S, Gane E, Bronowicki JP, Andreone P, et al. Simeprevir with peginterferon and ribavirin leads to high rates of SVR in patients with HCV genotype 1 who relapsed after previous therapy: a phase 3 trial. Gastroenterology. 2014;146(7):1669-79e3.
[7] Manns M, Marcellin P, Poordad F, de Araujo ES, Buti M, Horsmans Y, et al. Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection (QUEST-2): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2014.
[8] Jacobson IM, Dore GJ, Foster GR, Fried MW, Radu M, Rafalsky VV, et al. Simeprevir with pegylated interferon alfa 2a plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection (QUEST-1): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet. 2014.
[9] Lawitz E, Sulkowski MS, Ghalib R, Rodriguez-Torres M, Younossi ZM, Corregidor A, et al. Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet. 2014.
[10] Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. The New England journal of medicine. 2013;368(20):1867-77.
[11] Zeuzem S, Dusheiko GM, Salupere R, Mangia A, Flisiak R, Hyland RH, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3. The New England journal of medicine. 2014;370(21):1993-2001.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.