
- DAZ.online
- DAZ / AZ
- DAZ 33/2014
- Und noch ein Virus: ...
Infektiologie
Und noch ein Virus: Chikungunya
Unaussprechlich und nicht ungefährlich
Der Name
Der Name der Erkrankung geht nicht gerade flüssig über die Lippen: Der Begriff „Chikungunya“ stammt von den Makonde, einem Bantuvolk im Südosten Tansanias und bedeutet „der gekrümmt Gehende“. Mit diesem Namen wird auf die Hauptsymptome der Erkrankung, starken Gelenkschmerzen, Bezug genommen, die die Betroffenen in eine gekrümmte Körperhaltung zwingen. Dass es nach wie vor nur einen Makonde-Namen für das Virus gibt zeigt, dass die Erkrankung in tropischen und subtropischen Gegenden Afrikas und Südostasiens endemisch ist und dort auch für wiederkehrende Epidemien sorgt. 1953 wurde das Virus in Tansania erstmals isoliert. Retrospektive Untersuchungen einer „Dengue-Epidemie“ in Batavia-Jakarta im Jahr 1779 deuten darauf hin, dass es sich damals tatsächlich um das Chikungunya-Fieber gehandelt hat [2].
Das Virus
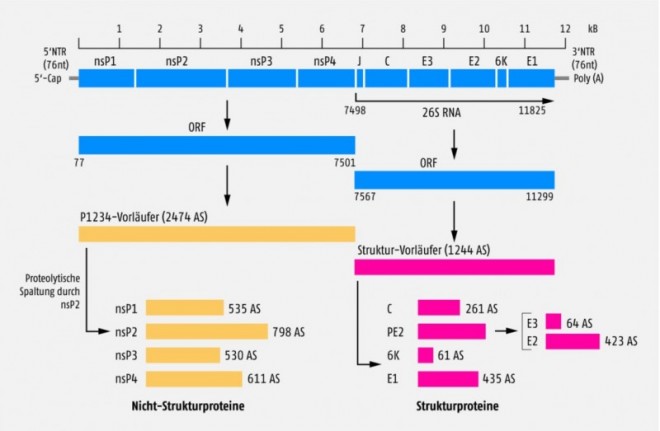
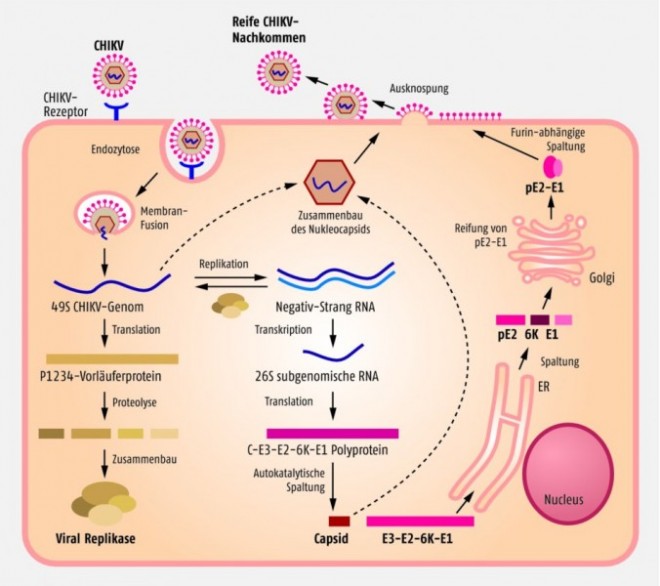
Das Chikungunya-Virus (CHIKV) gehört zu den Alphaviren in der Familie der Togaviridae und ist ein kugeliges, ca. 70 nm großes Partikel mit Membranhülle und einzelsträngigem RNA-Genom in Plusstrang-Orientierung, das heißt die RNA kann in der befallenen Wirtszelle direkt als mRNA für die Translation verwendet werden. Von der 11,7 kB großen RNA werden zwei Polyproteine gebildet, wobei das eine in vier Nicht-Strukturproteine (nsP1-4) zerschnitten wird und das andere die drei Haupt-Strukturproteine Capsid sowie die E1- und E2-Hüllglykoproteine bildet (Abb. 1). Die Proteine nsP1-4 sind für die Replikation der viralen RNA und für die Modulierung der antiviralen Reaktion der Wirtszelle verantwortlich und werden direkt nach der Infektion der Zelle gebildet. Anschließend kann das Virus-Genom repliziert werden und steht als doppelsträngige RNA sowohl für neue Einzelstrang-Genome als auch für die kleinere mRNA mit der Information für das Struktur-Polyprotein als Matrize zur Verfügung. E1 und E2 bilden nach der Translation ein Heterodimer in der Membran des Endoplasmatischen Reticulums und wandern über den sekretorischen Weg zur Plasmamembran. Nach Interaktion der E1/E2-Proteine mit dem Nukleocapsid kann das komplette Virion abgeschnürt werden (Abb. 2). Im fertigen Viruspartikel befinden sich auf der Oberfläche 80 Spikes, die jeweils aus drei E1/E2-Dimeren bestehen. E2 ist für die Interaktion mit zellulären Rezeptoren verantwortlich, während E1 für die Fusion der Virushülle mit der Endosomen-Membran sorgt [2].
In Zellkultursystemen kann das Chikungunya-Virus humane Epithel- und Endothelzellen, primäre Fibroblasten sowie – etwas ineffizienter – Makrophagen infizieren [3], während in primären Lymphozyten und Monozyten sowie dendritischen Zellen keine Virus-Vermehrung beobachtet wurde. Bisher ist allerdings noch nicht gesichert, welches Oberflächenmolekül vom viralen E2-Protein angesteuert wird.
Die Übertragung
CHIKV wird über weibliche Stechmücken der Gattung Aedes übertragen. Dabei werden grob zwei Kreisläufe unterschieden, die entweder im Regenwald zwischen Stechmücken und infizierten Affen sowie Menschen vor allem in dünner besiedelten afrikanischen Gegenden ablaufen oder aber in urbanen Regionen nur noch Stechmücken und Menschen betreffen. Gerade der zweite Infektionsweg birgt die Gefahr der Ausbreitung aus den bisherigen Endemiegebieten nach Amerika und Europa.
Mittlerweile kennt man drei Virus-Hauptstämme: die Westafrika-Linie, die Ost-/Zentral-/Südafrika-Linie (ECSA) und die asiatische Linie, die sich von Ostafrika ausgebreitet hatte. Als Haupt-Überträger fungieren die Stechmücken Aedes aegypti, die Ägyptische Tigermücke, die auch die Erreger des Dengue-Fiebers und des Gelbfiebers übertragen kann, sowie ihr asiatisches Pendant A. albopticus. Nach einer recht kurzen Inkubationszeit von zwei bis zehn Tagen entwickeln 80 bis 90% der Infizierten die typischen Symptome. Eine direkte Übertragung von Mensch zu Mensch ist nur über Transfusion Virus-haltigen Blutes oder durch Verletzungen mit einer kontaminierten Nadel denkbar. Beschrieben wurden Infektionsfälle nach einer Cornea-Transplantation [3].
Die Krankheit
Die Betroffenen leiden meist unter dem plötzlichen Auftreten von hohem Fieber, Gelenkschmerzen, Rücken- und Kopfschmerzen sowie Erschöpfung. Außerdem treten in bis zu 50% der Fälle Magen-Darm-Beschwerden mit Diarrhö, Übelkeit, Erbrechen und Bauchschmerzen auf. Insgesamt führen die Symptome im akuten Krankheitsstadium dazu, dass die Lebensqualität der Patienten stark beeinträchtigt ist. Dieses Stadium ist zudem gekennzeichnet durch eine hohe Viruslast im Blut, die dann auch einhergeht mit einer schweren Lymphopenie und einer mäßigen Thrombopenie. Normalerweise heilt die Erkrankung innerhalb eines Monats wieder komplett aus, allerdings können auch länger (ein bis zwei Jahre) anhaltend rheumatische Beschwerden auftreten. Der Anteil an schnell geheilten Patienten variiert zwischen den verschiedenen Epidemien zwischen 20 und über 80% [3]. Eine arthritische Vorerkrankung und weibliches Geschlecht scheinen einen längeren Krankheitsverlauf zu unterstützen. Risikofaktoren für einen schweren Verlauf der akuten Phase bei Erwachsenen sind fortgeschrittenes Alter, Alkoholmissbrauch, Bluthochdruck, Herzbeschwerden, Atembeschwerden und Verwendung von NSAIDs. Kinder sind seltener von Gelenkschmerzen als vielmehr von Hautveränderungen und neurologischen Komplikationen betroffen. Vor allem Neugeborene, die die Viren von ihrer infizierten Mutter erhalten haben, leiden unter schweren Verlaufsformen, zum Teil mit anhaltenden Behinderungen.
Die Therapie
Das Virus ist empfindlich gegenüber Austrocknung und Temperaturen über 58°C. Außerdem greifen die üblichen Desinfektionsmittel die virale Hülle an.
Für das Chikungunya-Fieber existiert bisher keine antivirale Therapie. Stattdessen werden zur symptomatischen Therapie während der akuten und länger persistierenden Phase Paracetamol und NSAIDs empfohlen. Aspirin sollte wegen der Blutungsgefahr jedoch vermieden werden ebenso wie systemisch wirkende Corticosteroide wegen eines möglicherweise starken Rebound-Effekts bei Therapieende. Während der persistierenden Phase der Erkrankung können DMARDs und auch Anti-TNF-α-Wirkstoffe eventuell erfolgreich eingesetzt werden [3].
Mögliche antivirale Wirkstoffe
Etliche, bekanntermaßen gegen Viren einsetzbare Wirkstoffe wie die Interferone α und β , aber auch Ribavirin oder Chloroquin zeigten in In-vivo-Untersuchungen kaum inhibitorische Effekte gegenüber CHIKV. Ein recht vielversprechender Kandidat, Arbidol, wurde vor einigen Jahren in Russland als Mittel gegen Atemwegsinfektionen entwickelt und scheint sich in Zellmembranen einzulagern und dabei die Fusion aus Virus- und Endosomen-Membran zu verhindern. Über diesen Mechanismus kann der Wirkstoff in den frühen Phasen einer Infektion mit Chikungunya-Viren aber auch mit Influenza-Viren, respiratorischem Syncytial-Virus und eventuell sogar Hepatitis-C-Virus eingreifen. Zudem wird der Substanz eine stimulierende Wirkung auf das Immunsystem zugeschrieben. Arbidol ist in Russland und China für die Prophylaxe und Behandlung von Influenza-A- und –B-Infektionen zugelassen [3, 4].
Allerdings werden auch noch etliche andere Wirkstoffe gegen das Chikungunya-Virus getestet, wie z.B. die Phenothiazine Chlorpromazin, Perphenazin, Ethopropazin, Thiethylperazin, Thioridazin und Methdilazin, die wegen ihrer Hirngängigkeit vor allem bei den neuronalen Symptomen eingesetzt werden könnten. Als Inhibitoren der viralen Replikase wirken in vitro 5,7-Dihydroxyflavone wie Apigenin, Chrysin, Naringenin und Silybin, aber auch Prothipendyl und die Daphnan-Diterpenoide Trigocherrin A, B und F. Und auch eine virale Protease, nsP2, ist Zielstruktur möglicher Inhibitoren, wie z.B. ID1452-2. Es sind noch einige weitere Substanzen in der Testung, allerdings liegen bisher keine In-vivo-Ergebnisse an Patienten vor, so dass sich diese Wirkstoffe erst noch bewähren müssen [5].
Mögliche Impfstoffe
Bisher ist kein Impfstoff gegen das Chikungunya-Virus verfügbar, obwohl bereits in den 1960er Jahren eine erste inaktivierte Vakzine entwickelt wurde, die jedoch in Abhängigkeit von der zur Herstellung verwendeten Ausgangszellkultur nur bedingt wirksam war [3, 5]. Einen wirksameren Impfstoff erhoffte sich die US-Army mit lebend-attenuierten Viren des Typs 181/25. Allerdings traten bei der klinischen Testung der Vakzine TSI-GSD-218 einige schwerwiegende unerwünschte Nebenwirkungen auf, und es zeigte sich, dass die attenuierten Viren nur einzelne Punktmutationen enthielten, die leicht revertieren könnten, so dass die weitere Entwicklung gestoppt wurde.
Wesentlich sicherer sind demgegenüber beispielsweise DNA-basierte Vakzine, die den Impfling veranlassen, das antigene Hüllprotein selbst zu produzieren. Auch rekombinant hergestellte E1/E2-Proteine oder Virus-ähnliche Partikel (VLP), die die CHIKV-Oberflächenproteine präsentieren wurden bereits entwickelt und im Mausmodell getestet. Der Nachteil dieser Impfstoffe ist die zum Teil komplizierte Herstellung oder Applikation sowie die nötige Boosterung, was gerade in den betroffenen Entwicklungsländern Probleme bereitet.
Nach wie vor werden daher effizientere, lebend-attenuierte Impfstoffe beforscht, und mittlerweile werden verschiedene Systeme zur Abschwächung getestet: Bringt man in das CHIKV-Genom eine interne Ribosomen-Eintrittsstelle (IRES) ein, können sich die Viren, selbst wenn sie durch Mutation wieder voll infektiös werden würden, nicht mehr in Moskitos vermehren. Stechmücken erkennen keine IRES und können daher das Virus-Genom nicht translatieren. Alternativ können auch die Sequenzen der Gene derart mutiert werden, dass das Viruspartikel zwar noch korrekt zusammengesetzt wird, aber die Replikationsrate dramatisch reduziert ist. Bis zu 882 derartige Mutationen wurden bereits eingeführt. Klinische Studien mit den Lebend-Vakzinen stehen allerdings noch aus. In einem ähnlichen experimentellen Stadium befinden sich rekombinante Viren, die aus Adenovirus, Vesiculostomatitis-Virus oder anderen Alphaviren bestehen, die ihrerseits die Oberflächenproteine von CHIKV exprimieren [3, 6].
Chikungunya als Gefahrenpotenzial für Europa
Bisher gibt es also noch keinen wirklich spezifischen Wirkstoff gegen das Chikungunya-Virus. Immerhin sind aber einige Substanzen und Impfstoffkandidaten in der Pipeline. Das wissenschaftliche Interesse an dem Virus ist erst seit 2005 gestiegen, als eine Epidemie in der Region um den Indischen Ozean wütete und etliche Erkrankungsfälle nach Europa eingeschleppt wurden [3]. Seit Dezember 2013 ist die Karibik von einer Epidemie betroffen. Bis 15. Juli wurden aus dieser Region 232 Krankheitsfälle nach Kontinental-USA eingeschleppt. Dort ist die Gefahr einer persistierenden Weitergabe der Viren durchaus gegeben, da bereits in etlichen Staaten die Haupt-Überträger Aedes aegypti und A. albopticus heimisch geworden sind. Erste Untersuchungen der Viren in der Karibik deuten darauf hin, dass die Epidemie durch einen älteren asiatischen Virus-Stamm verursacht ist, der noch nicht an den Wirt A. albopticus angepasst ist, so dass die Ausbreitung etwas langsamer vonstatten geht [7].
Bereits 2011 haben die US-amerikanischen Centers for Disease Control and Prevention (CDC) zusammen mit der Pan American Health Organization den Leitfaden „Preparedness and Response for Chikungunya Virus Introduction in the Americas“ herausgegeben, um Richtlinien im Umgang mit Erkrankten und Überträgern bereitzuhalten. Sicherlich wird diese mittlerweile sehr konkrete Bedrohung auch die CHIKV-Forschung in den USA beflügeln.
In Europa sind erst wenige Fälle aus der Karibik importiert worden. Die entsprechenden Stechmücken sind noch nicht weit verbreitet: A. albopticus findet sich in einigen südlichen Regionen von Kontinental-Europa (Frankreich, Spanien und Italien), A. aegypti ist bisher nur auf Madeira anzutreffen. Das European Centre for Disease Prevention and Control (ecdc) rät bereits zu erhöhter Wachsamkeit gegenüber auftretenden Erkrankungsfällen. Vor allem Reiserückkehrer aus betroffenen Gebieten sollten bei Symptomen, die auf Chikungunya-Fieber hindeuten, einen Arzt aufsuchen und Mückenstiche mithilfe von Repellenzien möglichst vermeiden, um eine autochthone Ausbreitung der Viren zu verhindern.
Quelle
[1] Vermehrt Chikungunyafieber-Erkrankungen aus der Karibik bei deutschen Reisenden. Epidemiologisches Bulletin 22/2014, Robert Koch-Institut (RKI), www.rki.de
[2] Tsetsarkin KA, Chen R, Sherman MB, Weaver SC. Chikungunya virus: evolution and genetic determinants of emergence. Curr Opin Virol. (2011)4;310-317
[3] Thiberville SD, Moyen N, Dupuis-Maguiraga L et al. Chikungunya fever: epidemiology, clinical syndrome, pathogenesis and therapy. Antiviral Res. (2013)99;345-370
[4] Brooks MJ, Burtseva EI, Ellery PJ et al. Antiviral activity of arbidol, a broad-spectrum drug for use against respiratory viruses, varies according to test conditions. J Med Virol. (2012)84;170-181
[5] Kaur P, Chu JJ. Chikungunya virus: an update on antiviral development and challenges. Drug Discov Today. (2013)18;969-983
[6] Weaver SC, Osorio JE, Livengood JA et al. Chikungunya virus and prospects for a vaccine. Expert Rev Vaccines. (2012)11;1087-1101
[7] Morens DM, Fauci AS. Chikungunya at the Door – Déjà Vu All Over Again? N Engl J Med. 2014 Jul 16 [Epub ahead of print]
[8] Chikungunya outbreak in Caribbean region 25. Juni 2014, Rapid Risk Assessment. European Centre of Disease Prevention and Control (ECDC), www.ecdc.europa.eu























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.