
- DAZ.online
- DAZ / AZ
- DAZ 21/2014
- Ein altes Vitamin in ...
Vitamine
Ein altes Vitamin in neuem Licht
Vitamin K: wichtig für die Blutgerinnung und die Knochen
Die Entdeckung von Vitamin K geht auf die Forschungsarbeiten am biochemischen Institut der Universität Kopenhagen von Carl Peter Henrik Dam in den Jahren 1928 bis 1930 zurück. Bei seinen Arbeiten über den Cholesterin-Stoffwechsel stellte der dänische Biochemiker bei Küken, die länger als zwei bis drei Wochen mit einem cholesterin- und fettfreien Hühnerfutter gefüttert wurden, eine spontane Blutungsneigung fest. Diese Gerinnungsstörung war mit einem erniedrigten Prothrombingehalt (Prothrombin = Faktor II) des Blutes verbunden [1-3]. Da zu diesem Zeitpunkt keines der bisher bekannten Vitamine (z.B. Vitamin A, C, D) in der Lage war, die Störung der Blutgerinnung zu vermeiden, postulierte Dam ein neues fettlösliches Vitamin, welches die Koagulation reguliert. Letzteres musste im grünen Gemüse und in der Leber enthalten sein, da mit der ergänzenden Verfütterung dieser Nahrungsmittel eine normale Blutgerinnung bei den Tieren hergestellt werden konnte. Dam gelang es zudem mit einem Ether-Extrakt aus Luzernen (Alfalfa) die Hämorrhagien der Hühner erfolgreich zu behandeln. Das antihämorrhagische Vitamin nannte Dam Vitamin K (nach Koagulation: Blutgerinnung) [4].
In den 1930er Jahren arbeiteten mehrere Arbeitsgruppen an der Isolierung und Identifizierung von Vitamin K. Zu dieser Zeit gelang es einer US-amerikanischen Forschergruppe um den Biochemiker Edward Albert Doisy, das antihämorrhagische Vitamin K zu isolieren und die chemische Naphthoquinon-Ringstruktur aufzuklären. 1943 erhielten die beiden Forscher Dam und Doisy für die Entdeckung und die Aufklärung der chemischen Struktur von Vitamin K zusammen den Nobelpreis für Medizin [5, 6].
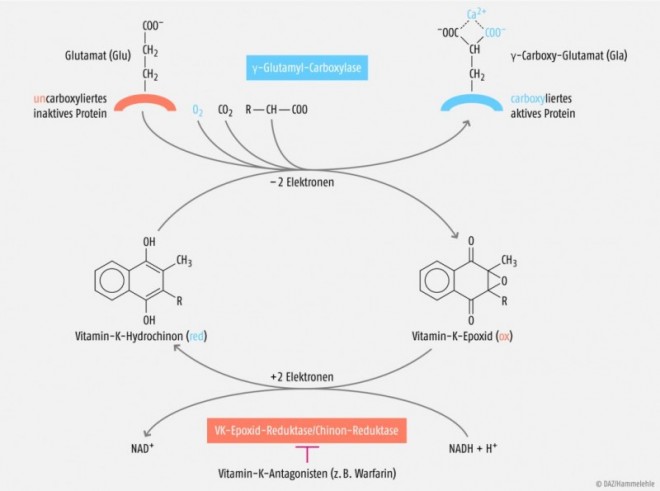
Erst Ende der 1970er Jahre wurde schließlich die genaue biochemische Funktion von Vitamin K aufgeklärt. Vitamin K ist als Coenzym essenziell für die γ-Carboxylierung spezifischer Glutaminsäure(Glu)-Reste in einer Reihe von Vitamin-K-abhängigen Proteinen. Die so gebildeten γ-Carboxyglutaminsäure(Gla)-Verbindungen sind in der Lage, Calcium-Ionen komplex zu binden, was seinerseits zu einer Konformationsänderung des Proteins führt und die Voraussetzung für seine physiologische Funktion ist. Auf diese Weise entstehen zum Beispiel durch posttranslationale Modifizierung aus Vorstufen die Gerinnungsfaktoren Faktor II (Prothrombin), Faktor VII, IX und X [7–9].
In diesem Zusammenhang erkannte man auch die Bedeutung des Vitamin-K-Zyklus: Die γ-Carboxylierung wird durch eine mikrosomale Carboxylase katalysiert und benötigt CO2 und molekularen Sauerstoff. Als Cofaktor wird Vitamin-K-Hydrochinon benötigt. Dabei liefert die Oxidation des Hydrochinons zum Vitamin-K-2,3-Epoxid die notwendige Energie für die Abstraktion eines Protons vom gamma-Kohlenstoff des Glutaminsäure-(Glu)-Restes, wodurch ein Carbanion entsteht, welches dann zu γ-Carboxyglutaminsäure (Gla) carboxyliert wird (Abb. 1). Vitamin-K-2,3-Epoxid wird anschließend wieder zu Vitamin-K-Hydrochinon durch die Enzyme Vitamin-K-Epoxid- und Chinon-Reduktase regeneriert [14, 15, 46]. Die γ-Carboxylierung wird somit von einer zyklischen Umwandlung geprägt, bei der oxidierte und reduzierte Formen des Vitamin K als treibende Faktoren beteiligt sind. Von großer medizinischer Bedeutung ist die Hemmung dieser beiden Enzyme durch Vitamin-K-Antagonisten wie Phenprocoumon und Warfarin, die im Rahmen einer Antikoagulationstherapie ausgenutzt wird [12]. Aktuell sind etwa 14 Vitamin-K-abhängige Proteine bekannt mit einem breiten Wirkspektrum auf die Hämostase, den Calcium-Stoffwechsel, die Kontrolle des Zellwachstums, die Apoptose und die Signaltransduktion (siehe Tabelle) [10, 11, 18, 41].
Nach Abklärung der hämostasiologischen Bedeutung und der Erforschung weiterer Vitamin-K-abhängiger Gla-Proteine wie Osteocalcin (BGP = bone-Gla-protein) und Matrix-Gla-Protein (MGP) steht derzeit der Einfluss des Vitamins auf die Knochen- und Gefäßgesundheit im Fokus der aktuellen Forschung [12, 14, 44].
Die K-Vitamere: Nomenklatur, Struktur und Vorkommen
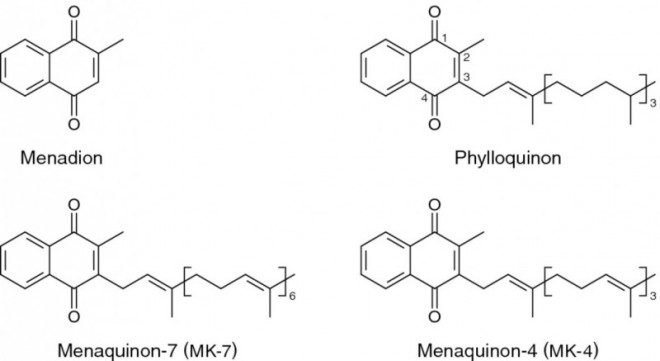
Vitamin K ist keine einheitliche Substanz, sondern eine Gruppe engverwandter Derivate mit einer 2-Methyl-1,4-Naphthoquinon-Struktur als gemeinsames Grundgerüst. Diesen Grundkörper, der auch als Menadion bezeichnet wird, enthalten alle Vitamin-K-Derivate. Menadion kommt in der Natur nicht vor, kann aber synthetisch hergestellt werden und ist auch bekannt unter der Bezeichnung Vitamin K3. Die einzelnen Substanzen aus der Gruppe der K-Vitamine werden auch als K-Vitamere bezeichnet. Sie unterscheiden sich vor allem durch die Länge und Sättigung der isoprenoiden Seitenkette am C3 [18].
Die wichtigsten natürlich vorkommenden K-Vitamine sind das in grünen Pflanzen enthaltene Phylloquinon (2-Methyl-3-phytyl-1,4-naphthoquinon, Phytomenadion), auch als Vitamin K1 bekannt, sowie das von Darmbakterien (z.B. Bacteroides) mit unterschiedlich langen Seitenketten gebildete Menaquinon, auch als Vitamin K2 bezeichnet. Vitamin K1 enthält eine Phytyl-Seitenkette mit 20 C-Atomen, also eine einfach ungesättigte lipophile Seitenkette mit vier Isopren-Einheiten. In Pflanzen ist Phylloquinon beispielsweise ein funktioneller und struktureller Bestandteil der Photosynthese. Vitamin K1 wird von Pflanzen und Algen synthetisiert. Es kommt dementsprechend vor allem in grünem Blattgemüse wie Grünkohl (145 µg/100 g), Rosenkohl (177 µg/100 g), Brokkoli (180 µg/100 g) und Spinat (380 µg/100 g) vor und macht etwa 90% des über die Nahrung aufgenommen Vitamin K aus. Darüber hinaus findet sich Vitamin K1 in einigen Pflanzenölen (z.B. Sojaöl: 193 µg/100 g, Rapsöl: 127 µg/100 g) und in tierischen Lebensmitteln (z.B. Leber: 5 µg/100 g, Eier: 2 µg/100 g) [17, 45, 47].
Vitamin K2 besteht aus einer Gruppe von Menaquinonen, die durch die Länge ihrer Isoprenoid-Seitenkette – einer lipophilen, mehrfach ungesättigten Seitenkette von variabler Länge – gekennzeichnet sind (Abb. 2). Ein Menaquinon mit sieben Isoprenoid-Einheiten hat man früher als Vitamin K35 bezeichnet, da eine Isoprenoid-Einheit fünf C-Atome enthält. Heute werden Menaquinone im Allgemeinen als MK-n bezeichnet, wobei n für die Anzahl der Isoprenoid-Einheiten steht. Menaquinon-4 (MK-4) und Menaquinon-7 (MK-7) sind unter präventiven und therapeutischen Aspekten die wichtigsten beiden Vertreter der Vitamin-K2-Gruppe mit vier bzw. sieben Isoprenoid-Einheiten [16-18]. Menaquinone finden sich vor allem in tierischen Lebensmitteln wie Rinderleber sowie in bakteriell fermentierten Nahrungsmitteln wie Joghurt und einigen Käsesorten (z.B. MK-8 und MK-9: 5 bis 20 µg/100 g). Die reichhaltigste Quelle für MK-7 mit 10 µg/g ist ein japanisches Gericht mit einer langen Ernährungstradition namens Natto, das aus bakteriell fermentierten Sojabohnen besteht. Das Bakterium, das im Soja MK-7 produziert heißt Bacillus subtilis natto. Die ersten schriftlichen Dokumente über Natto finden sich in dem japanischen Buch „Shin Sarugakki“ von Fujiwara no Akihira, der von 989 bis 1066 vor Christus lebte [19, 20, 42].
Der Vitamin-K-Bedarf
Der Bedarf an Vitamin K ist nicht genau bekannt und die entsprechenden Empfehlungen beziehen sich vonseiten der Ernährungsgesellschaften meist auf den hepatischen Bedarf für die Bildung von Blutgerinnungsfaktoren. Unter Einbeziehung der Plasmathrombinspiegel wird für alle Altersgruppen jenseits des Neugeborenenalters eine adäquate tägliche Vitamin-K-Zufuhr von 1 µg pro kg Körpergewicht empfohlen.
Eine aktuelle Untersuchung der Universität Maastricht, bei der 896 Blutproben gesunder Personen ausgewertet wurden, zeigt jedoch, dass obwohl alle Koagulationsproteine durch Vitamin K vollständig carboxyliert waren, bei einem Großteil der untersuchten Personen eine hohe Konzentration an uncarboxylierten γ-Carboxyglutaminsäure-Proteinen (Osteocalcin, Matrix-Gla-Protein) vorliegt. Uncarboxyliertes Osteocalcin (ucOc) und uncarboxyliertes Matrix-Gla-Protein (ucMGP) sind funktionelle Laborparameter für einen Vitamin-K-Mangel und mit einem erhöhten Risiko für Knochenfrakturen bzw. Gefäßkomplikationen assoziiert. Nach den Ergebnissen dieser Untersuchung muss davon ausgegangen werden, dass ein Großteil der Bevölkerung nicht ausreichend mit Vitamin K versorgt ist [21].
Einfluss von Vitamin K auf das Knochen- und Gefäßsystem
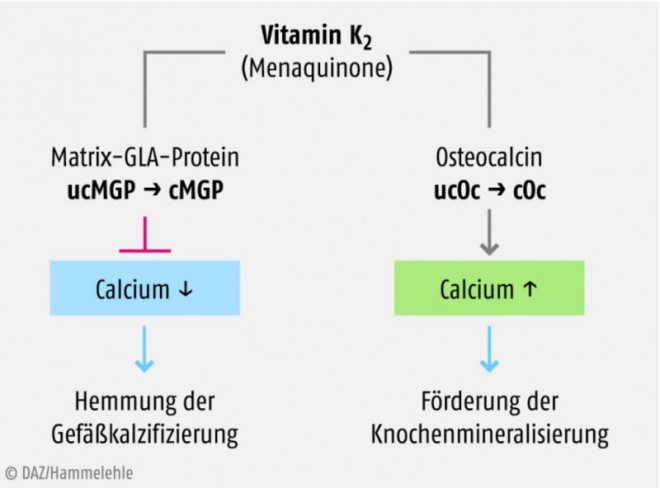
Die verschiedenen Gla-Proteine können als Folge der Vitamin-K-vermittelten γ-Carboxylierung Calcium-Ionen binden und werden hierüber aktiviert. Carboxyliertes Osteocalcin (cOc) bindet im Knochengewebe Calcium, welches mithilfe der Osteoblasten in das Hydroxylapatit des Knochens eingebaut wird. 1,25-(OH)2D3 steigert die Synthese des uncarboxylierten Osteocalcins [43]. Eine geringe diätetische Vitamin-K-Zufuhr und ein hoher Anteil an uncarboxyliertem Osteocalcin (ucOc) sind eigenständige Risikofaktoren für Hüftgelenkfrakturen [22–24, 43]. Während carboxyliertes Osteocalcin (cOc) den Einbau von Calcium in die Knochenmatrix fördert und damit den Knochenstoffwechsel unterstützt, wirkt das Vitamin-K-abhängige Matrix-Gla-Protein (cMGP) der Gefäßkalzifizierung sowie altersbedingten Verschleißerscheinungen der Arterien entgegen und schützt die Blutgefäße vor einer Calcium-Überladung (Abb. 3) [25, 26]. Es gibt zunehmend Hinweise dafür, dass der empfohlene Vitamin-K-Bedarf der Ernährungsfachgesellschaften für die γ-Carboxylierung des Osteocalcins und Matrix-Gla-Proteins durch die normale diätetische Zufuhr nicht ausreicht [21].
Weitere Anwendungsbereiche
Aufgrund seiner antientzündlichen, antioxidativen und antikanzerogenen Eigenschaften dürfte Vitamin K, vor allem das Menaquinon-7 (MK-7), bei einer Vielzahl von weiteren Erkrankungen (z.B. Krebs, Diabetes, AMD) interessant sein, dies werden Studien in den nächsten Jahren zeigen. Aufgrund seiner Strukturähnlichkeit mit Coenzym Q10 ist zudem zu vermuten, dass MK-7 in Bezug auf die Mitochondrien ein Q10-Mimetikum ist und die mitochondriale ATP-Produktion in der Atmungskette unterstützt.
K-Vitamere: Unterschiede in der Wirksamkeit
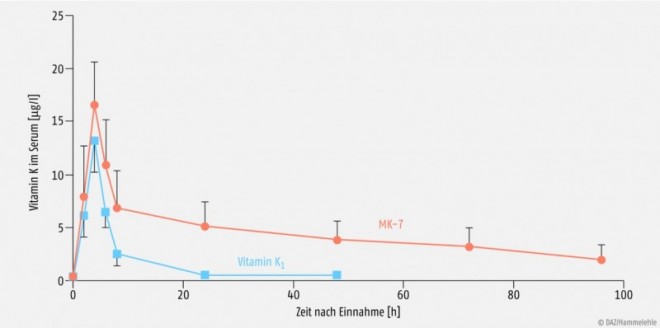
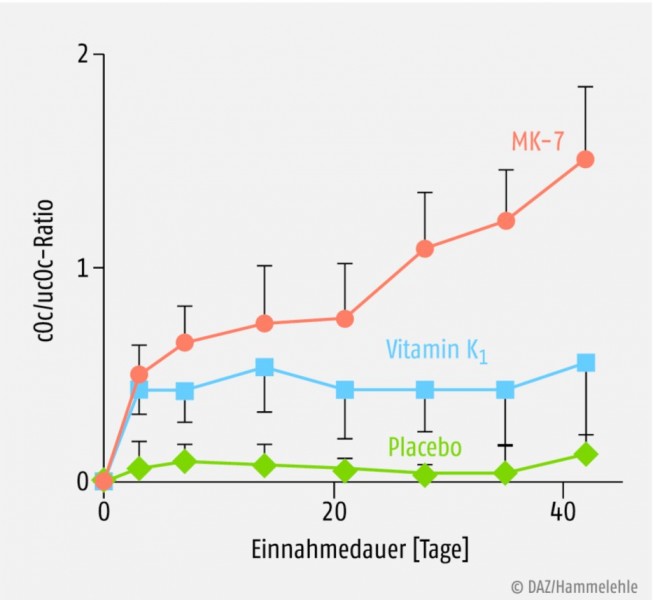
Von den verschiedenen K-Vitameren Phylloquinon und Vitamin K2 als Menaquinon-4 (MK-4) oder Menaquinon-7 (MK-7) sind als Nahrungsergänzungsmittel vor allem Vitamin K1 und Menaquinon-7 interessant. Dabei weist das aus Natto gewonnene MK-7 einige physikochemische Vorteile gegenüber dem Vitamin K1 auf. Menaquinon-7 ist aufgrund seiner Molekülstruktur lipophiler und besitzt im Vergleich zu Vitamin K1 eine deutlich längere Halbwertszeit (HWZ MK-7: drei Tage). Bei regelmäßiger Zufuhr von MK-7 resultieren daher nicht nur stabilere, sondern auch etwa sieben- bis achtfach höhere Blutspiegel. Im Vergleich zu Vitamin K1 ist die Verteilung von MK-7 in verschiedenen Geweben signifikant besser. MK-7 ist daher auch effizienter in der Carboxylierung extrahepatischer (z.B. Osteocalcin) und hepatischer Proteine (z.B. Prothrombin) (siehe Abb. 4 und 5) [48]. Im Vergleich zu MK-7 ist bei MK-4 eine orale Bioverfügbarkeit in nutritiven Dosierungen (z.B. 420 µg MK-4) nicht nachweisbar. Die in der Nahrung enthaltene geringe MK-4-Menge trägt damit auch nicht zum Aufbau des Vitamin-K-Status und Carboxylierungsgrades Vitamin-K-abhängiger Proteine bei [50].
Wechselwirkung mit Vitamin-K-Antagonisten
Aufgrund der wesentlich besseren Bioverfügbarkeit von MK-7 ist auch das Risiko für pharmakodynamische Interaktionen mit Vitamin-K-Antagonisten deutlich höher als bei Vitamin K1. Während man in Studien eine Senkung des INR-Wertes (INR-Senkung von 2 auf 1,5) bei Einnahme von Vitamin K1 > 300 µg täglich beobachten konnte, trat diese bei MK-7 bereits bei > 100 µg auf. Viele Nahrungsergänzungsmittel sind zur Zeit auf dem Markt mit einer Dosierung von 45 µg MK-7 und mehr pro Tagesdosierung. Aktuelle Dosis-Findungs-Studien der Universität Maastricht, die den Einfluss von täglich 10 µg, 20 µg und 45 µg MK-7 pro Tag auf die gerinnungshemmenden Eigenschaften von Vitamin-K-Antagonisten untersucht haben, zeigen, dass sogar bereits unter der täglichen Supplementierung von < 10 µg MK-7 eine signifikante Störung der Einstellung der Blutgerinnung auftreten kann. Die Arbeitsgruppe um Theuwissen rät daher von der Supplementierung von MK-7 bei Patienten unter einer Therapie mit Vitamin-K-Antagonisten ab [48, 49].
Fazit für die Praxis
Vitamin K – vor allem Menaquinon-7 (MK-7) – erlebt derzeit in der Gesundheitsbranche einen wahren Boom, vergleichbar mit dem Vitamin-D-Boom vor etwa drei Jahren. Unter präventiven Aspekten könnte man sich bei MK-7 an einer täglichen Zufuhrempfehlung von 0,5 bis 1,0 µg pro kg Körpergewicht orientieren, in der Therapie von Erkrankungen wie Osteoporose an täglich 2 bis 4 µg pro kg Körpergewicht. In der medizinischen und pharmazeutischen Praxis sollte man mit den Grundlagen und Besonderheiten der K-Vitamere vertraut sein, um Patienten kompetent zu beraten. Während aktuelle Studien zeigen, dass Vitamin K2 in der Prävention und Therapie von Knochen- und Gefäßerkrankungen zunehmend an Bedeutung gewinnt, bleibt das hohe Interaktionspotenzial mit Antikoagulanzien, das zu beachten ist!
Quelle
[1] Dam H, Cholesterinstoffwechsel in Hühnereiern und Hühnchen. Biochem Z, 1929; 215: 475-492.
[2] Dam H, Haemorrhages in chicks reared on artificial diets: A new deficiency disease. Nature 1934; 133: 909–910.
[3] Dam H, The antihaemorrhagic vitamin of the chick. Occurrence and chemical nature. Nature, 1935; 135:652–653.
[4] Dam H, Schonheyder F, Tage-Hansen E, Studies on the mode of action of vitamin K. Biochem J, 1936; 30:1075–1079.
[5] McKee RW, Binkley SB, MacCorquodale DW, Thayer SA, Doisy EA. The isolation of vitamins K1 and K2. J Am Chem Soc, 1939; 61: 1295.
[6] Thayer SA, McKee RW, Binkley SB, MacCorquodale DW, Doisy EA. The assay of vitamins K1 and K2. Proc Soc Exp Biol Med, 1939; 41: 194–197.
[7] Nelsestuen GL, Suttie JW. Mode of action of vitamin K. Calcium binding properties of bovine prothrombin. Biochemistry, 1972; 11(26): 4961–4964.
[8] Stenflo J, Suttie JW. Vitamin K-dependent formation of gamma-carboxyglutamic acid. Annu Rev Biochem, 1977; 46: 157–172.
[9] Esmon, C.T. and J.W. Suttie. Vitamin K-dependent carboxylase: Solubilization and properties. J Biol Chem, 1976; 251(20): 6238–6243.
[10] Lian JB, Friedman PA. The vitamin K-dependent synthesis of gamma-carboxyglutamic acid by bone microsomes. J Biol Chem, 1978; 253(19): 6623-6626.
[11] Suttie JW. Mechanism of action of vitamin K: synthesis of gamma-carboxyglutamic acid. CRC Crit Rev Biochem, 1980; 8(2): 191-223.
[12] Bell RG. Metabolism of vitamin K and prothrombin synthesis: anticoagulants and the vitamin K-epoxide cycle. Fed Proc 1978; 37(12): 2599-2604.
[13] Price PA, Urist MR, Otawara Y. Matrix Gla protein, a new gamma-carboxyglutamic acid-containing protein which is associated with the organic matrix of bone. Biochem Biophys Res Commun, 1983; 117(3): 765-771.
[14] Dowd P, Hershline R, Ham SW, Naganathan S. Vitamin K and energy transduction: a base strength amplification mechanism. Science, 1995; 269(5231): 1684-1691.
[15] Berkner KL, The vitamin K-dependent carboxylase. Annu Rev Nutr, 2005; 25: 127-149.
[16] Olson RE, The function and metabolism of vitamin K. Annu Rev Nutr, 1984; 4:281-337.
[17] Booth SL, Suttie JW. Dietary intake and adequacy of vitamin K. J Nutr, 1998; 128(5): 785-788.
18] Suttie JW, Vitamin K: In Health and Disease. CRC Press, 2009
[19] Shearer MJ, Newman P. Metabolism and cell biology of vitamin K. Thromb Haemost 2008; 100: 530-547.
[20] History of miso, soybean jiang (China), jang (Korea) and tauco/taotjo (Indonesia) (200 BC-2009): Extensively annotated bibliography and sourcebook. Compiled by Shutleff W & Aoyagi A. Soyinfo Center, Lafayette, 2009.
[21] Theuwissen E, Magdeleyns EJ, Braam LA, Vitamin K-status in healthy volunteers. Food Funct, 2014; 5(2): 229-234.
[22] Szulc P, Chapuy M-C, Meunier PJ et al. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest, 1993; 91(4): 1769-1774.
[23] Feskanich D, Weber P, Willett WC et al. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr, 1999; 69(1): 74-79.
[24] Yamauchi M, Yamaguchi T, Nawata K et al. Relationships between undercarboxylated osteocalcin and vitamin K intakes, bone turnover, and bone mineral density in healthy women. Clin Nutr, 2010; 29(6): 761-765.
[25] Braam LA, Hoeks AP, Brouns F et al. Beneficial effects of vitamin K on the elastic properties of the vessel wall in postmenopausal women: a follow-up study. Thromb Haemost. 2004; 91(2): 373-380.
[26] Vermeer C, Shearer MJ, Zittermann A, et al. Beyond deficiency: potential benefits of increased intakes of vitamin K for bone and vascular health. Eur J Nutr, 2004; 43(6):1-11.
[27] Cockayne S, Adamson J, Lanham-New S et al. Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med, 2006; 166(12): 1256-1261.
[28] Aonuma H, Miyakoshi N, Hongo M et al. Low serum levels of undercarboxylated osteocalcin in postmenopausal osteoporotic women receiving an inhibitor of bone resorption. Tohoku J Exp Med, 2009; 218(3): 201-205.
[29] Hirao M, Hashimoto J, Ando W et al. Response of serum carboxylated and undercarboxylated Osteocalcin to alendronate monotherapy and combined therapy with vitamin K2 in postmenopausal women. J Bone Miner Metab, 2008; 26 (3): 260-264.
[30] Matsumoto Y, Mikuni-Takagaki Y, Kozai Y et al. Prior treatment with vitamin K(2) significantly improves the efficacy of risedronate. Osteoporos Int, 2009; 20(11): 1863-1872.
[31] Shiraki M, Yamazaki Y, Shiraki Y et al. High level of serum undercarboxylated osteocalcin in patients with incident fractures during bisphosphonate treatment. J Bone Miner Metab, 2010; 28(5): 578-584.
[32] van Summeren MJ, Braam LA, Lilien MR, et al., The effect of menaquinone-7 (vitamin K2) supplementation on osteocalcin carboxylation in healthy prepubertal children. Br J Nutr, 2009; 102(8): 1171-1178.
[33] Geleijnse JM, Vermeer C, Grobbee DE et al., Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study. J Nutr, 2004; 134(11): 3100-3105.
[34] Dalmeijer GW, van der Schouw YT, Magdeleyns E et al. The effect of menaquinone-7 supplementation on circulating species of matrix Gla protein. Atherosclerosis, 2012; 225(2): 397-402.
[35] Caluwé R, Vandecasteele S, Van Vlem B et al. Vitamin K2 supplementation in haemodialysis patients: a randomized dose-finding study. Nephrol Dial Transplant, 2013; [Epub ahead of print].
[36] Cheung CL, Sahni S, Cheung BM et al. Vitamin K intake and mortality in people with chronic kidney disease from NHANES III. Clin Nutr, 2014; pii: S0261-5614(14)00086-7. doi: 10.1016/j.clnu.2014.03.011. [Epub ahead of print].
[37] Spronk HM, Soute BA, Schurgers LJ, et al., Tissue-specific utilization of menaquinone-4 results in the prevention of arterial calcification in warfarin-treated rats. J Vasc Res, 2003; 40(6): 531-537.
[37a] Mahtani KR1, Heneghan CJ, Nunan D, et al., Vitamin K for improved anticoagulation control in patients receiving warfarin. Cochrane Database Syst Rev, 2014; 5:CD009917[38] Knapen MH, Drummen NE, Smit E, et al., Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int, 2013; 24(9): 2499-2507.
[39] Beulens JW, van der A DL, Grobbee DE, et al., Dietary phylloquinone and menaquinones intakes and risk of type 2 diabetes. Diabetes Care, 2010; 33(8):1699-1705.
[40] Liabeuf S, Olivier B, Vemeer C et al. Vascular calcification in patients with type 2 diabetes: the involvement of matrix Gla protein. Cardiovasc Diabetol, 2014; 13(1): 85. [Epub ahead of print].
[41] Rishavy MA, Berkner KL. Insight into the coupling mechanism of the vitamin K-dependent carboxylase: mutation of histidine 160 disrupts glutamic acid carbanion formation and efficient coupling of vitamin K epoxidation to glutamic acid carboxylation. Biochemistry, 2008; 47(37): 9836-9846.
[42] Shearer, M. Vitamin K. Lancet, 1995, 345(8944): 229–234.
[43] Price PA. Role of vitamin-K-dependent proteins in bone metabolism. Annu Rev Nutr, 1988; 8: 565-583.
[44] Shearer MJ, Bach A, Kohlmeier M. Chemistry, nutritional sources, tissue distribution and metabolism of vitamin K with special reference to bone health. J Nutr, 1996; 126(4 Suppl): 1181S–1186S.
[45] Suttie, JW, The importance of menaquinones in human nutrition. Annu Rev Nutr, 1995; 15: 399–417.
[46] Suttie, JW, Synthesis of vitamin K–dependent proteins. FASEB J, 1993; 7(5): 445–452.
[47] Schurgers LJ, Vermeer C, Determination of phylloquinone and menaquinones in food. Effect of food matrix on circulating vitamin K concentrations. Haemostasis. 2000; 30(6): 298-307.
[48] Sato T, Schurgers LJ, Uenishi K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women. Nutr J, 2012; 11:93. doi: 10.1186/1475-2891-11-93
[49] Theuwissen E, Teunissen KJ, Spronk HM et al. Effect of low-dose supplements of menaquinone-7 (vitamin K2 ) on the stability of oral anticoagulant treatment: dose-response relationship in healthy volunteers. J Thromb Haemost, 2013; 11(6): 1085-1092.
[50] Sato T, Schurgers LJ, Uenishi K. Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women. Nutr J, 2012; 11:93. doi: 10.1186/1475-2891-11-93.
[51] McCabe KM, Adams MA, Holden RM, Vitamin K status in chronic kidney disease. Nutrients, 2013; 5(11): 4390-4398.
Ein neuer Allrounder?
Fragen zum Stellenwert von Vitamin K
DAZ: Herr Professor Kisters, Herr Gröber, Ihren nebenstehenden Ausführungen ist zu entnehmen, dass Sie Vitamin K eine wichtige Rolle für die Knochengesundheit und den Gefäßschutz zusprechen. Wie sieht die Datenlage aus?
Kisters: Zunächst zum Einfluss auf die Knochen: In der Nurses Health Study mit 72.327 Frauen im Alter von 38 bis 63 Jahren wurde der Einfluss der täglichen Vitamin-K-Aufnahme auf die Knochenbrüchigkeit über einen Zeitraum von zehn Jahren untersucht. Dabei zeigte sich, dass Frauen mit einer täglichen Vitamin-K-Aufnahme von ≥ 109 µg gegenüber denjenigen mit einer Aufnahme von < 109 µg ein um 30% verringertes Risiko für Hüftgelenkfrakturen hatten (RR: 0,70; 95% CI: 0,53 bis 0,93) [23]. In einer doppelblinden placebokontrollierten Studie mit 55 Jugendlichen wurde der Anteil des uncarboxylierten Osteocalcins (ucOc) durch die Supplementierung von 45 µg Vitamin K2 als Menaquinon-7 pro Tag signifikant gegenüber Placebo gesenkt sowie der Anteil am carboxylierten Osteocalcin (cOc) erhöht, was auf eine Verbesserung der Knochenmineralisierung hindeutet [32].
DAZ: Ein interessanter Hinweis, aber gibt es eindeutige Belege für eine Erhöhung der Knochendichte unter Vitamin-K-Supplementierung?
Gröber: In einer Metaanalyse von 13 randomisierten kontrollierten Studien wurde der Einfluss einer Supplementierung von Vitamin K als Vitamin K1 (1 bis 10 mg pro Tag) oder Vitamin K2 (15 bis 45 mg MK-4 pro Tag) auf die Frakturrate und die Knochendichte untersucht. Dabei konnte gezeigt werden, dass insbesondere Vitamin K2 als MK-4 im Vergleich zu Placebo das Risiko für Wirbelfrakturen um 60% (OR: 0,40; 95% CI: 0,25 bis 0,65), für Hüftfrakturen um 77% (OR: 0,23; 95% CI: 0,12 bis 0,47) und für nicht vertebrale Frakturen um 81% senkt (OR: 0,19; 95% CI: 0,15 bis 0,35). In allen ausgewerteten Studien konnte dabei bis auf eine Studie eine Verbesserung der Knochendichte durch Vitamin K1 und Vitamin K2 als MK-4 nachgewiesen werden [27].
Kisters: Erwähnenswert ist auch, dass in einer aktuellen dreijährigen placebokontrollierten Studie an 244 gesunden postmenopausalen Frauen die tägliche Supplementierung von 180 µg Vitamin K2 als MK-7 zu einer signifikanten Verbesserung der Knochendichte sowie der Knochengesundheit und der Knochenstärke führte. Der Quotient aus ucOc/cOc diente als Marker für den Vitamin-K-Status und wurde durch MK-7 deutlich verbessert [38].
Gröber: Ein weiterer interessanter Aspekt ist der, dass unter einer Therapie mit Amino-Bisphosphonaten bei Patienten mit Frakturereignissen die ucOC-Spiegel erhöht sind. In einer randomisierten Studie mit 241 postmenopausalen Frauen führte die Supplementierung von 45 mg Vitamin K2 (MK-4, Menaquinon-4) über einen Zeitraum von 24 Monaten gegenüber der Kontroll-Gruppe zu einem signifikanten Anstieg des carboxylierten Osteocalcins (cOC) sowie zu einer signifikant verringerten Frakturrate. Die ossäre Wirksamkeit der in der Osteoporosetherapie eingesetzten Bisphosphonate (z.B. Risedronat) kann durch die begleitende Supplementierung von Vitamin K2 (MK-4: 45 bis 60 mg/d) verbessert werden, wie die Ergebnisse klinischer Studien belegen [28–31].
DAZ: Einen weiteren wichtigen Einfluss soll Vitamin K auf die Gefäßkalzifizierung haben. Was sagen hier die Studien?
Kisters: In der Rotterdam-Studie, einer groß angelegten Bevölkerungsstudie mit 4807 holländischen Frauen und Männern (Alter: 55+) wurde der Einfluss des mit der Nahrung aufgenommenen Vitamin K1 und Vitamin K2 über einen Zeitraum von zehn Jahren (1990–2000) auf das Risiko einer koronaren Herzkrankheit, der Arterienverkalkung und der Gesamtsterblichkeit untersucht. Für Vitamin K1 (Aufnahme: ~250 µg/Tag) konnte man in dieser Studie keinen Schutzeffekt auf das Herz-Kreislauf-System und die Gesamtmortalität nachweisen. Durch Vitamin K2 (Aufnahme: ~25 µg/Tag) wurde das relative Risiko, an einer Herzerkrankung zu versterben, um 57% reduziert. Auch das Auftreten einer koronaren Herzkrankheit (um 41%) und die Gesamtsterblichkeit (um 36%) wurden durch Vitamin K2 deutlich gesenkt. Das Risiko für eine starke Arterienverkalkung wurde durch Vitamin K2 sogar um 52% verringert (OR: 0,48) [33].
Gröber: Carboxyliertes MGP ist ein wichtiger Inhibitor der Gefäßkalzifizierung. Uncarboxyliertes Matrix-Gla-Protein (ucMGP) ist dementsprechend ein eigenständiger Risikofaktor für Arteriosklerose. In einer aktuellen placebokontrollierten Studie führte die Supplementierung von täglich 180 µg oder 360 µg MK-7 im Vergleich zu Placebo zu einer signifikanten Reduktion des uncarboxylierten MGP um 31% bzw. 46% [34]. Dialysepatienten haben aufgrund einer vorzeitigen Gefäßverkalkung ein hohes kardiovaskuläres Risiko. Bei den Betroffenen sind häufig erhöhte Spiegel an uncarboxyliertem MGP als Zeichen einer unzureichenden diätetischen Aufnahme von Vitamin K nachweisbar. In einer aktuellen Studie mit Dialysepatienten konnte man durch die Supplementierung von 360 µg, 720 µg oder 1080 µg MK-7 dreimal pro Woche über einen Zeitraum von acht Wochen den Anteil des inaktiven Matrix-Gla-Proteins signifikant um 17%, 33% bzw. 46% senken [35, 36]. Danach muss davon ausgegangen werden, dass das individuelle kardiovaskuläre Risiko bei Herz-Kreislauf- und Dialysepatienten durch die Supplementierung von Vitamin K2 verbessert werden kann.
DAZ: Sind hierzu entsprechende Studien in Planung bzw. schon auf dem Weg?
Gröber: In Bezug auf Nierenerkrankungen und Hämodialyse werden derzeit die Ergebnisse zweier randomisierter Studien aus Europa (VitaVasK-Studie) und Kanada (iPACK-HD-Studie) mit Spannung erwartet [51].
DAZ: Vitamin K wird auch von Ihnen als Allrounder wie Vitamin D propagiert. Für welche Patienten kann es von Nutzen sein?
Gröber: Die protektiven Wirkungen von Vitamin K2 bei Gefäßerkrankungen machen es auch interessant bei Patienten mit Diabetes mellitus. Erhöhte Spiegel an uncarboxyliertem MGP sind auch bei Diabetikern mit einem gesteigerten Risiko der Gefäßverkalkung verbunden. Darüber hinaus zeigt eine aktuelle placebokontrollierte Studie an 42 gesunden Männern, dass die Supplementierung von 30 mg Vitamin K2 als MK-4 (dreimal täglich), im Vergleich zu Placebo über die Aktivierung von Osteocalcin (ucOc → cOc) die Insulin-Produktion und Insulin-Empfindlichkeit der Zellen, die sogenannte Insulin-Sensitivität, verbessert. Carboxyliertes Osteocalcin (cO) scheint ein körpereigenes Hormon zu sein, welches auch den Insulin-Stoffwechsel verbessert [35, 36]. Bemerkenswert sind auch die Ergebnisse aus Tierversuchen, in denen man nachweisen konnte, dass sich in der Arterienwand dreimal mehr Vitamin K2 (MK-4) anreichert als Vitamin K1. Dabei konnte man auch eine durch Warfarin ausgelöste Arterienverkalkung vollständig durch Vitamin K2 nicht aber durch Vitamin K1 verhindern. Vitamin K2 scheint aufgrund seiner Isoprenoid-reichen Struktur auch einen günstigen Effekt auf die Cholesterinwerte zu haben [37].
DAZ: Kann man tatsächlich von nachgewiesenen protektiven Wirkungen des Vitamin K sprechen? Ihre letzten Ausführungen sind ja eher hypothetischer Natur. Was kann man denn jetzt guten Gewissens empfehlen, wie sollte man vorgehen?
Kisters: In Bezug auf die Ergebnisse zur Gefäßkalzifizierung bei kardiovaskulären Erkrankungen kann man eine begleitende Supplementierung von 2 bis 4 µg MK-7 pro Tag bzw. als labordiagnostischen Parameter die Messung der carboxylierten Matrix-Gla-Proteine empfehlen. Bei Patienten, die mit Vitamin-K-Antagonisten therapiert werden, sollte man in jedem Fall streng die INR-Werte kontrollieren und gegebenenfalls muss der INR-Wert bei zusätzlicher Einnahme von Vitamin K angepasst werden. Eine aktuelle Cochrane-Analyse zum Einfluss von Vitamin K auf eine Therapie mit Warfarin gibt Hinweise darauf, dass die Vitamin-K-Supplementierung (z.B. 150 µg Vitamin K/d) einen günstigen Effekt auf die Stabilität einer Antikoagulationstherapie mit Warfarin hat. Derzeit liegen aber noch zu wenige Studienergebnisse vor, um hier eine allgemeine Empfehlung auszusprechen. Qualitativ größere Studien müssen in den nächsten Jahren zeigen, ob Patienten unter Warfarin oder Phenprocoumon von einer begleitenden Therapie mit Vitamin K profitieren. Auch die Vitamin-Form als Phylloquinon, Menaquinon-4 und Menaquinon-7 muss dabei spezifiziert werden [37a].
DAZ: Wenn man Ihren Ausführungen folgt, dann haben ja Vitamin K und Vitamin D ganz oft ähnliche protektive Wirkungen. Beide dienen der Knochengesundheit, sollen eine wichtige Rolle bei Krebs, Diabetes und weiteren chronischen Erkrankungen spielen. Wie lautet denn jetzt Ihre Empfehlung? Wann sollten diese „Allrounder“ eingenommen werden. Was ist im Vorfeld zu klären?
Gröber: Vitamin D und Vitamin K wirken im Hinblick auf die Bildung und Carboxylierung des Osteocalcins synergistisch. Es macht durchaus Sinn, beide Vitamine in der Prophylaxe und Therapie der Osteoporose zu kombinieren. Empfehlenswert ist zur labormedizinischen Abklärung die Messung des 25-OH-D-Status und des carboxylierten Osteocalcins. Ob bei einer Supplementierung von Vitamin D3 grundsätzlich auch Vitamin K gegeben werden sollte, ist derzeit nicht hinreichend untersucht. Auch in den großen Studien zur Senkung der allgemeinen und kardiovaskulären Mortalität durch Vitamin D wurde der Einflussfaktor Vitamin K nicht erfasst. Behauptungen, die teilweise in populärwissenschaftlichen Büchern zu Vitamin K2 oder bei Youtube zu finden sind, dass bei einer Einnahme von 8000 IE Vitamin D3 pro Tag zusätzlich 1000 µg MK-7 eingenommen werden müssen oder dass bei 1000 IE Vitamin D3 pro Tag zusätzlich 100 bis 200 µg MK-7 erforderlich sind, sind nicht hinreichend belegt, darin sind sich führende Vitamin-D-Forscher aus den USA um Prof. Dr. med. Michael F. Holick von der Universität Boston einig. Hier müssen die Ergebnisse aus Studien in den nächsten Jahren, in denen die Wechselwirkung von Vitamin D und Vitamin K bei verschiedenen Krankheitsbildern untersucht werden, für Klarheit sorgen.
DAZ: Herr Gröber, Herr Professor Kisters, wir danken für das Gespräch.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.