
- DAZ.online
- DAZ / AZ
- DAZ 11/2014
- Was darf man bei Gicht ...
Ernährung
Was darf man bei Gicht essen?
Ernährungsmedizinische Aspekte – jenseits von Fleischverzicht und Alkoholabstinenz
Eine Krankheit mit Geschichte
Krankheit der Reichen. Gicht war unter dem Namen Podagra („Fußfessel“) bereits im Altertum bekannt; die deutsche Bezeichnung „Gicht“ geht auf das althochdeutsche gi-giht[e] mit der Bedeutung „Besprechung, Behexung“ zurück [1]. Damit bezeichnete man alle Arten von Gliederschmerzen und Lähmung, deren Ursache unbekannt war und die man deshalb bösen Zaubersprüchen zuschrieb. Doch bereits im 18. Jahrhundert tauchen Hinweise auf realere Krankheitsursachen auf, so die „übertriebene Eßlust auf beschwerliche Speisen“ und das „höchst übertriebene Weintrinken“ [2]. Der auch medizinischen Laien offensichtliche Zusammenhang zwischen ausgiebigem Fleischkonsum und der Gichterkrankung führte bald dazu, dass die Gicht als „Krankheit der Reichen“ galt – denn nur sehr wohlhabende Zeitgenossen konnten sich den exzessiven Fleisch- und Alkoholkonsum leisten. Und so zählen zu den prominenten Gicht-Patienten auch Ludwig XIV., die meisten Hohenzollern- Könige, Wallenstein, Goethe und Bismarck.
Pathogenese. Die pathophysiologisch entscheidende Substanz der Gicht-Erkrankung ist die Harnsäure als natürliches Abbauprodukt der Purinbasen Adenin und Guanin; hierbei handelt es sich um körpereigene Substanzen, die andererseits aber auch durch purinreiche Nahrung zugeführt werden können. Der letzte Schritt des Purin-Abbaus besteht in der enzymatischen Umsetzung von Xanthin bzw. Hypoxanthin durch die Xanthinoxidase zum renal ausscheidungsfähigen Endprodukt, der Harnsäure [3]. Die renale Harnsäure-Ausscheidung findet in drei Phasen statt: Zunächst wird die Harnsäure mit dem Primärharn gefiltert, danach über verschiedene Transporter im proximalen Tubulus sezerniert und schließlich über passive Resorption im proximalen Tubulus ausgeschieden. Entscheidend für die renale Ausscheidungsfähigkeit der Harnsäure sind die beiden Transporterproteine hURAT1 (humaner Urat1-Transporter) und SCL 2A9 (Fructose-Transporter) [4, 5].
Abhängig von genetischen Polymorphismen ist die Ausscheidungsleistung dieser Transportproteine individuell sehr unterschiedlich [6], ebenso das Ausmaß der Harnsäure-Rückresorption [7, 8]. Die pathophysiologische Ursache der Gicht-Erkrankung ist in ca. 98% der Fälle eine genetisch bedingte Harnsäure-Ausscheidungsstörung der Nieren [9]. In diesem Fall ist das Ausscheidungssystem bereits unter physiologischen Bedingungen nahezu ausgelastet, sodass eine erhöhte exogene Purin-Zufuhr mit der Nahrung und/oder eine weitere Hemmung der renalen Sekretionsleistung direkt zu kritischen Harnsäure-Spiegeln führt [10]. Überschreitet die Konzentration der Harnsäure in Abhängigkeit von pH-Wert und Temperatur das Löslichkeitsprodukt, kann sie in Form von Natriumurat-Kristallen ausfallen [3]. Das klinische Bild dieser Situation ist der Gicht-Anfall, der durch äußerst schmerzhafte, lokale Entzündungsreaktionen gekennzeichnet ist [6].
Gicht-Diät. Aus der Pathophysiologie der Gicht ergeben sich direkt die bekannten Diäthinweise, die sich von „streng purinarm“ über „purinarm“ [11] bis hin zur längerfristigen Senkung der Harnsäure-Konzentration „durch Gewichtsreduktion und mehr pflanzliche Kost“ [12] erstrecken. Im Mittelpunkt der Gicht-Diät stehen entsprechend Purin-reiche Lebensmittel wie Fleischgerichte, Innereien, Fleischextrakte und Fisch. Doch hoher Fleischkonsum ist nicht der einzige relevante Ernährungsfaktor: In einer schwedischen Studie wurden die Harnsäure-Spiegel von durchschnittlich ernährten Schweden mit jenen von Kitava-Ureinwohnern in Papua-Neuguinea verglichen, die als naturnah lebendes Volk besonders viel purinreiche tierische Lebensmittel verzehren [13]. Überraschenderweise wiesen die Kitava-Männer niedrigere Harnsäure-Spiegel auf als die schwedische Vergleichspopulation. Bei der anschließenden Auswertung wurde deutlich, welche Nahrungsmittel neben den tierischen Produkten ebenfalls relevante Risikofaktoren für Hyperurikämie und Gicht darstellen: Bier, Spirituosen und: Fructose.
Da derzeit in Deutschland keine S3-Leitlinie zu Therapie und Management von Hyperurikämie und Gicht vorliegt, folgen sowohl die Arzneimittel- als auch die Ernährungstherapie überwiegend Expertenmeinungen – im besten Fall der S1-Handlungsempfehlung der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin (DGAM) [14]. Auf europäischer Ebene gibt es die Empfehlungen der European League Against Rheumatism (EULAR) [15] und die Leitlinien der British Society for Rheumatology (BSR) [16], die zwar auf umfassenden Evidenzanalysen der aktuellen internationalen Datenlage beruhen, dennoch aber nicht dem Standard von S3-Leitlinien entsprechen. Das Fehlen einer deutschen evidenzbasierten Leitlinie kann als Indiz dafür gelten, dass eine Hyperurikämie häufig als nicht therapiebedürftig eingeschätzt wird [17].
Sowohl in den S1-Handlungsempfehlungen als auch in den europäischen Leitlinien wird, neben der obligaten Pharmakotherapie, eine „Anpassung von Lebensstil-Faktoren“ empfohlen. Moderne diätetische Maßnahmen als Teil des Lebensstil-Konzeptes bei Gicht sollten folgende Ziele verfolgen [12]:
- Anfallsprophylaxe durch das Vermeiden diätetischer Auslöser
- gesteigerter Verzehr von Lebensmitteln mit antiphlogistischem Potenzial
- langfristige Ernährungsumstellung auf Harnsäure-senkende Lebensmittel
- langfristige Ernährungsumstellung zur Reduktion metabolischer und kardiovaskulärer Risiken
In der Praxis bedeutet dies, dass es einerseits kritische Lebensmittel gibt, die zur Gicht-Prophylaxe und bei manifester Gicht zur Anfallsprophylaxe gemieden werden sollten; andererseits stellen zahlreiche Lebensmittel auch protektive nutritive Faktoren dar, die den Harnsäure-Spiegel senken und das Anfallsrisiko reduzieren.
Kritische Lebensmittel
Fleisch. Hoher Fleischverzehr ist die bekannteste und häufigste Ursache für die Entstehung der Gicht. Grund dafür ist der hohe Purin-Gehalt. Zusätzlich ist Fleisch häufig reich an gesättigten Fettsäuren, was den Lipid-Stoffwechsel ungünstig beeinflusst und zu gesteigerter Insulin-Resistenz beiträgt – wodurch die Harnsäure-Konzentration im Blut weiter erhöht wird [18]. Anders als früher häufig empfohlen gilt jedoch nicht mehr, dass die Zufuhr tierischer und pflanzlicher Proteine grundsätzlich reduziert werden sollte; im Gegenteil sind insbesondere Nüsse und Hülsenfrüchte durchaus empfehlenswert, da sich deren Zusammensetzung auch bei Gicht-Patienten günstig auf das kardiovaskuläre Risiko auswirkt [18, 19].
Fisch. Wie auch Fleisch sind viele Fische reich an Purinen und erhöhen bei Gicht-Patienten die Wahrscheinlichkeit eines Anfalls. Andererseits sind aber gerade fette Fische reich an Omega-3-Fettsäuren, von deren kardioprotektiven Wirkungen auch Gicht-Patienten in besonderem Maße profitieren können [19]. Moderater Fettfischkonsum (einmal pro Woche; Makrele, Lachs oder Hering) kann also durchaus möglich und sinnvoll sein, wenn die übrigen diätetischen Maßnahmen eingehalten werden. Kommt es jedoch bereits nach gelegentlichem Fischkonsum zu Gicht-Anfällen, kann die vermehrte Zufuhr an Omega-3-Fettsäuren auch durch pflanzliche Öle (z.B. Leinöl, Rapsöl) oder durch Supplemente sichergestellt werden [19].
Alkohol. Dass alkoholische Getränke ebenso wie purinreiche tierische Lebensmittel zur Entstehung von Hyperurikämie beitragen, ist lange bekannt. Bereits ein Glas Bier pro Tag erhöht bei Gicht-Patienten das Anfallsrisiko um 30%; bei höherem Alkoholkonsum steigt die Anfallsrate noch drastischer an [20]. Acetat als Endprodukt des physiologischen Alkohol-Abbaus dient als Vorstufe von Adenosin, was ebenfalls in den Purin-Abbau eingeht [3]. Weiterhin fördert Alkohol den anaeroben Glucose-Stoffwechsel und hemmt die renale Harnsäure-Ausscheidung am proximalen Tubulus [21]. Diese Gicht-fördernden Effekte von Alkohol gelten vor allem für regelmäßig hohen Alkoholkonsum oder für gelegentliche Alkohol-Exzesse („Familienfeier“), die dann kurzfristig Gicht-Anfälle auslösen können.
Es gibt jedoch deutliche Unterschiede hinsichtlich der Art des alkoholischen Getränks: Besonders ungünstig ist der Effekt von Bier, denn hier kommen zu den ungünstigen Alkohol-Effekten noch die Nachteile einer hohen Purin-Belastung (vor allem Guanosin) im Hefeanteil hinzu [12]. Ähnlich ungünstig sind aufgrund des hohen Alkoholgehalts Spirituosen. Dagegen scheint ein regelmäßiger moderater Wein-Konsum (maximal ein Glas/Tag, möglichst trockener Wein) das Gicht-Risiko nicht oder nur minimal zu erhöhen. Mitunter wird sogar die Meinung vertreten, dass gerade Gicht-Patienten keine strenge Wein-Abstinenz einhalten sollten, um nicht auf die kardioprotektiven Wirkungen von regelmäßig geringen Mengen Rotwein zu verzichten – denn bereits die Hyperurikämie stellt einen kardiovaskulären Risikofaktor dar [20].
Fructose – Gicht durch Fruchtsäfte? Für viele Menschen – auch in den Gesundheitsberufen – ist die Gicht eine vermeintlich „altmodische“ Erkrankung, über die alles bekannt ist. Sie erscheint als Sinnbild von Völlerei und ungezügeltem Fleisch- und Bierkonsum früherer Zeiten. Doch erstaunlicherweise ist die Gicht auf dem Vormarsch: So hat sich ihre Prävalenz in Europa seit den 70er Jahren verdreifacht und beträgt derzeit 1 bis 2% aller Erwachsenen [22]. Die Ursache dieses Anstiegs war lange unklar, denn der Fleisch- und Alkoholkonsum hat in den vergangenen Jahrzehnten nicht entsprechend zugenommen. Nun mehren sich die Hinweise darauf, dass für die Prävalenzzunahme der Gicht der stark gestiegene Fructosekonsum verantwortlich ist.
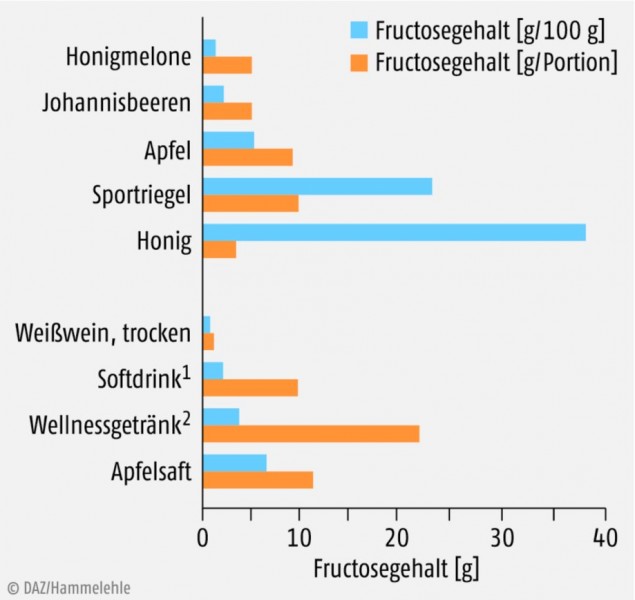
Anders als man vermuten könnte, ist nicht der tägliche Obstkonsum die nutritive Hauptquelle für Fructose, sondern der industrielle Einsatz von Fruchtzucker als Süßungsmittel in zuckerhaltigen Softdrinks und Multivitaminsäften, auf die ein bedeutender Anteil der täglichen Kalorienzufuhr entfällt [23]. Es ist kaum bekannt, dass Süßgetränke immer häufiger mit Fructose oder mit einem Fructose-angereicherten Maissirup (high-fructose corn syrup, HFCS) gesüßt werden, da die Süßkraft höher und die Produktionskosten geringer als bei Tafelzucker sind. Eine weitere versteckte Hauptquelle für Fructose sind Müsliriegel, Joghurterzeugnisse, Eis und Süßigkeiten [19]. So ist der Fructose-Gehalt eines „Sportriegels“ ca. viermal so hoch wie der eines Apfels (Abb.).
Außerdem gibt es den anhaltenden Trend, Glucose als Hauptzucker aus Haushalt und industriell gefertigten Lebensmitteln zu verbannen und durch den vermeintlich gesünderen, weil Zahn-schonenden und „natürlicheren“ Fruchtzucker zu ersetzen.Die maßgebliche Bedeutung des Fruchtzuckers für die Pathogenese der Gicht ist noch nicht lange bekannt, dabei ist Fructose das einzige Kohlenhydrat mit einem direkten Effekt auf die Harnsäure: Bereits wenige Minuten nach dem Konsum Fructose-haltiger Getränke steigt die Harnsäure-Konzentration in Blut und Urin an [24]. Ursache dafür ist der physiologische Fructose-Metabolismus im Körper: Dieser erfolgt unter Verbrauch von Adenosintriphosphat (ATP), was stark vereinfacht zur Steigerung der körpereigenen Purin-Synthese führt. Außerdem wird das durch vermehrten ATP-Verbrauch anfallende Adenosinmonophosphat (AMP) in den regulären Purin-Abbau eingeschleust [3]. Ähnlich wie Alkohol hemmt Fructose zusätzlich die renale Harnsäure-Ausscheidung [25].
Besonders ausgeprägt ist dieser Effekt bei Menschen, deren Harnsäure-Spiegel bereits erhöht ist [26, 27]. 2008 konnte in einer großen prospektiven Beobachtungsstudie an über 46.000 Männern gezeigt werden, dass die negative Wirkung von Fructose auf die Harnsäure mindestens so stark ist wie der längst bekannte Effekt von Alkohol [23]. So erhöht bereits ein Fructose-haltiges Süßgetränk pro Tag bei gesunden Menschen das Gicht-Risiko um 45%; Gicht-Patienten oder Menschen mit bereits bestehender Hyperurikämie sollten Fructose-haltige Getränke daher erst recht meiden [23]. Doch auch indirekt wirkt sich Fructose ungünstig auf die Gicht-Prognose aus: Erhöhte Fructose-Zufuhr bedeutet automatisch erhöhte Kalorienzufuhr, was zu erhöhten Insulin-Spiegeln, Insulin-Resistenz und Gewichtszunahme führt – sämtlich Faktoren, die ebenfalls zur Steigerung des Harnsäure-Spiegels beitragen [28]. Selbstverständlich sind auch in reifem Obst teilweise hohe Fructose-Konzentrationen enthalten, doch anders als bei der Aufnahme industriell gefertigter Fructose-haltiger Softdrinks überwiegen die Vorteile einer obstreichen Ernährung zur Prävention zahlreicher Erkrankungen die Nachteile einer erhöhten Fructose-Zufuhr in jedem Fall.
Fazit für die Praxis
Ernährungshinweise bei Gicht
Konsum einschränken/vermeiden
- purinreiche tierische Lebensmittel (Fleisch, Geflügel) nur in geringen Mengen
- Fisch und Meerestiere nur einmal pro Woche wählen, dabei auf eine vermehrte Zufuhr von Omega-3-Fettsäure-reichen Fischsorten (z.B. Lachs, Makrele, Hering) achten
- Hülsenfrüchte und Sojaprodukte in Maßen unbedenklich (bis zu 2 Portionen/Woche)
- auf Bier und Spirituosen verzichten, trockener Wein in geringen Mengen möglich
- auf mit Fructose/Fructose-Sirup gesüßte Getränke möglichst vollständig verzichten
- kilokalorien-bedarfsgerecht essen und trinken
- bei Übergewicht/Adipositas Gewicht reduzieren (CAVE: maximal 1 kg/Monat; raschere Gewichtsabnahme kann Gicht-Anfälle provozieren!)
Konsum empfohlen
- fettreduzierte Milch- und Milchprodukte
- eiweißreiche pflanzliche Lebensmittel (z.B. Getreideprodukte, -flocken) bevorzugen
- Kaffee in moderaten Mengen (unabhängig davon, ob mit oder ohne Coffein)
- Vitamin C (ab 500 mg/d)
Protektive Faktoren
Kaffee. In den letzten Jahren rückten bei den diätetischen Empfehlungen für Gicht-Patienten Lebensmittel in den Blickpunkt, deren Inhaltsstoffen protektive Eigenschaften zugesprochen werden. Ein Beispiel hierfür ist Kaffee. Bei dem enthaltenen Coffein handelt es sich um ein Xanthin, das ebenfalls eine Purin-Quelle darstellt; deshalb wurde Gicht-Patienten lange grundsätzlich von Kaffee abgeraten. Inzwischen hat sich aber gezeigt, dass dies nicht notwendig ist, im Gegenteil: In Beobachtungsstudien konnte gezeigt werden, dass ein hoher Kaffeekonsum mit niedrigen Harnsäure-Spiegeln assoziiert ist [29, 30]. Klinisch zeigte sich in den Untersuchungen, dass Männer, die regelmäßig vier bis fünf Tassen Kaffee pro Tag konsumierten, ein um 40% reduziertes Gicht-Risiko im Vergleich zu Männern hatten, die keinen Kaffee tranken [29]. Diese Beobachtung führte zu der Hypothese, dass das Coffein möglicherweise wie Allopurinol die Xanthinoxidase hemmen und so die physiologische Harnsäure-Produktion bremsen könnte. Dagegen spricht allerdings, dass das Gicht-Risiko auch bei Kaffeetrinkern reduziert ist, die ausschließlich Coffein-freien Kaffee trinken, während umgekehrt Coffein-haltiger Tee keinen protektiven Effekt besitzt. Dies deutet darauf hin, dass nicht das Coffein, sondern andere Inhaltsstoffe des Kaffees – wie z.B. die Chlorogensäuren – für die Harnsäure-senkende Wirkung verantwortlich sind.
Milchprodukte. Die Anfallshäufigkeit kann bei Gicht-Patienten durch den täglichen Verzehr von Magermilchprodukten deutlich reduziert werden; dies gilt für fettreduzierte Joghurts und ist bereits für eine Menge von 250 ml Magermilch pro Tag signifikant [18]. Der Harnsäure-senkende Effekt kommt dabei vermutlich durch die enthaltenen Proteine Casein und Lactalbumin zustande, für die ein urikosurischer Effekt belegt ist. Bei fettreduzierten Joghurts ist dieser positive Effekt jedoch meist nur bei Naturjoghurts vorhanden, da Fruchtzubereitungen inkl. hoher Fructose-Anteile die Harnsäure-senkende Wirkung der Milchproteine konterkarieren und in der Summe eher ungünstig wirken.
Vitamin C. Ascorbinsäure (Vitamin C) besitzt ab Dosierungen von 500 mg/d einen urikosurischen Effekt am proximalen Tubulus und fördert die renale Harnsäure-Ausscheidung außerdem durch eine gesteigerte glomeruläre Filtrationsrate [3]. Der klinische Vorteil der entsprechenden Vitamin-C-Zufuhr konnte auch in placebokontrollierten Studien belegt werden: So reduziert die tägliche Gabe von 500 mg Vitamin C das Gicht-Risiko um 20%, die Gabe von 1500 mg um bis zu 50% [31]. Dies sind allerdings Dosierungen, die realistisch nicht über die Nahrung, sondern nur durch Nahrungsergänzungsmittel erreicht werden können.
Quelle:
[1] Rudolf Schützeichel. Althochdeutsches Wörterbuch. 7. Auflage, de Gruyter 2012.
[2] Niederhuber I. Sydenhams Abhandlung von dem Podagra, übersetzt und mit Anmerkungen beleuchtet. Landshut, 1791.
[3] Choi HK, Mount DB, Reginato AM. American College of Physicians; American Physiological Society: Pathogenesis of gout. Ann Intern Med 2005; 143: 499–516.
[4] Unger S, Tausche AK, Kopprasch S et al. Molecular basis of primary renal hyperuricemia: role of the human urate transporter hURAT1. Z Rheumatol 2007; 66: 58–61.
[5] Graessler J, Graessler A, Unger S et al. Association of the human urate transporter 1 with reduced renal uric acid excretion and hyperuricemia in a German Caucasian population. Arthritis Rheum 2006; 54: 292–300.
[6] Tausche AK, Jansen T, Schröder HE et al. Gicht – aktuelle Aspekte in Diagnostik und Therapie. Dtsch Ärzteblatt 2009; 106: 34–35.
[7] Riede UN, Schäfer HE, Werner M (Hrsg.) Allgemeine und spezielle Pathologie. 5. vollst. überarbeitete Auflage, Thieme, Stuttgart 2004.
[8] Kedar E, Simkin PA. A perspective on diet and gout. Adv Chronic Kidney Dis 2012; 19: 392–397.
[9] Köttgen A, Albrecht E, Teumer A et al. Genomewide association analyses identify 18 new loci associated with serum urate concentrations, Nat Genet 2013; 45: 145–154.
[10] Arasteh K, Baenkler HW, Bieber C. Duale Reihe Innere Medizin. 2. vollständig überarbeitete und erweiterte Auflage. Thieme Stuttgart 2009.
[11] Kluthe R, Dittrich A, Everding R et al. Das Rationalisierungsschema 2004 des Bundesverband Deutscher Ernährungsmediziner e.V. (BDEM), Deutsche Adipositas Gesellschaft e.V., Deutsche Akademie für Ernährungsmedizin e.V. (DAEM), Deutsche Gesellschaft für Ernährung e.V. (DGE), Deutsche Gesellschaft für Ernährungsmedizin e.V. (DGEM), Verband der Diätassistenten – Deutscher Bundesverband e.V. (VDD), Verband der Diplom-Oecotrophologen e.V. (VDOE) Akt Ernaehrungsmed 2004; 29: 245–253.
[12] Forster A, Krebs A. Gicht: Die traditionelle purinarme Diät ist out: Entzündliche rheumatische Erkrankungen und Ernährung Schweizer Zeitschrift für Ernährungsmedizin 2013; 11: 20–24.
[13] Lindeberg S, Cordain L, Rastam L et al. Serum uric acid in traditional Pacific Islanders and in Swedes. J Intern Med 2004; 255: 373–378.
[14] Engel B, Prautzsch H. Akute Gicht in der hausärztlichen Versorgung. DEGAM S1-Handlungsempfehlung, www.degam.de/files/Inhalte/Leitlinien-Inhalte/Dokumente/S1-Handlungsempfehlung/S1-HE_akute%20Gicht_Kurzfassung.pdf. Zugriff: 28.02.2014
[15] Zhang W, Doherty M, Pascual E et al. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65: 1301–1311.
[16] Jordan KM, Cameron JS, Snaith M et al. British Society for Rheumatology and British Health Professionals in Rheumatology Guideline for the Management of Gout. Rheumatology (Oxford) 2007; 46:1372–1374.
[17] Junker W. Gicht – die „vergessene“ Erkrankung trotz vieler therapeutischer Optionen. Leserbrief: Zum Beitrag aus der DMW Nr. 33 Dtsch Med Wochenschr 2011; 136: 1660–1664.
[18] Choi HK, Atkinson K, Karlson EW et al. Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men. N Engl J Med 2004; 350: 1093–1103.
[19] Choi HK. A prescription for lifestyle change in patients with hyperuricemia and gout. Curr Opin Rheumatol 2010; 22: 165–172.
[20] Choi HK, Atkinson K, Karlson EW et al. Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2004; 363:1277–1281.
[21] Horn F. Biochemie des Menschen. Das Lehrbuch für das Medizinstudium. 4. aktualisierte und erweiterte Auflage. Thieme. Stuttgart 2009.
[22] Wülfer A. Epidemiologie der Hyperurikämie und Gicht. Ars medici 2006; 19: 916–917.
[23] Choi HK. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study. BMJ 2008; 336: 309.
[24] Fox IH, Kelley WN. Studies on the mechanism of fructose-induced hyperuricemia in man. Metabolism 1972; 21: 713–721.
[25] Johnson RJ, Segal MS, Sautin Y. Potential role of sugar (fructose) in the epidemic of hypertension, obesity and the metabolic syndrome, diabetes, kidney disease, and cardiovascular disease. Am J Clin Nutr 2007; 86: 899–906.
[26] Stirpe F, Della Corte E, Bonetti E et al. Fructose-induced hyperuricaemia. Lancet 1970; 2: 1310–1311.
[27] Choi HK, Willet W, Curhan G. Fructose-rich beverages and risk of gout in women. JAMA 2010; 304: 2270–2278.
[29] Choi HK, Willet W, Curhan G. Coffee consumption and risk of incident gout in men: a prospective study. Arthritis Rheum 2007; 56: 2049–2055.
[30] Traindl O, Gicht und Ernährung. rheuma plus 4/2012. Online : www.springermedizin.at/artikel/31901-gicht-und-ernaehrung Zugriff: 28.02.2014
[31] Choi HK, Gao X, Curhan G. Vitamin C intake and the risk of gout in men: a prospective study.Arch Intern Med 2009; 169: 502–507.
[32] Bundesministerium für Ernährung und Landwirtschaft (BMEL), ehemals Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz (BMELV) Bundeslebensmittelschlüssel. Bundeslebensmittelschlüssel (BLS) Version 3.01 www.bls.nvs2.de/. Zugriff 28.02.2014.
Autoren
Prof. Dr. rer. nat. Martin Smollich, Fachapotheker für Klinische Pharmazie, Antibiotic Stewardship-Experte (DGI). 1998 bis 2004 Studium von Biologie und Pharmazie in Münster und Cambridge (UK), 2005 bis 2008 wissenschaftlicher Mitarbeiter an der Universitätsfrauenklinik Münster und Promotion über ein Thema zur experimentellen Pharmakotherapie des Mammakarzinoms, 2009 bis 2013 klinische Tätigkeit und pharmakologischer Konsildienst. Seit 2013 Professor und Studiengangsleiter des Studiengangs Clinical Nutrition/Ernährungsmanagement an der Mathias Hochschule Rheine.
Wissenschaftliche Schwerpunkte:
Klinische Ernährung, Klinische Pharmakologie, Arzneimitteltherapiesicherheit und rationale Antiinfektiva-Therapie.
Dipl. med. päd. Birgit Blumenschein, Diätassistentin, 1988 bis 1990 Ausbildung zur staatlich anerkannten Diätassistentin, 1996 bis 2002 Lehrassistentin an medizinischer Fachschule, Fachbereich Diätassistenz, 1997 bis 2003 Studium der Medizinpädagogik an der Charité in Berlin. Seit 2003 selbstständig tätig in eigener Praxis, seit 2011 wissenschaftliche Mitarbeiterin an der Mathias Hochschule Rheine, Studiengangskoordinatorin des Studiengangs Clinical Nutrition/ Ernährungsmanagement, B.Sc.
Wissenschaftliche Schwerpunkte:
Ernährungsmedizin mit den Schwerpunkten Gastroenterologie, Stoffwechsel und Adipositas; Gesundheitsbildung, Betriebliches Gesundheitsmanagement.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.